【テクニカルレポート】新規組織化学染色脱色法
本記事は、和光純薬時報 Vol.87 No.4(2019年10月号)において、麻布大学獣医学部 解剖学第二研究室 小澤 秋沙様に執筆いただいたものです。
本法は組織化学染色として臨床検査及び研究で最も汎用されているヘマトキシリン・エオジン(HE)染色またはマッソン・トリクローム(MT)染色で染色された組織切片を脱色し、他の染色への再利用を可能にする方法である。
これまで1つの組織化学染色につき最低組織切片1 枚を用いることが一般的であり、そのため組織化学染色の方法の数だけの組織切片を用意することが必要である。しかし、組織切片作製には手技の熟練及び組織サンプルの状態・大きさ等多数の要因によって評価に適した複数の組織切片を揃えることが困難な場合がある。また、同一細胞の評価をする場合は隣接した切片を用いる方法が一般的だが、たとえ隣接の組織切片が適切に得られたとしても、観察したい同一の組織構造や同一の細胞内構造が2 つの隣接した組織切片にまたがって存在していないこともある。
そのような場合には、すでに観察したい特徴を持った細胞や構造があることがわかっている組織切片の再利用は大変有用である。HE 染色は組織の大まかな特徴を捉えるために最初に行われる代表的な染色法の1つであり、HE 染色で認められた目的の構造をもつ組織切片が再染色可能になることは、臨床検査や研究の結果の精度を向上させることにつながる。
これまで、組織切片の脱色にはアルコールと塩酸の混合溶液、シュウ酸、過マンガン酸カリウム含有溶液等が用いられてきた。しかし、これらの脱色方法では脱色後の再染色性に問題が生じることがあった。
実際にアルコールに塩酸を加えた溶液ではヘマトキシリン等の色素は脱色が不十分であるし、また、過マンガン酸カリウム、シュウ酸による脱色では組織切片へのダメージが大きく、再染色の際に切片の剥離等により組織構造が崩れてしまうことがあり、再染色方法が限定され、組織切片の再利用に制限がある。そのため、組織切片にほとんどダメージを与えずに多くの染色法による再染色を可能にする脱色方法が開発されることが望まれてきた。
今回、我々が開発したdeColorizing Solution は、HE 染色を施しその組織の状態(特定の構造や細胞の存在)を確認した後に、異なる染色への再利用を行うことで、同一組織切片からより多くの情報を得ることを可能にする方法である。本方法の特徴はこれまで脱色が困難であったヘマトキシリン、鉄ヘマトキシリンを脱色することができることである。
使用方法はまず染色・封入されたスライドグラス標本からカバーグラスが自然に剥がれ落ちるまでキシレン等の有機溶媒に浸漬する。この際に無理にカバーグラスを外そうとすると組織切片が崩れてしまうことがあるので注意する必要がある。
また、封入剤が組織切片上に残留した状態で次の手順に進むことで、水溶性色素が水和後に落ちていない状態になり、その後のdeColorizing Solution による脱色効果が弱くなるので、キシレン等の有機溶媒に十分に浸漬することがポイントとなる。古い標本ほど、封入剤の固化が進んでいるので、封入剤がとれづらいことに注意する。
次に、組織切片を各濃度のエタノールで順次水和し、最後は蒸留水に浸漬する。この水和のときにエオジン等の水溶性色素のほとんどが脱色され、ヘマトキシリンの染色が組織切片上に残っている状態になる。このヘマトキシリンによる染色が残っている組織切片を使用濃度に希釈したdeColorizing Solution 1 に浸漬する。脱色する組織切片の染色されてからの経過期間によるが、室温で1時間のdeColorizing Solution 1 への浸漬によって、ほとんどのヘマトキシリンが脱色される。
鉄ヘマトキシリンを脱色する場合にはdeColorizing Solution 1への1時間の浸漬後、蒸留水で3 回洗い、次にdeColorizing Solution 2 へ浸漬する。脱色の程度(残留した染色)が次の染色への影響がないかを光学顕微鏡で確認し、蒸留水に浸漬して3 回洗い、この時点で次の染色へと用いる事ができる。
これまでに、deColorizing Solutionを用いた脱色後の再染色として、HE染色、PAS染色、MT染色、免疫組織化学染色が可能であることを確認している。
図1と図2はそれぞれマウスの海馬または肝臓のHE染色後に上述の手順でdeColorizing Solutionを用いて脱色した図である。図1A 及び図2Aで見られるように核を含むヘマトキシリンで染色されていた部分のほとんどの染色が、図1B 及び図2B では脱色されていることがわかる。
-
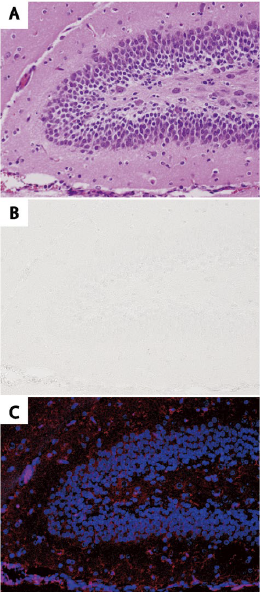
図1. deColorizing Solution 1 を用いたHE 染色後組織切片の脱色と再染色
A:HE染色したマウス海馬の組織像
B:deColorizing Solution 1を用いて脱色した後のAと同一箇所の組織像
C:脱色後に抗IBA1 抗体を用いて蛍光免疫組織化学染色したA及びBと同一箇所の組織像 -
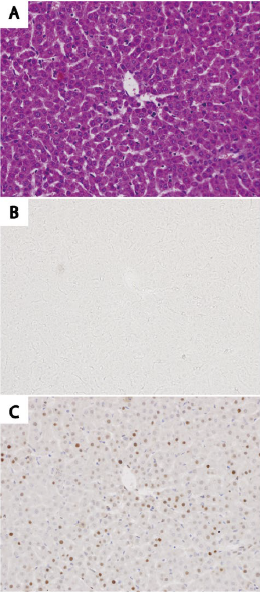
図2. deColorizing Solution 1を用いたHE染色後組織切片の脱色と再染色
A:HE染色したマウス肝臓の組織像
B:deColorizing Solution 1を用いて脱色した後のAと同一箇所の組織像
C:脱色後に抗PCNA抗体を用いて免疫組織化学染色したA及びBと同一箇所の組織像
また、図3はマウスの肝臓または腎臓をMT 染色したあとにdeColorizing Solution 1及び2を用いて脱色した図である。図3A及びCでは鉄ヘマトキシリンで染色されていた核を含む殆どの色素が図3B及びDではきれいに脱色されている。
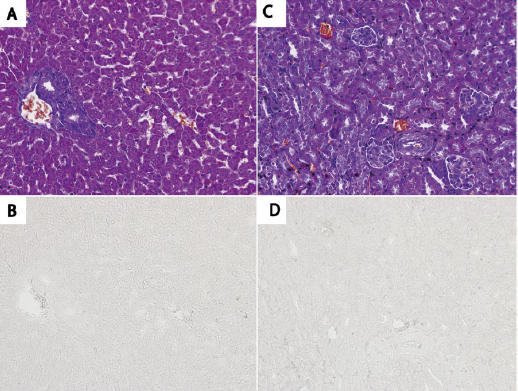
図3.deColorizing Solution 1及び2を用いたMT染色後組織切片の脱色
A:MT染色したマウス肝臓の組織像B:deColorizing Solution 1及び2を用いて脱色した後のA と同一箇所の組織像
C:MT 染色したマウス腎臓の組織像
D:deColorizing Solution 1及び2を用いて脱色した後のCと同一箇所の組織像
図1C はマウスの海馬を脱色した後に抗IBA1抗体(富士フイルム和光純薬株式会社)で免疫組織化学染色した図である。図1A及びBと同一の箇所の図である。脱色後の海馬切片でもIBA1陽性のマイクログリアの突起が検出されていることがわかる。同様に図2Cはマウスの肝臓を脱色後に抗PCNA抗体で免疫組織化学染色した図である。PCNA陽性が主に肝細胞の核で認められる。
また、脱色による組織切片の崩れ等のダメージは認められていない。
本方法を用いる利点として、これまで長期にわたり大学、研究所、病院等で保存、蓄積されている希少な組織切片をその組織切片が作製された時点では開発されていなかった染色方法や新規抗原に対する抗体を用いて、再評価することで新しい情報が得られることが可能になると考えられる。
現時点では、deColorizing Solutionの適用はHE 染色またはMT 染色となっているが、本方法の適用を拡大することで、脱色という方法がさらに組織切片の再利用による有用性を高めるであろう。




