【特別講座】高リサイクル型ならびに触媒型高活性超原子価ヨウ素反応剤の開発
本記事は、ChemGrowing Vol.09 (2019年7月号)において、立命館大学総合科学技術研究機構・立命館大学薬学部 土肥寿文 様,森本功治 様,北 泰行 様に執筆いただいたものです。
はじめに ~超原子価ヨウ素反応剤~
超原子価ヨウ素反応剤は、鉛(Ⅳ)、タリウム(Ⅲ)や水銀(Ⅱ)などの重金属酸化剤と類似の反応性を示し、毒性が低く、かつ爆発性などの懸念のない取り扱い易い酸化剤で、環境調和型酸化反応の開発に有望視されている1)。
著者の一人の北は、重金属酸化剤の毒性が社会的に認識された1980年代前半より3価の超原子価ヨウ素反応剤であるフェニルヨージンジアセタート(phenyliodine(Ⅲ) diacetate、PIDA)、フェニルヨージンビストリフルオロアセタート(phenyliodine(Ⅲ) bis(trifluoroacetate)、PIFA)、 ヨードソベンゼン(iodosobenzene)等を用い反応性の検討を行った。特にフェノールやフェニルエーテル類などの芳香族化合物の新規酸化反応を開発し、ガランタミンなどヒガンバナアルカロイド類やマカルバミンF、ディスコハブディンなどの抗腫瘍性含硫黄海洋天然物の合成へと応用した2)。
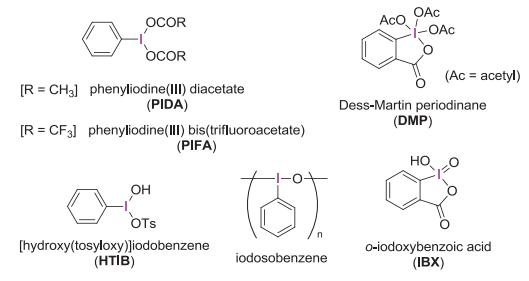
図1. 有機合成によく用いられる超原子価ヨウ素反応剤
この間、1990年代初頭より有機合成の分野において毒性、安全性、および効率などを重んじるグリーンケミストリーが盛んに唱えられるようになり、超原子価ヨウ素反応剤は重金属酸化剤の代替として有機合成の分野で一躍有名になった。現在では、図1に示す代表的な3価および5価の反応剤が市販されている。
なかでも、3価の超原子価ヨウ素反応剤であるPIDAやPIFAは多彩な反応性を示すことから、様々な反応開発に関する研究に現在用いられている。
ヨウ素反応剤は基質や触媒を酸化した後に、1価のヨードベンゼンとなる。近年では精密化学製品の合成に高純度が要求され、この副生するヨードベンゼンの除去が実用化への問題となる。また、有機ヨウ素化合物を等量用いることは工業的な利用には大きな制約があるので、回収・再利用可能なリサイクル型反応剤の開発や遷移金属のような高活性な触媒の開発が重要である。
高リサイクル型超原子価ヨウ素反応剤
大河原らにより合成されたポリスチレンを担体とするポリ(ジアセトキシヨード)スチレン(PDAIS)は回収がろ過で行える利便性があり、以前からよく用いられていた3)。実際に筆者の研究室でも、これらのポリマー反応剤を用いた環境調和型反応の開発研究を行っており、この際に低溶解性や活性部位の立体障害のために従来のPIDAやPIFAなどに比べて反応性が著しく低下すること、また数回の使用で劣化すること等の問題点を確認していた。
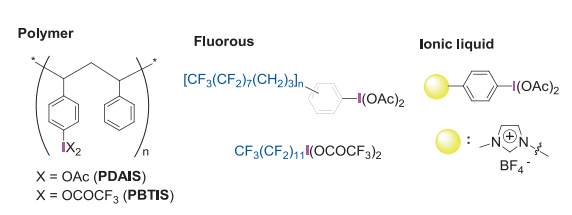
図2. ポリマー、フルオラス、イオン型リサイクル反応剤
このような背景下、近年では低分子の新しいリサイクル反応剤の開発が次々と行われ、Gladyszらはフルオラスタグを持つ化合物を4)、またZhangらはイオン性タグを持つ化合物を合成した5)。
これらは反応剤をフルオラスケミトリーやイオン液体を利用することにより生成物と分離・回収できるが、反応性についてはPIDAやPIFAとは異なる部分が多い。
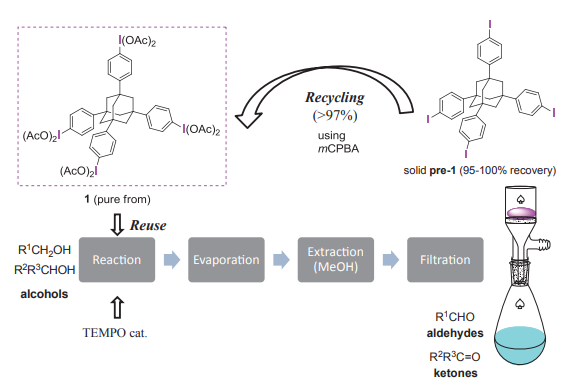
図2-1. アダマンタン型リサイクル反応剤(Wako Organic Square No.37, 43)
筆者らが開発したアダマンタン型反応剤1(図2-1)は安定な固体で、酸化に弱いベンジル水素を持たないため劣化に強く、有機溶媒(ジクロロメタン、アセトニトリルやメタノール)によく溶け、様々な酸化反応で従来のPIDAやPIFAとほぼ同じ反応性を示す6)。
回収は、反応終了後に副生する1価のヨード体pre-1が極性溶媒に対して難溶であるため、メタノールを加えると固体として沈殿し、ろ過で生成物と分離・回収できる。これは、有機ヨウ素化合物がその原子価数によって大きく極性を変える性質を利用したものである。
アダマンタン型リサイクル反応剤1は水中でのアルコールの酸化反応(反応a)をはじめ、アルコールのTEMPO酸化(反応b)、フェノールの酸化反応(反応f)、スルフィドの酸化反応(反応g)、ビアリールカップリング反応(反応e)、ホフマン型の転位反応やケトンのα-トシロキシ化(反応cとd)において、高収率で生成物を与える。
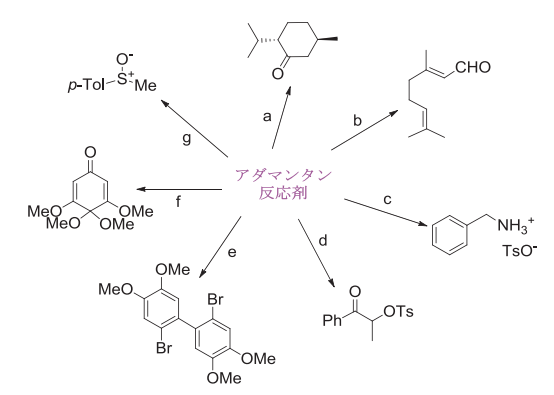
図2-2. アダマンタン型リサイクル反応剤の反応例
回収は後述の方法によりヨード体pre-1として95 %以上で行うことができた。アダマンタン型リサイクル反応剤1は分子内に4つの反応部位を有しているため基質に対して1/4当量用いれば良く、反応性に優れているためポリマー担持型の反応剤のように過剰量用いる必要はない。溶媒はジクロロメタンからメタノールのような極性溶媒まで、さらに水中での反応も行うことができる。幅広い反応温度領域(-40℃から70℃)に対応できる優れたリサイクル型反応剤である7)。
原料物質の調製にかかる工程数の削減、廃棄物の低減、反応剤の入手などの二次的な要素を考慮する際に、炭素-水素(C-H)結合を直截的にカップリングさせる酸化的手法は魅力的といえる。 1970年代頃からこのような酸化的カップリングが電解酸化や重金属酸化剤を用いて実際に試されたが、より優れた反応の設計や新しい酸化剤の開発に関する研究が現在、活発に行われている。
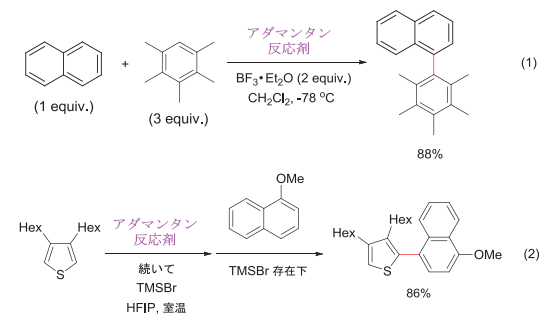
図2-3. アダマンタン型リサイクル反応剤を用いるメタルフリー芳香環カップリング
筆者らはこれまでの長年の研究で、超原子価ヨウ素反応剤の特徴を活かしたメタル触媒フリーな芳香環カップリングを数多く開発している8)。アダマンタン型リサイクル反応剤1は著者らが開発した超原子価ヨウ素カップリングにも有効で9)、カチオンラジカル生成カップリング10)(図2-3,式(1))やヘテロ芳香族化合物の酸化的クロスカップリング11)(図2-3,式(2))において、良い収率で生成物を与える。
触媒型高活性超原子価ヨウ素反応剤の開発
酸素架橋型超原子価ヨウ素反応剤は、1963年にWaddingtonらによってµ-oxo diiodanyl ditrifluoroacetate(Ph(OCOCF3)I-O-I(OCOCF3)Ph、µ-oxo PIFA)やアセタートを配位子に有するμ-oxo PIDAが報告されたが12)、反応性に関してはほとんど検証されていなかった。
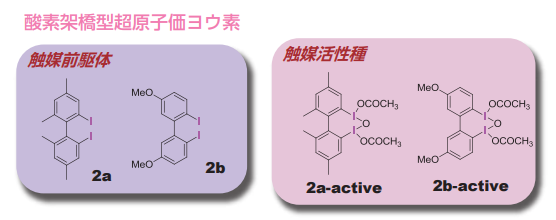
図3. μ-オキソ超原子価ヨウ素反応剤および触媒(Wako Organic Square No.59)
μ-oxo PIDAやPIFAは安定な白色粉末で、塩化メチレンやアセトニトリル等の様々な有機溶媒に可溶である。μ-oxo PIDAやPIFAの芳香環を連結した分子2では、ヨウ素原子どうしが適切な距離をとることで 架橋型超原子価ヨウ素状態を生じやすくなり、触媒として用いることができる(図3)13)。
1. μ-オキソPIDAおよびPIFAの反応性
μ-オキソPIFAはPIDAやPIFAよりも反応性が高く、フェノール類の酸化において従来よりも2~3割高い収率で生成物を与える。1-ナフトールのキノンへの酸化では、アセトニトリルと水の混合溶媒中にPIDAやPIFAを用いるとそれぞれ50%、76%で生成物を与えるが、μ-オキソPIFAを代わりに用いるとほぼ定量的にp-ナフトキノンが得られる(図3-1)14)。しかし、その合成には多段階を要するため、触媒的に働く超原子価ヨウ素反応剤としてμ-オキソ超原子価ヨウ素触媒を開発した。
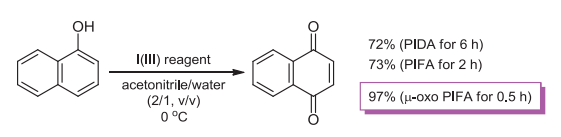
図3-1. μ-オキソPIFAによる水系での酸化反応
2. μ-オキソ超原子価ヨウ素触媒を用いた脱芳香族化反応
μ-オキソ超原子価ヨウ素触媒2aはアニソール類の脱芳香族化を効果的に触媒する(図3-2)。9%希薄過酢酸溶液(~2当量)と併せて用いると、2 mol%以下の触媒量で酸化的スピロラクタム生成物を与える15)。廃棄物が水と酢酸のみとなるグリーンケミストリーの面でも優れた方法となり、フェノール類の酸化を始め、 その他の反応にも有効に用いられるようになっている16)。ヨードベンゼンやクロロヨードベンゼン、ヨードアニソールやヨードメシチレンなどの触媒回転数が5程度であることと比較して、触媒回転数50を超える優れた触媒となる。
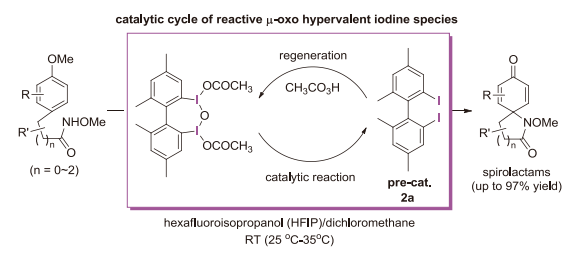
図3-2. μ-オキソ超原子価ヨウ素触媒による酸化的脱芳香化
3. μ-オキソ超原子価ヨウ素触媒を用いた酸化的芳香環アミノ化反応
アリールアミン類を合成する方法としてはUllmann反応やBuchwald-Hartwigアミノ化反応があり、医薬品や工業製品の生産など、幅広い分野で用いられている。優れた合成手法であるものの、芳香環の事前の官能基化が必要であり、より効率的な合成方法が望まれていた。
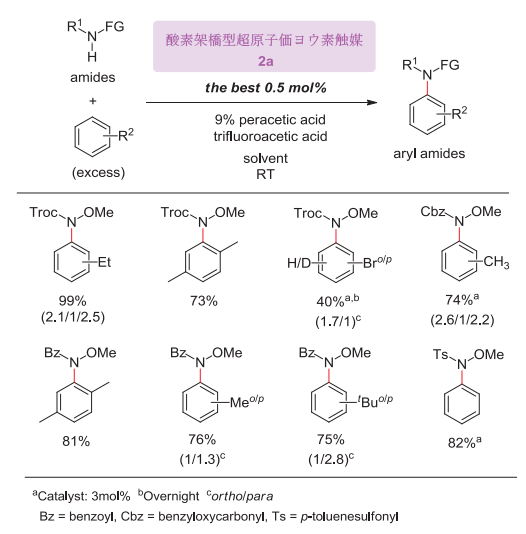
図3-3. 酸化的芳香環アミノ化
近年になり、金属触媒と酸化剤とを用いる芳香環C-H結合の酸化的アミノ化反応が報告されるようになった17)。一方、触媒量の低減に限界があることや、芳香環上に配向基の導入が必要になり原子効率の低下につながることなど、改善するべき点がある。
著者らのμ-オキソ超原子価ヨウ素触媒2aは、過酢酸などの適切な酸化剤の存在下、芳香族炭化水素とアミドとの酸化的カップリングを効果的に触媒し、対応するアリールアミン類を室温で与える(図3-3)18)。このように超原子価ヨウ素触媒は、炭素、窒素、酸素などの典型元素から成る有機分子触媒とは性質が大きく異なり、金属元素と近い反応性を示す。0.5 mol%の触媒量の使用でも良い収率でこれらのアリールアミン類が得られ、酸化的芳香環アミノ化において金属触媒系を凌駕する有機触媒と言える。
4. μ-オキソ超原子価ヨウ素触媒を用いたアニリンカップリング反応
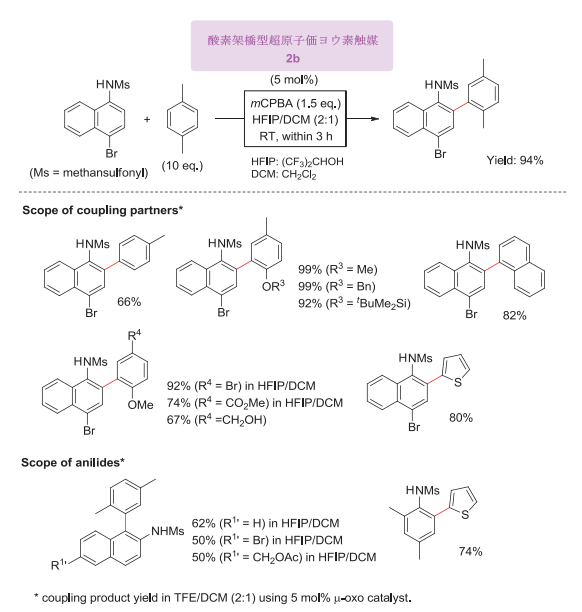
図3-4. 酸化的アニリンカップリング
筆者らは2008年に、芳香環に関して優れた選択性を示す超原子価ヨウ素反応剤を用いた世界初のメタル触媒フリーカップリングを報告した10)。この成功を契機に、二量体や過剰酸化のため難しいと思われてきた酸化的クロスカップリングが様々な基質でうまくいくことが明らかになった。
一方、超原子価ヨウ素反応剤の触媒化についての例はなく、その実現には高活性なヨウ素触媒の利用が不可欠である。μ-オキソ超原子価ヨウ素触媒2bはメタクロロ過安息香酸(mCPBA)を再酸化剤として用いると、アニリン類と様々な芳香族化合物との酸化的カップリングを効果的に起こすことがわかった(図3-4)19)。
本法は有機触媒を用いる初のメタルフリーな芳香環酸化的カップリングの例であり、高い反応性と化学選択性を併せ持つμ-オキソ超原子価ヨウ素触媒を用いたときのみ、効果的に触媒反応が進行する。
おわりに
21世紀に入り,超原子価ヨウ素反応剤のリサイクルおよび触媒的利用法が進展し、回収型反応剤や高活性触媒がいよいよ有機合成の場で実用されようとしている。今後も様々な特徴をもつ新規反応剤や触媒の開発が進展し、超原子価ヨウ素反応剤を用いた新規合成法の開拓にますます拍車がかかるに違いない。筆者らが開発し、現在、富士フイルム和光純薬から販売されている高活性μ-オキソ触媒2や提供可能なアダマンタン型リサイクル反応剤1が、今後このような研究開発の場において中心的な役割を担うことを期待するとともに、実用の場へと近い将来応用されることを願いたい。
文献
- "Hypervalent Iodine Chemistry" In Topics in Current Chemistry, ed. by Wirth T., Springer, Switzerland (2016).
- Kita, Y. and Dohi, T.: Chem. Rec., 15(5), 886 (2015). DOI: 10.1002/tcr.201500020
- Togo, H. and Sakuratani, K.: Synlett, (12), 1966 (2002). DOI: 10.1055/s-2002-35575
- Tesevic, V. and Gladysz, J. A.: Green Chem., 7(12), 833 (2005). DOI: 10.1039/B511951K
- Qian, W., Jin, E., Bao, W. and Zhang, Y.: Angew. Chem. Int. Ed., 44 (6), 952 (2005). DOI: 10.1002/anie.200461889
- Tohma, H., Maruyama, A., Maeda, A., Maegawa, T., Dohi, T., Shiro, M., Morita, T. and Kita, Y.: Angew. Chem. Int. Ed., 43(27), 3595 (2004). DOI: 10.1002/anie.200454234
- Dohi, T., Fukushima, K., Kamitanaka, T., Morimoto, K., Takenaga, N. and Kita, Y.: Green Chem., 14 (5), 1493 (2012). DOI: 10.1039/C2GC16632A
- Dohi, T. and Kita, Y.: Curr. Org. Chem., 20 (5), 580 (2016).
- Morimoto, K., Dohi, T. and Kita, Y.: Synlett, 28 (14), 1680 (2017). DOI: 10.1055/s-0036-1588455
- Dohi, T., Ito, M., Morimoto, K., Iwata, M. and Kita, Y.: Angew. Chem. Int. Ed., 47 (7), 1301 (2008). DOI: 10.1002/anie.200704495
- Kita, Y., Morimoto, K., Ito, M., Ogawa, C., Goto, A. and Dohi, T.: J. Am. Chem. Soc., 131 (5), 1668 (2009). DOI: 10.1021/ja808940n
- Alcock, N. W. and Waddington, T. C.: J. Chem. Soc., 4103 (1963). DOI: 10.1039/JR9630004103
- 北 泰行, 土肥寿文: 新規酸素架橋型超原子価ヨウ素化合物及びこれを含有する酸化剤(和光純薬工業株式会社)特開2012-051846。
- Dohi, T., Nakae, T., Takenaga, N., Uchiyama, T., Fukushima, K., Fujioka, H. and Kita, Y.: Synthesis, 44 (8), 1183 (2012). DOI: 10.1055/s-0031-1290579
- Dohi, T., Takenaga, N., Fukushima, K., Uchiyama, T., Kato, D., Shiro, M., Fujioka, H. and Kita, Y.: Chem. Commun., 46 (41), 7697 (2010). DOI: 10.1039/C0CC03213A
- Recent review: Reddy Kandimalla, S., Prathima Parvathaneni, S., Sabitha, G. and Subba Reddy, B. V.: Eur. J. Org. Chem., (8), 1687 (2019). DOI: 10.1002/ejoc.201801469
- Pioneering report: Shrestha, R., Mukherjee, P., Tan, Y., Litman, Z. C. and Hartwig, J. F.: J. Am. Chem. Soc., 135 (23), 8480 (2013). DOI: 10.1021/ja4032677
- Dohi, T., Sasa, H., Dochi, M., Yasui, C. and Kita, Y.: Synthesis, 51 (5), 1185 (2019). DOI: 10.1055/s-0037-1611661
- Ito, M., Kubo, H., Itani, I., Morimoto, K., Dohi, T. and Kita, Y.: J. Am. Chem. Soc., 135 (38), 14078 (2013). DOI: 10.1021/ja407944p




