【特別講座】Cy-Ubpyの開発物語
本記事は、ChemGrowing Vol.02 (2017年9月号)において、九州大学先導物質化学研究所 國信 洋一郎様に執筆いただいたものです。

はじめに ~位置選択性制御の重要性~
有機合成反応において、位置選択性制御の重要性は言うまでもありません。位置選択性の制御がうまくいかないと、反応の結果、様々な生成物が混合物として得られてしまいます。そのため、目的生成物の収率が低下してしまうとともに、混合物の中から欲しい化合物を単離しないといけなくなるため、時間や労力、コストがかかってしまいます。その反面、位置選択的に反応を進行させることができれば、そのような問題点を一挙に解決することができ、目的生成物を効率よく得ることができます。
これまでに開発されてきた多くの有機合成反応では、カルボニル基や炭素-ハロゲン結合のような反応性の高い官能基や結合を足掛かりとして目的化合物を合成するため、位置選択性はさほど問題にはなりません。このことは、最近のノーベル化学賞の受賞対象となった、不斉酸化・還元反応、オレフィンメタセシス、クロスカップリング反応にもあてはまります。
では、最近注目度がますます高まってきており、世界中で盛んに研究がなされている炭素-水素(C-H)結合変換反応においてはどうでしょうか?多くの有機化合物中には、様々な種類の C-H 結合が多数含まれるため、狙った位置のみで C-H 結合を切断し、C-C, C-O, C-N 結合などの新しい結合に変換することは決して容易ではありませんでした。
そのような中、配向基を用いる位置選択的な C-H 結合変換反応が世界中で精力的に開発されています。なお、ここでの配向基とは、触媒金属中心に配位し、C-H 結合活性化を進行させることのできる、基質に含まれる配位性の官能基のことを指します。配向基の威力は絶大であり、これまで困難とされてきた(信じられてきた)C-H 結合変換反応を現実味のあるものにしています。
しかし、配向基を用いる C-H 結合変換反応には問題点がないわけではありません(森羅万象、完璧なものなどありませんが)。1つ目は、基本的には反応点が配向基の近傍(芳香族化合物の場合には、配向基のオルト位)に限られること、2つ目は、反応前に基質に配向基を導入し、反応後には生成物から配向基をはずさないといけないこと、3つめは、多くの配向基は反応後に生成物から外せないため、配向基が生成物の構造で重要な役割を果たさない限りは、その反応は実用的ではなく、基礎研究のための反応にとどまってしまうこと、です。
そこで、配向基を用いる C-H 結合変換反応と相補性をなし、C-H 結合変換反応を真に実用的な有機合成反応にするために、新たな位置選択性の制御法の開発が必要であると考え、以下の研究に取り組むことにしました。
従来のメタ位選択的な C-H 変換反応
先ほど、配向基を用いる C-H 結合変換反応では、基本的には配向基の近傍、特に芳香族化合物の場合には配向基のオルト位でしか反応が進行しないと述べました。それゆえ、ここ数年来、芳香族化合物のオルト位以外の反応点、すなわちメタ位やパラ位で位置選択的に C-H 結合変換反応を進行させることが次なる重要な研究課題の1つであることが認識されてきました。
そのような中、最近になってメタ位選択的な C-H 結合変換反応が、わずかではありますが報告されてきました。1つ目の反応形式として、Smith らのグループ1、および石山、宮浦、Hartwig らのグループ2からそれぞれ独立に、イリジウム触媒による C-H ボリル化反応が報告されました。
本反応は通常、触媒活性種と基質の置換基間の立体反発のため、芳香環置換基のオルト位では反応が進行せず、メタ位およびパラ位で反応が進行します。しかし、1,2-二置換や 1,3-二置換芳香族化合物を基質として用いることで、メタ位のみで反応が進行するようになります(図1a)。
本反応では、触媒活性種と基質の置換基間の立体障害により反応点を1か所に限定しているところがポイントですが、必然的に基質が限定されてしまうという問題点があります。なお、同様の考え方を用いて、Hartwig らにより、メタ位選択的な C-H シリル化反応も報告されています3。
2つ目の反応形式として、電子的に反応点をメタ位に制御している反応が報告されています(図1b)4,5。この形式の反応の進行はかなり偶然的な要素が強いですし、反応点は多分に基質に依存してしまいます。
3つ目の反応形式は、配向基を用いる方法です。Yu らは、適切に設計された配向基を用いることで、パラジウム触媒をメタ位 C-H 結合に近づけ、メタ位選択的な C-H アルケニル化反応が進行することを報告しています(図1c)6。
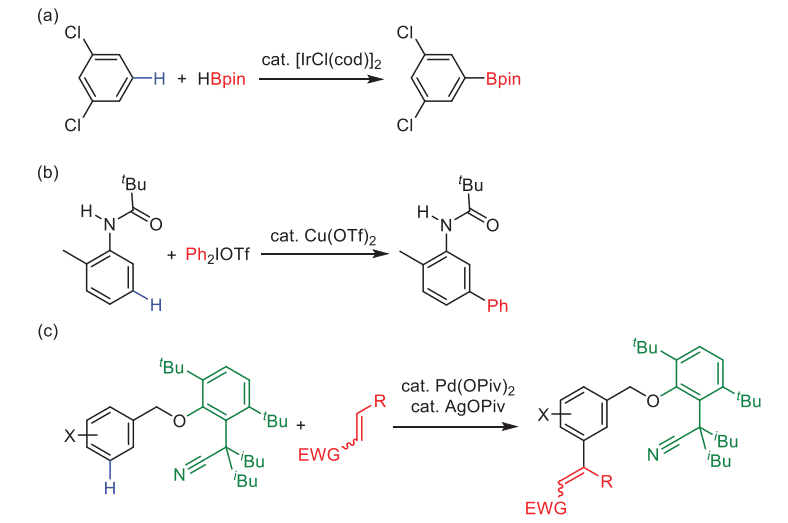
図1. メタ位選択的なC-H変換反応の先行例
著者も配向基を利用する同様の反応設計をしましたが(著者以外にも同じような考えをした研究者は何人かいるのではないでしょうか)、以下の理由から別の戦略をとることにしました:(1)適切な配向基を設計・合成するのにはかなり時間がかかると考えたため、(2)仮に適切な配向基にたどり着いたとしても、反応前に配向基を基質に導入し、反応後に生成物から配向基をはずさないといけないという、配向基のしがらみから逃れることができないため、です。
そのような理由のため、配向基を用いる戦略をとる気にはならず、以下に示す別の戦略をとることにしました。
触媒系のデザイン ~配向基からの脱却を志向して~
では、配向基以外の方法でどのようにメタ位選択的な C-H 結合結合変換反応を達成すればよいでしょうか?例えば、図1c に示す配向基を含む基質を眺めてみると、反応前後で配向基を着脱しないといけないのは、配向基と基質が共有結合でつながっていることが大きな原因です。
そこで、共有結合ではなく非共有結合性相互作用を利用することで、基質の望みの反応点を触媒活性中心に近づけることができれば、配向基の問題点を克服しつつ、目的とするメタ位選択的なC-H結合変換反応を実現できるものと想像しました。
生体酵素は、水素結合や疎水性相互作用のような非共有結合性相互作用を巧みに利用して、目的とする反応を選択的に進行させています。この事実からも、非共有結合性相互作用を利用するという戦略は間違っていないのではないかと信じて、水素結合を利用することにしました。
図2に著者がデザインした触媒系を示します。遷移金属触媒の配位子に適切なリンカーを介して基質認識部位を導入します。基質認識部位は水素結合により基質の官能基を認識します。リンカー構造が適切であれば、触媒部位は反応点であるメタ位 C-H 結合に近づくはずです。そこに適切な反応剤がやってくることにより、メタ位選択的な C-H 変換反応が進行すると考えました。
水素結合がそれほど強くない結合であることは重要で、反応後に生成物が配位子の基質認識部位から解離し、基質が基質認識部位で捕捉されることで触媒サイクルが回転すると考えました。
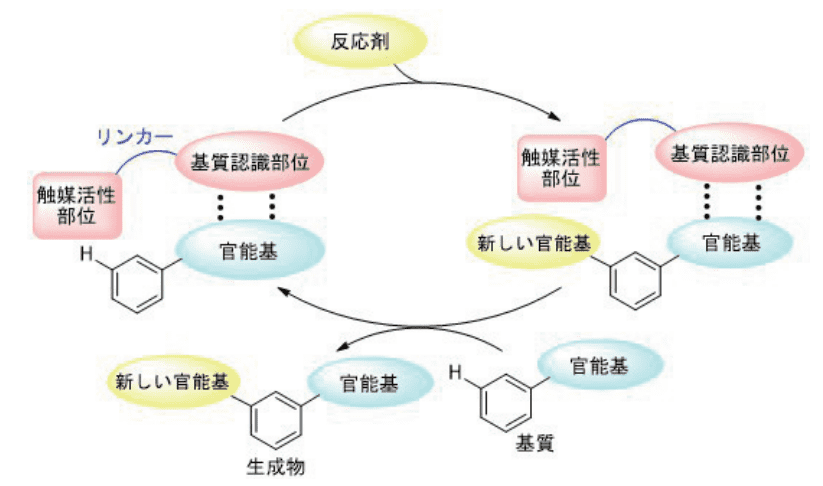
図2. 水素結合を利用する触媒システムのデザイン
図3には、触媒配位子の設計について紹介しています。基質の認識にはあまり結合力の強くない水素結合を利用するため、反応としては室温であまり極性の高くない溶媒中でも進行する C-H ボリル化反応をモデル反応として選択しました。
また、基質認識部位としては、カルボニル基などと水素結合を形成することが知られている尿素誘導体を選択しました。位置選択性の制御には、リンカー構造がとても重要であることは自明です。
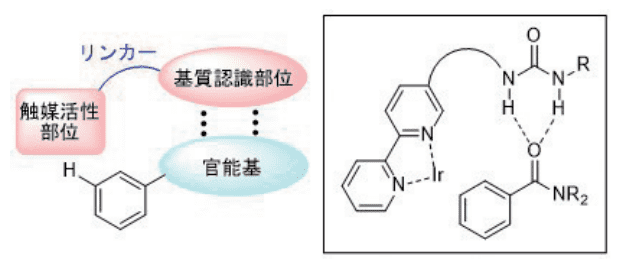
図3. 触媒配位子の設計
メタ位選択的な C-H ホウ素化反応 ~未踏の地を目指して~
やや古典的な方法ではありますが、分子模型を組むことによって、良さそうな配位子をいくつか設計しました。それらの配位子を合成し、C-Hボリル化反応を検討しました(図4)。
イリジウム触媒によるC-Hボリル化反応で通常用いられるdtbpy配位子を用いて芳香族アミドの C-H ボリル化反応を行なったところ、メタ/パラ比が 0.51 と、若干パラ位選択的に反応が進行しました。一方、配位子1を用いて反応を行なったところ、メタ/パラ比が 2.0 と、わずかではあるがメタ位で優先して反応が進行するようになりました。
一方、配位子1を用いて反応を行なったところ、メタ/パラ比が 2.0 と、わずかではあるがメタ位で優先して反応が進行するようになりました。この結果は、配位子設計があながち間違いではなく、少なくとも方向性は正しいと認識させてくれました。
残念ながら配位子2では反応が進行しなかったものの、配位子3(Cy-Ubpy、シクロヘキシル-ユービッピー)を用いることで、メタ/パラ比が 30 以上と、1HNMR ではメタ体の生成のみが観測されました。この結果は、水素結合により C-H 変換反応の位置選択性の制御に初めて成功した点で、とても意義深いと考えています。
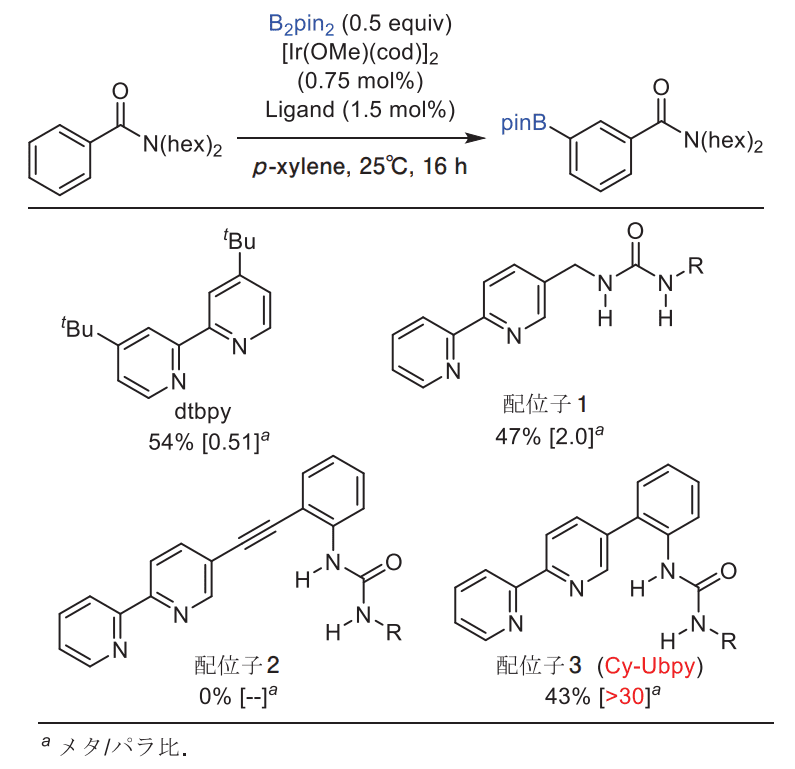
図4. 配位子の検討
次に、基質の適用範囲を検討しました(図5)。本反応は、芳香族アミドや芳香族リン化合物(ホスホン酸ジエステル、ホスホン酸ジアミドおよびホスフィンオキシド)で良好なメタ位選択性を示しました。また、様々な官能基があっても、それらを損なうことなく目的生成物を与えました。
本反応は、芳香族化合物のみならず6員環や5員環ヘテロ芳香族化合物でもまずまずの位置選択性を示したことから、触媒配位子がある程度の柔軟性をもっていることが示唆されました。
次に、水素結合の重要性を確認するために、いくつかの実験を行ないました。配位子3の重ベンゼン溶液に基質である芳香族アミドを加えていったところ、尿素部位の2つのプロトンシグナルの顕著な低磁場シフトが観測されました。この結果は、配位子の尿素部位と基質のアミド部位との間にしっかりと水素結合が形成されていることを示しています。
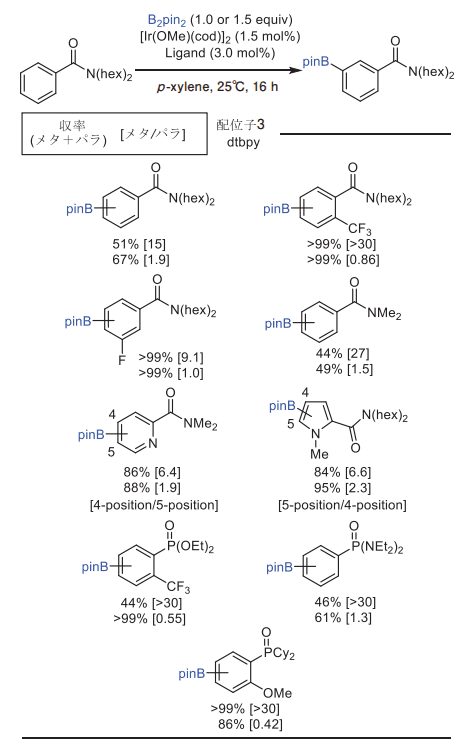
図5. 基質検討
また、いくつかの対照実験も行ないました(図6)。ウレア部位を2つのメチル基で保護した配位子3-Me2を用いて反応を行なったところ、メタ位選択性は全く発現しませんでした。この結果は、当初想定したとおりに、メタ位選択性の発現には触媒配位子と基質間での水素結合が重要な役割を果たしていることを示しています。
また、ウレア部位が結合している位置の異なる配位子4やビピリジル部位とウレア部位を連結せずに混ぜた配位子5では、メタ位選択性が全く発現しなかったことから、ビピリジル部位とウレア部位の位置関係をしっかりと規定することが、メタ位選択性の発現に重要であることも明らかになりました。
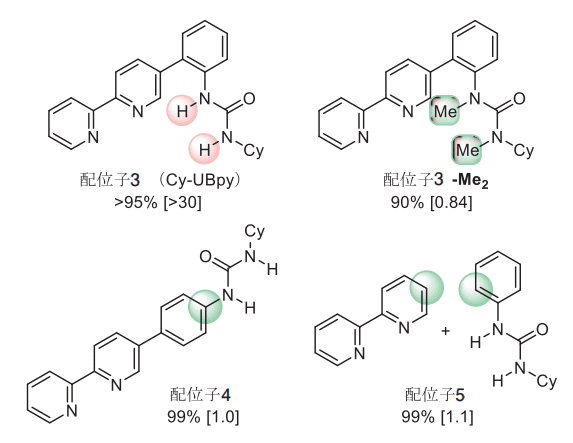
図6. 対照実験
最近の動向
今回紹介した反応を足掛かりとして、我々の研究グループでは、水素結合よりも強い Lewis 酸-塩基相互作用を利用するオルト位選択的な C-H ボリル化を報告しています(図7)7。
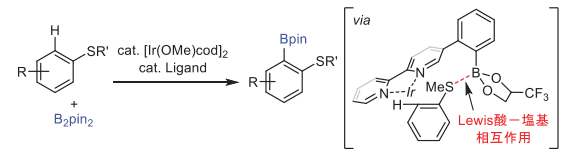
図7. Lewis酸-塩基相互作用を利用するオルト位選択的なC-Hボリル化
また、他の研究グループからもいくつかの関連する研究報告が出始めています。イギリスの Phipps らは、静電相互作用を利用するメタ位選択的な C-H ボリル化を報告しています8。また、インドの Chattopadhyay らにより、水素結合もしくは配位結合を用いるパラ位選択的な C-H ボリル化反応も報告されました9。
まとめ
以上、Cy-Ubpy の開発、および触媒配位子と基質の官能基の間での水素結合を巧みに利用したメタ位選択的な C-H 結合変換反応について紹介させていただきました。Cy-Ubpy とその原料であるアミン体(Amino-bpy)は、和光純薬工業より市販されています。
本研究分野がさらに進展していき、C-H 結合変換反応がオレフィンメタセシスやクロスカップリング反応のように、真に実用的な有機合成反応になることを願いつつ、著者らも微力ながら努力を続けていく所存です。
最後になりましたが、本研究成果を上げることができたのは、東京大学大学院薬学系研究科・金井求教授との有益なディスカッション、および井田悠さん(2017年3月博士号取得)と西光海博士の絶え間ない努力の賜物であり、この場を借りて感謝申し上げます。
参考文献
- Cho, J.-Y., Tse, M. K., Holmes, D., Maleczka Jr., R. E. and Smith, M. R. III : Science, 295, 305 (2002). DOI: 10.1126/science.1067074
- Ishiyama, T., Takagi, J., Ishida, K., Miyaura, N., Anastasi, N. R. and Hartwig, J. F. : J. Am. Chem. Soc, 124, 390 (2002). DOI: 10.1021/ja0173019
- (a) Cheng, C., Hartwig, J. F. : Science, 343, 853 (2014). DOI: 10.1126/science.1248042 (b) Cheng, C., Hartwig, J. F. : J. Am. Chem. Soc., 137, 592 (2015). DOI: 10.1021/ja511352u
- Phipps, R. J., Gaunt, M. J. : Science, 323, 1593 (2009). DOI: 10.1126/science.1169975
- (a) Saidi, O., Marafie, J., Ledger, A. E. W., Liu, P. M., Mahon, M. F., Kociok-Köhn, G., Whittlesey, M. K. and Frost, C. G. : J. Am. Chem. Soc., 133, 19298 (2011). DOI: 10.1021/ja208286b (b) Hofmann, N., Ackermann, L. : J. Am. Chem. Soc., 135, 5877 (2013). DOI: 10.1021/ja401466y
- (a) Leow, D., Li, G., Mei, T.-S., and Yu, J.-Q. : Nature, 486, 518 (2012). DOI: 10.1038/nature11158 (b) Tang, R.-Y., Li, G. and Yu, J.-Q. : Nature, 507, 215 (2014). DOI: 10.1038/nature12963
- Li, H.-L., Kuninobu, Y. and Kanai, M. : Angew. Chem. Int. Ed., 56, 1495 (2017). DOI: 10.1002/anie.201610041
- Davis, H. J., Mihai, M. T. and Phipps, R. J. : J. Am. Chem. Soc., 138, 12759 (2016). DOI: 10.1021/jacs.6b08164
- Hoque, M. E., Bisht, R., Haldar, C. and Chattopadhyay, B. : J. Am. Chem. Soc., 139, 7745 (2017). DOI: 10.1021/jacs.7b04490
特別講座 講師 國信 洋一郎 教授にお話を伺いました!!

化学の中でも、いろいろな変化が起こったり、新しく有用な化合物を生み出すことのできる有機反応に興味があり、有機化学を専攻しました。
最近では、炭素-水素結合変換反応における位置選択性制御法の開発といった基礎研究から、蛍光材料やポリマーのような応用志向の研究まで幅広く研究しています。
また、頑張って意味のある研究をしていると、必ず評価してくださる方がいて、講演会やシンポジウム、学会によんでいただいたり、お話しする機会が増えることで、人の輪が広がることをとてもうれしく思っています。
あと、言葉ではないですが、二重らせんを提唱したワトソンとクリックも好きです。若いながらも、とても重要な課題に果敢に立ち向かった姿勢と勇気が素晴らしいと思います。
あと、福岡は食べ物がおいしいのと、東京に比べて日が長いのはよいですね。
最近は日本全体が裕福になったせいか、ハングリー精神といいますか、研究に対する執念がいまいち足りない方をしばしば見受けます。
もったいないと思います。そう考えてしまう自分は、もう若手研究者ではなくなってしまったのでしょうか(苦笑)。




