【特別講座】拡大するボロン酸の化学
本記事は、OrganicSquare Vol.39 (2012年3月号)において、東京大学大学院 理学系研究科化学専攻 特任助教 佐藤 健太郎 様に執筆いただいたものです。

はじめに
2010 年のノーベル化学賞が、R. Heck・根岸英一・鈴木章の 3 氏に与えられたことはまだ記憶に新しい。受賞対象となったクロスカップリング反応の中でも、ボロン酸及びその誘導体を基質として用いる「鈴木-宮浦反応」の有用性は極めて高く、この試薬の存在こそがノーベル賞への決め手であったといっても過言ではない(図 1)[1]。
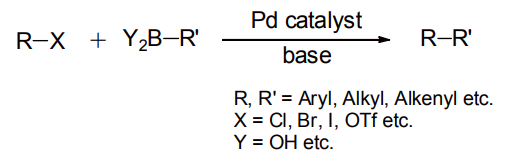
図 1 鈴木-宮浦カップリング
ボロン酸(R-B(OH)2)及びそのエステル[2]は、空気や水に安定で取り扱いやすい上に、副生物の除去も容易で毒性・環境負荷なども低いなど優れた特徴を併せ持つ。このため鈴木-宮浦カップリングは、天然物全合成から医薬品・有機電子材料の探索・生産に多数応用され、実験室レベルから工業スケールに至るまで、今やなくてはならない試薬となっている(図 2)。
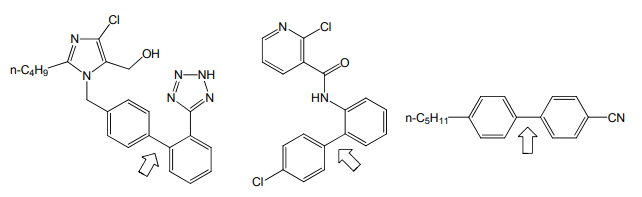
図 2 鈴木-宮浦カップリングで工業的に生産されている化合物の例
左から降圧剤ロサルタン、農薬ボスカリド、液晶材料 5-CB。矢印は鈴木-宮浦カップリングで作られた結合またボロン酸類の試薬としての優れた性質が認められるにつれ、鈴木-宮浦反応以外への応用も大いに進展しつつある。ここではボロン酸類の化学の、幅広い展開の一端をご紹介したい。
ボロン酸合成法の進展
鈴木-宮浦反応の普及に伴い、現在では極めて多様なボロン酸類が市販されるようになっている。重水素化芳香族ボロン酸なども入手可能で、各種標識化合物や、近年注目される「ヘビー・ドラッグ」(重水素化医薬)[3]などの合成も容易になっている。
ボロン酸合成の手法も進歩している。かつては有機金属化合物とホウ酸トリイソプロピルなどを反応させる方法が主流であったが、近年パラジウム触媒による交換反応で合成する穏和かつ直接的な方法が開発されている(図 3)[4]。
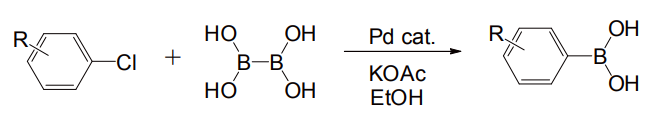
図 3 パラジウム触媒による芳香族ボロン酸合成
C-H 結合活性化によって、直接芳香族ボロン酸を合成する手法も登場している。石山・宮浦らは、イリジウム触媒を用いてベンゼンを直接フェニルホウ酸に変換することに成功した(図 4)[5]。効率に優れたボロン酸合成法として、さらなる進展が期待される。
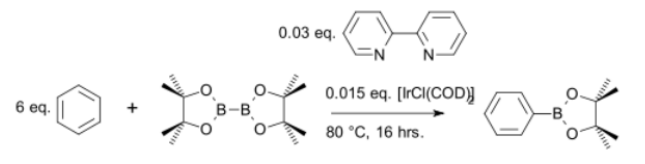
図 4 C-H 結合活性化による芳香族ボロン酸合成
有機ボレートを用いるクロスカップリング
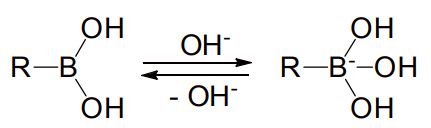
図 5 ボロン酸とボレートの平衡
鈴木-宮浦反応では、反応系中に炭酸カリウムやトリエチルアミンなど、塩基の添加が必要となる。これは、塩基がホウ素原子に配位することでアート錯体となって炭素の求核性が増し、パラジウムへのトランスメタル化を促進するためと考えられる(図 5)。このように、極めて安定でありながら、塩基の添加によって大きく振る舞いを変えるボロン酸の特徴が、鈴木-宮浦反応の優位性を生み出しているといえる。
そこで、最初からボレートの形で単離可能な試薬が開発された。たとえば G. A. Molander らは、各種のトリフルオロボレート類(RBF3-)が、鈴木-宮浦カップリングの基質として有効であることを示した[6]。各種ボロン酸(またはそのエステル)をフッ化水素カリウム(KHF2)と反応させるだけで、簡便に調整可能である。反応性はやや低いが、安定で各種の変換反応にも耐え、芳香族のみならずアルキルボレートによるカップリングにも向く。
一方宮浦らは、かご状構造を持った有機ボレート類を開発している(図 6)[7]。これは調製に若干手間がかかるものの、多くの有機溶媒に可溶であること、反応性が高く、室温で塩基の添加なしでも十分な速度で反応が進行する点が優れている。またかご状ボレート試薬は、後述の Chan-Lam-Evans カップリングの基質としても有用である[7]。
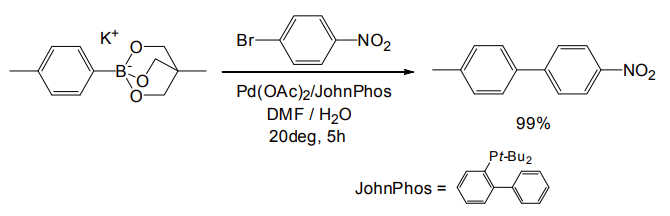
図 6 かご状ボレートによる鈴木-宮浦カップリング反応
ボロン酸の保護基
ボロン酸の反応性を抑えるための誘導体も登場してきた。M. D. Burke らによる「MIDA ボロネート」(N-メチルイミノジ酢酸とボロン酸とから合成)[8]、杉野目らによる 1, 8-ジアミノナフタレンとの環状アミド[9]などがそれで、これらは通常の鈴木-宮浦反応の条件でクロスカップリングを起こさない(図 7)。
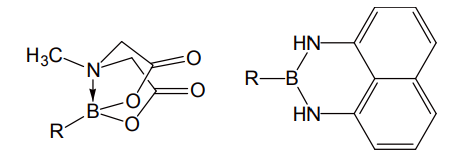
図 7 MIDA ボロネート(左)と、1,8-ジアミノナフタレンアミド(右)
各種の反応条件に安定だが、前者は塩基水溶液処理、後者は酸処理によって容易に脱離し、ボロン酸を再生する。すなわちこれらの誘導体は、ボロン酸の保護基として使用可能である。これらを活用すれば短工程で効率よくクロスカップリングを繰り返すことが可能であり、有機電子材料や医薬品などの効率的探索に威力を発揮すると思われる(図 8)[10]。
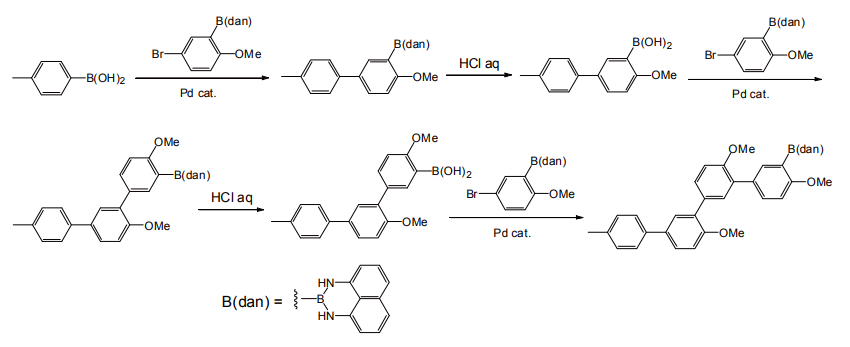
図 8 1,8-ジアミノナフタレンアミド(dan 基)を用いた連続クロスカップリング
鉄触媒による鈴木-宮浦反応
近年の有機合成研究の大きな流れとして、レアメタルからユビキタス金属への置換がある。鈴木-宮浦反応も例外ではなく、2010 年に京都大学の中村らによって、鉄触媒でのカップリング反応が達成された(図 9)[11]。
鉄中心に空き配座を持ち、スピン密度を高める配位子の設計がポイントであった。鉄触媒は低毒性である上、酸洗浄だけで ppb レベルまで除去できる。基質として塩化アルキルも使用可能であるなどのメリットもあり、特に医薬品合成などに大きなインパクトを与えうる反応といえよう。
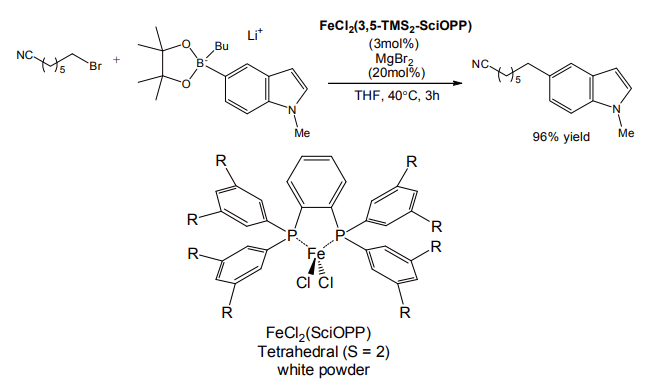
図 9 鉄触媒による鈴木-宮浦カップリング
また銅塩を触媒として、チオールエステルとボロン酸からケトンを合成する Liebeskind-Srogl カップリングも、穏和な条件で進行するため利用価値が高い(図 10)[12]。
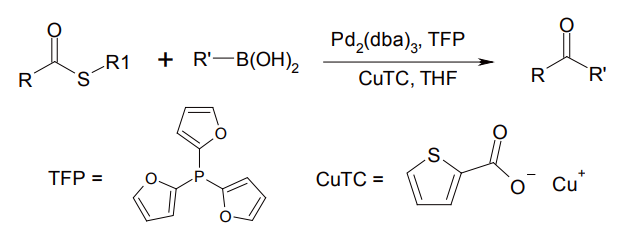
図 10 Liebeskind-Strogl カップリング
芳香族-ヘテロ元素結合生成
C-C 結合生成に限らず、ヘテロ元素との結合生成の用途も開拓された。芳香族ボロン酸と一級または二級アミンを、塩基存在下酢酸銅(II)とともに撹拌するだけで、芳香族アミンが生成する(図 11)。
アミンの代わりに N-H 結合を持つアミドやアゾール類、またフェノールやチオールをアリール化することも可能であり、利用範囲は極めて広い[13]。古くから用いられている Ullmann 反応と類似の形式であるが、遥かに条件が穏和で後処理も簡便である。
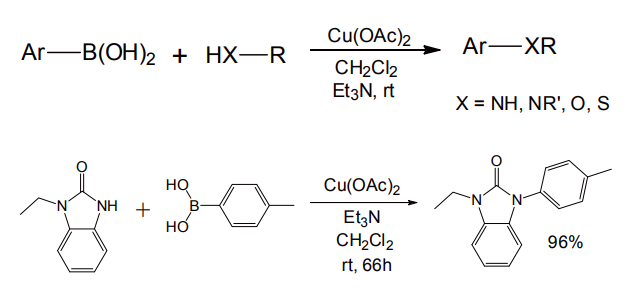
図 11 Chan-Lam-Evans カップリング
合成反応以外の利用
ここまではボロン酸の C-B 結合が切れて他の結合に置き換わる反応について述べてきたが、ボロン酸自身にも有用な用途が開拓されつつある。前述のように、ボロン酸はヒドロキシ基を持った化合物と、可逆的な共有結合によってボレート型の錯体を作るという特徴を有する。この性質を利用した医薬として、最近多発性骨髄腫の治療薬として認可を受けたボルテゾミブがある(図 12)。
この化合物は、ボロン酸部分が 26S プロテアソームの活性部位に結合し、そのはたらきを阻害する。これまでホウ素を含んだ医薬はほとんど例がなかったが、酵素阻害剤の基本骨格としてボロン酸は可能性を秘めているといえよう[14]。
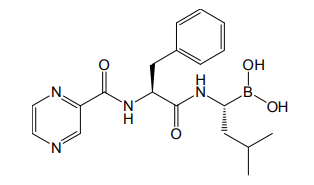
図 12 多発性骨髄腫治療薬ボルテゾミブ(商品名ベルケード)
ボロン酸エステルはアルコールや水の攻撃を受け、交換反応を起こしやすい。これを利用し、ボロン酸は 1,2-または 1,3-ジオールの保護基として、また超分子化学分野において糖認識部位としても応用される[15]。
近年注目されるのは、多孔質材料合成への応用であろう。金属イオンと橋かけ型配位子の自己組織化によって出来上がる、金属有機構造体(Metal Organic Framework, MOF)は現在最もホットな分野の一つだが、共有結合のみでこれに似たネットワークを構築する試みもなされている。
可逆的な結合を形成するボロン酸は、この共有結合性有機構造体(covalent organic framework,COF)の構築に最適な性質を持つ。具体的には、ボロン酸の脱水三量化によるボロキシン環形成、カテコールエステル形成などの反応が用いられる(図 13)。これらは気体の吸蔵や、触媒、発光材料などとしての応用が進められており、材料科学に重要な一分野を形成しつつある[16]。
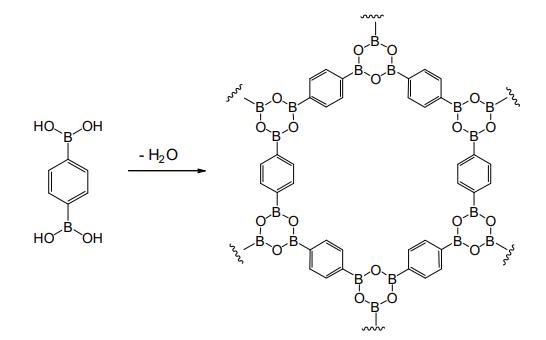
図 13 脱水三量化による COF の合成の例
このようにボロン酸は他にないユニークな性質を備えた物質群であり、アイディア次第でまだまだ新たな用途が拓ける可能性を秘めている。今後のさらなる研究の進展に、大いに期待したい。
参考文献
- N. Miyaura , A. Suzuki:Chem. Rev., 95, 2457 (1995). DOI: 10.1021/cr00039a007
- "Boronic Acids."Edited by Dennis G. Hall (2005)., WILEY-VCH
- K. Sanderson:Nature ,458, 269 (2009). DOI: 10.1038/458817a; K. Sanderson:Nature, 458, 817 (2009).;佐藤健太郎:Organic Square,33, 2 (2010).
- G. A. Molander et al.:J. Am. Chem. Soc.,132, 17701 (2010). DOI: 10.1021/ja1089759
- T. Ishiyama et al.:J. Am. Chem. Soc., 124, 390 (2002). DOI: 10.1021/ja0173019
- S. Darses et al.:Chem. Rev., 108, 288 (2008). DOI: 10.1021/cr0509758
- Y. Yamamoto et al.:Angew. Chem. Int. Ed., 47, 928 (2008).
- E. P. Gillis et al.,:J. Am. Chem. Soc., 129, 6716 (2007). DOI: 10.1021/ja0716204
- H. Noguchi et al.:J. Am. Chem. Soc., 129, 758-759 (2007). DOI: 10.1021/ja067975p
- S. J. Lee et al.:J. Am. Chem. Soc., 130, 466 (2008). DOI: 10.1021/ja078129x; H. Noguchi et al.:Org. Lett.,10, 377 (2008). DOI: 10.1021/ol702420x
- T. Hatakeyama et al.:J. Am. Chem. Soc., 132, 10674 (2010). DOI: 10.1021/ja103973a
- L. S. Liebeskind, J. Srogl:J. Am. Chem. Soc., 122, 11260 (2000). DOI: 10.1021/ja005613q;J. M. Villalobos et al.:J. Am. Chem. Soc., 129, 15734 (2007). DOI: 10.1021/ja074931n
- S. V. Ley et al.:Angew. Chem. Int. Ed., 42, 5400-5449 (2003).
- W. Yang et al.:Med. Res. Rev., 23, 346 (2003). DOI: 10.1002/med.10043
- "Boronic Acids in Saccharide Recognition", Tony D. James, Marcus D. Phillips and Seiji Shinkai, Royal Society of Chemistry (2006).
- A. P. Côté et al.:Science, 310, 1166 (2005). DOI: 10.1126/science.1120411;F. J. Uribe-Romo et al.:J. Am. Chem. Soc. 131, 4570 (2009). 10.1021/ja8096256




