【連載】Wako Organic Chemical News No.07「ペプチド合成における酸塩化物の活用」

今月の反応・試薬 「 ペプチド合成における酸塩化物の活用 」
サイエンスライター : 佐藤 健太郎氏
望みの配列を持ったペプチドを合成する技術の重要性は、今さらくだくだしく述べるまでもないだろう。実のところ、ペプチドはアミノ酸が一列につながっただけの単純な化合物でありながら、その合成は奥が深い。この分野の祖というべきエミール・フィッシャーが、初めてペプチドを合成したのは20世紀初頭のことであるが、より優れた方法を求めて、なおも研究は続いている。
長い間に様々な合成技法が開発されてきたが、以下の基本的な手順はほぼ共通する。
- アミノ基を保護したアミノ酸Aと、カルボキシ基をエステルとして保護したアミノ酸Bを用意する
- アミノ酸Aのカルボキシ基を何らかの形で活性化し、アミノ酸Bとカップリングさせる
- できたジペプチドの、アミノ基の保護基を脱離する
- アミノ基を保護した次のアミノ酸をカップリングする
という工程をくり返し、アミノ酸鎖を延長していくことになる。すなわち、ペプチド合成法の研究において最も肝要なのは、より優れたカルボキシ基の活性化法を見出すことにあるといってよい。
カルボキシ基の活性化には、酸塩化物、酸無水物、酸アジド、活性エステルなどの方法が知られており、活性化の度合いは概ねこの順序になる。すなわち、酸塩化物を用いる方法が最も反応性が高い。実際、フィッシャーによる最初のペプチド合成では、この酸塩化物法によってアミノ酸のカップリングが行われている。
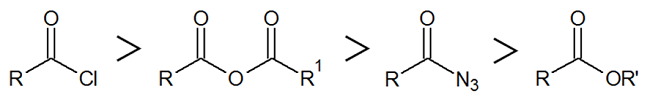
にもかかわらず、その後酸塩化物法は省みられなくなっていった。これは、酸塩化物の活性化度合いが高すぎ、塩基の存在下で分解またはラセミ化を起こしてしまうためだ
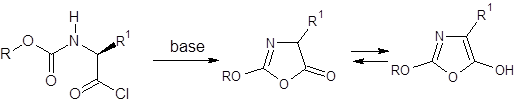
オキサゾロンを経由するラセミ化の機構
これを防ぐため、1-ヒドロキシベンゾトリアゾール(HOBt)を中心としたマイルドな活性エステル法などが用いられ、こちらがペプチドカップリングにおける主役となっていった。また系中で活性エステルを発生させるカップリング試薬が多数開発され、より速い反応を目指して競い合っているのが現状だ。酸塩化物法は、ある程度のラセミ化を覚悟で、立体障害の大きなアミノ酸や、大きなフラグメント同士のカップリングに用いられる程度であった。
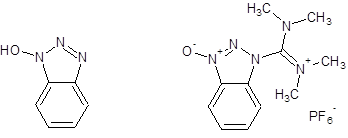
HOBt(左)と、カップリング試薬のひとつHBTU(右)
Fmoc法の発見
しかし、酸塩化物は反応性の高さの他、コストが安くすむこと、廃棄物が少なく安全であることなど、他の活性化法にはないメリットも有している。L. Carpinoらは、Fmoc基で保護されたアミノ酸の酸塩化物は、結晶として安定に単離でき、デシケーター中でラセミ化なしに保存できることを見出した。Fmocアミノ酸を、ジクロロメタン中室温で、触媒量のN,N-ジメチルホルムアミド(DMF)と塩化チオニル(SOCl2)で処理するという、ごく基本的な操作で酸塩化物への変換が行える。
得られたFmocアミノ酸塩化物は、さまざまな条件でカップリング反応が行える。ただしFmoc基は二級アミンなどの塩基で脱離するため、なるべく中性に近い条件で反応させることが望ましい。塩基への接触を最小限に抑えるため、5%炭酸水素ナトリウム水溶液と塩化メチレンを用いるSchotten-Baumann条件で反応を行うのが、最も簡便かつ廃棄物の少ない方法といえる。
Carpinoらは、この方法を用いたペプチドの迅速合成を発表している1)。Fmocアミノ酸塩化物を、先のSchotten-Baumann条件でカップリングし、そのまま4-アミノメチルピペリジンで処理してFmoc保護基を除去すると同時に、過剰の酸塩化物をトラップする。生じた副生成物は、pH5.5のリン酸バッファによる洗浄で除去できる。この操作を繰り返すことで、わずか4時間のうちに5残基から成るLeu-エンケファリン(Tyr-Gly-Gly-Phe-Leu) を、10mmolスケールで合成することに成功している。総収率は50~55%に達し、ラセミ化も0.1%以下に抑えられている。

CarpinoらによるLeu-エンケファリンの合成
Fmocアミノ酸塩化物によるカップリングは、N,N-ジイソプロピルエチルアミン存在下、ジクロロメタン中で反応を行うこともできる。シアン化銀存在下トルエン中での反応、亜鉛粉末存在下ジクロロメタン中で反応などの条件も知られており、中性条件が求められる場合、これらの方法も検討すべきであろう。
他の保護基
酸塩化物によるペプチド鎖延長は、Fmoc基の専売特許ではない2)。トリフルオロアセチル基や、スルホニル基で保護されたアミノ酸も、同様に酸塩化物として利用できる。中でも、ニトロベンゼンスルホニル基(ノシル基、Ns)は、チオール存在下弱塩基で脱保護ができるため、極めて有用である。
アミノ基の保護基として汎用されるベンジルオキシカルボニル基(Z基)で保護されたアミノ酸も、酸塩化物としてカップリングが行える。Fmoc基の場合と異なり、Z-アミノ酸塩化物を単離することはできないが、系中で発生させた酸塩化物にアミン成分を加えることで、収率よくアミド化を行うことができる。
N-メチルアミノ酸などの立体障害の大きな基質を用いる場合、各種縮合試薬を用いてもうまく進行しないことが多いが、酸塩化物でのカップリングはこうしたケースで威力を発揮する。前述の通り、操作や廃棄は簡便で、コスト面でも有利であることから、この方法はもっと活用されてよいのではないだろうか。
参考文献
- M. Beyerman et al., J. Org. Chem., 55, 721 (1990).
- アミノ酸塩化物に関する総説:G. Prabhu et al., Tetrahedron, 71, 2785 (2015).
注目の論文
① Cyclic Hypervalent Iodine Reagents and Iron Catalysts : The Winning Team for Late-Stage C-H Azidation
Maria Victoria Vita and Jerome Waser*
Angew. Chem. Int. Ed., Early View DOI : 10.1002/anie.201501666
超原子価要素試薬を用いた、C-Hアジド化反応。三級炭素のメチンC-Hが切断され、アジ基に置き換わる。反応はラジカル的に進行し、複雑なテルペン化合物なども収率よく官能基化できる。
② Highly Enantioselective Transfer Hydrogenation of Ketones with Chiral (NH)2P2 Macrocyclic Iron(II) Complexes
Raphael Bigler, Raffael Huber, and Antonio Mezzetti*
Angew. Chem. Int. Ed., Early View DOI : 10.1002/anie.201501807
鉄触媒を用いたMeerwein-Ponndorf-Verley型還元反応。イソプロピルアルコールを還元剤として、各種ケトンが高収率、高立体選択的に二級アルコールへと還元される。リンと窒素 2つずつを含む、14員環マクロサイクル型配位子が成功の鍵。
③ Multistep continuous-flow synthesis of (R)- and (S)-rolipram using heterogeneous catalysts
Tetsu Tsubogo, Hidekazu Oyamada & Shū Kobayashi
AffiliationsContributionsCorresponding author
Nature, 520, 329-332 (16 April 2015) doi:10.1038/nature14343
「フロー精密合成」という手法による、医薬品の合成。通常の化学反応では、原料などを溶媒に溶かして攪拌し、抽出・洗浄・精製などの工程で生成物を分離し、次の反応へ進む。しかしフロー精密合成においては、触媒を固定したカラムに原料を通過させることにより、精製操作なしに直接次の反応へ進む。この手法により4本のカラムで8段階の反応を行い、光学活性な医薬品ロリプラムを、低コストかつグリーンに合成することができた。有機合成の未来を感じる論文。





