【特別講座】オレフィンメタセシス触媒の最近の進歩
本記事は、OrganicSquare Vol.41 (2012年9月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

有機合成を変えた反応
長い化学の歴史の中で、有機合成を根底から変えた反応のひとつとして、オレフィンメタセシス反応を挙げることに異論のある者はないであろう[1]。最も安定な結合である炭素-炭素二重結合が切れて組み替わる、他にほとんど類例がないユニークな反応である。
オレフィンメタセシスの歴史は意外に古く、その発見は 1960 年代にまで遡ることができる。特異な反応形式は多くの化学者の興味を惹き、早い時期からメカニズムの解明が進められた。この反応では、チタン・モリブデン・ルテニウムなど遷移金属のカルベン錯体が触媒としてはたらく。これがオレフィンと反応してメタラシクロブタン環を形成し、再度解離することによってオレフィンの組み替えが起こるというのが、現在知られるオレフィンメタセシスのメカニズムだ。
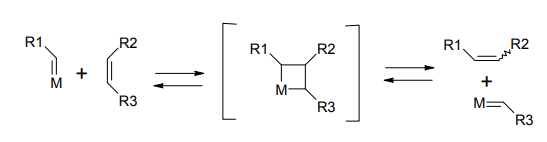
オレフィンメタセシス反応機構
当初オレフィンメタセシス研究の主役となったのは、R.Schrock の開発したモリブデン及びタングステンのカルベン錯体であった。この触媒は、複雑なアルカロイドの中間体合成に応用されるなど、多くの実績を挙げている[2]。
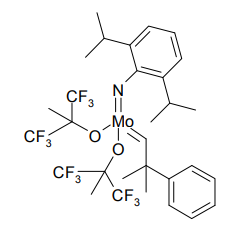
モリブデンを中心に持つ触媒の一例
しかしこれらの触媒は空気や水に対して極めて敏感であり、調製や反応操作に困難を伴うものであった。このためオレフィンメタセシスは、メカニズム的には興味を惹くものの、長らく合成的に有用な反応とみなされてはこなかった。
Grubbs 触媒の登場
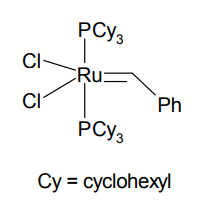
第 1 世代 Grubbs 触媒
この状況を一変させたのは、1990 年代半ばに R. H. Grubbs の開発した、いわゆる第 1 世代 Grubbs 触媒であった[3]。アルコール、ケトン、エステルなど各種の官能基とはほとんど反応せず、オレフィンだけを自在に組み替える触媒の登場は、逆合成の考え方を大きく変えることとなった。中員環などの環化反応や、環状オレフィンの開環重合など、今まで難しかった反応が簡単な操作で実現できるようになった意義は極めて大きい。
第 1 世代 Grubbs 触媒は、ルテニウムのカルベン錯体を基本とし、トリシクロヘキシルホスフィンを配位子として持つ点を特徴とする。かさ高く電子供与性の高い配位子のはたらきにより、メタラシクロブタン中間体が安定化されているものと考えられる。
第 2 世代 Grubbs 触媒
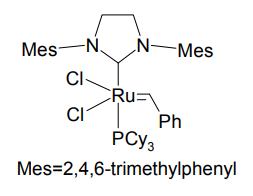
第 2 世代 Grubbs 触媒
さらに 1999 年には、第 2 世代 Grubbs 触媒が登場した[4]。トリシクロヘキシルホスフィン配位子の一方を、さらにかさ高くて配位力の強い N-ヘテロサイクリックカルベン(NHC)に置き換えた構造をとる。第 2 世代触媒では、三・四置換オレフィンや電子不足オレフィンなど、第 1 世代触媒では難しかった化合物も合成可能となっている。
第 2 世代触媒は、NHC の配位子としての有用性を広く知らしめたという意味でも、有機金属化学史上画期的であった。NHC は中心金属から極めて解離しにくく、このため第 2 世代触媒は第 1 世代に比べて格段に安定性が増している。
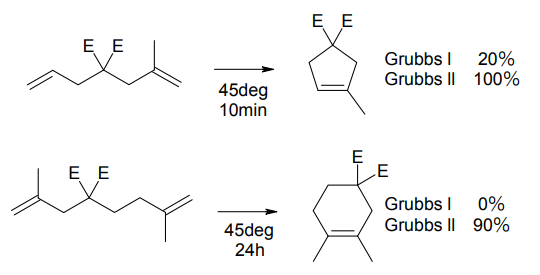
第一世代と第二世代の比較(E=CO2Et)
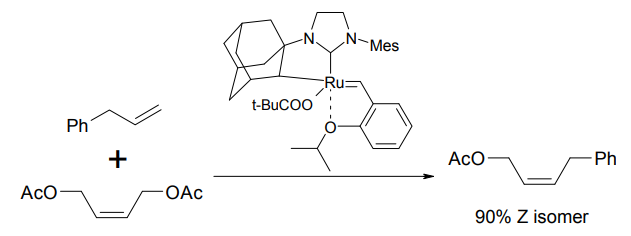
また、異種のオレフィン同士を分子間結合させる「クロスメタセシス反応」にも、この触媒は威力を発揮する[5]。特に、末端オレフィンとアクリル酸エステルとのクロスメタセシスによって、α,β-不飽和エステルを形成する反応は有用であり、多くの応用例がある。
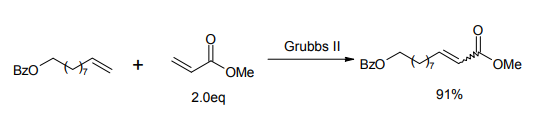
クロスメタセシス反応の例
ただし第 2 世代触媒は、第 1 世代より選択性が低いなどのケースもあり、全てにおいて優れているというわけではない。第 1 世代に取って代わるものというよりは、オレフィンメタセシスの適用範囲を広げた触媒と見るべきであろう。
第 3 世代 Grubbs 触媒
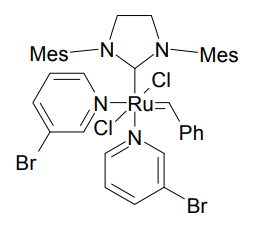
第 3 世代 Grubbs 触媒
メタセシス反応は、まず一方のホスフィン配位子が脱離し、これがオレフィンを取り込んでメタラシクロブタンを形成することで開始される。NHC 配位子はその強い電子供与性により、配位子が外れた中間体を安定化させるため、高い活性を示すと考えられる。
そこで、一方の配位子をもっと離脱しやすいものに替える手法が開発された。3-ブロモピリジン配位子を持つものは反応の開始が速く、開環メタセシス重合などに威力を発揮する[6]。このタイプを、第 3 世代 Grubbs 触媒と呼ぶこともある。
さらに Piers らは、この配位子を最初から欠いた、4 配位のカチオン性錯体を報告している[7]。配位子が脱離していくステップがないため、反応が極めて速いという特徴を持つ。下図の反応では、第 2 世代 Grubbs 触媒を使った場合には 0度、2 時間で収率 25%にとどまるが、Piers らの触媒を使えば、同条件で 90%以上の生成物が得られてくる。これらを第 1 世代及び第 2 世代Piers-Grubbs触媒と呼ぶこともある。
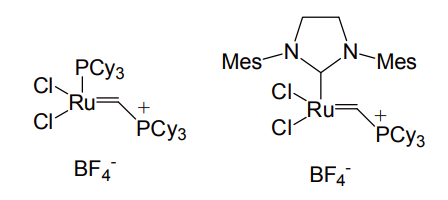
第 1 世代 Piers-Grubbs 触媒(左)第 2 世代 Piers-Grubbs 触媒(右)
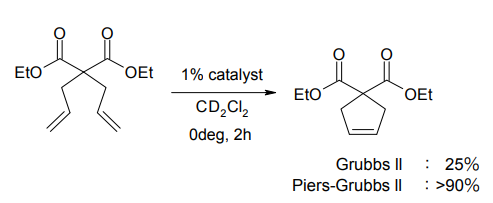
Piers-Grubbs 触媒を用いた閉環メタセシス
Hoveyda-Grubbs 触媒
Hoveyda らは、2-イソプロポキシスチレンを基質としてオレフィンメタセシスを行っていた際、反応がすぐに停止してしまうことを見出した。この偶然の発見を元に、彼らは下図のような新規触媒を報告した[8]。それぞれ、Hoveyda-Grubbs第 1 世代触媒、第 2 世代触媒と呼ばれる。ベンジリデン基に結合したエーテル酸素が中心のルテニウムに配位し、安定化している。この触媒は、反応開始は遅いものの、反応速度は Grubbs 触媒と遜色ないという特徴を有する。
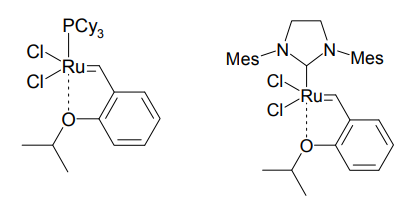
Hoveyda-Grubbs 触媒の第一世代(左)、第二世代(右)
またこのイソプロポキシベンジリデン基に電子求引基を導入することで、エーテル酸素の配位力を弱め、脱離しやすくすることで反応性を上げようという工夫もなされている。ニトロ基・フェニル基を導入したものの他、スルホンアミド部位を結合させたものが最近登場した。その高い安定性から、プロトン酸による分子内 Friedel-Crafts 反応とのタンデム反応に応用され、成果を挙げている[9]。
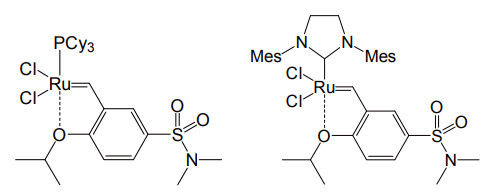
改良 Hoveyda-Grubbs 触媒
また、立体障害を軽減することで、四置換オレフィンの合成を容易にした下図のような触媒も登場している[10]。その他、水溶性置換基を導入したもの、樹脂に固定化して回収を容易にしたものなど、多くのバリエーションが入手可能となっている。
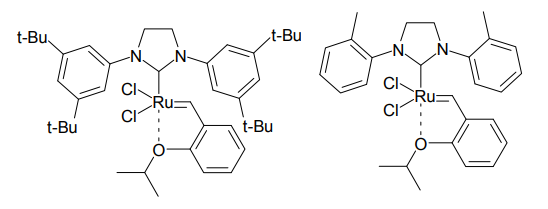
触媒の選択
これだけ様々な触媒が登場してくると、自分の反応にはどれが最適か迷わざるを得ない。まず通常の閉環メタセシスなどの場合には、比較的低コストの第 1 世代 Grubbs 触媒から試してみるのがよいと思われる。三置換・四置換オレフィンや、電子不足オレフィンなど反応性が低いものに関しては、第 2 世代 Grubbs 触媒の使用を検討すべきであろう。
近年では、安定性と取り扱いに優れた Hoveyda-Grubbs タイプの使用例が増えている。水や湿気に安定であるため、シリカゲルカラムで回収再使用可能であることも、コスト面から見て大きなメリットになる。さらなる高反応性を求めるなら、第 3 世代 Grubbs 触媒や、Piers-Grubbs 触媒という選択肢を検討することになろう。
Schrock 触媒の進展
モリブデンやタングステンを中心とした触媒においても、近年大きな進展があった。オレフィンメタセシスに関しては半世紀近い研究が蓄積されているが、長らくエナンチオ選択性、E,Z の選択性を持たせることは難しいテーマであった。
しかし 2008 年、Schrock と Hoveyda の共同研究により、高い立体選択性での不斉オレフィンメタセシスが実現した[11]。彼らは中心金属のモリブデン上に不斉要素を持たせた触媒を開発、これを用いたアルカロイド合成も実現した。
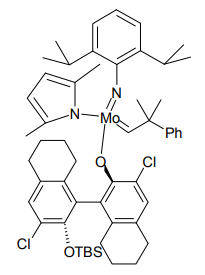
Schrock と Hoveyda による不斉オレフィンメタセシス触媒
オレフィンメタセシスは可逆反応であるため、E-Z 選択性を持たせることは難しい。特に、クロスメタセシスによる二置換オレフィンの合成において、熱力学的に不安定な Z-オレフィンを形成することは至難の業であった。
Schrock と Hoveyda は、先の不斉メタセシス触媒をさらにファインチューニングし、この Z-選択的オレフィンメタセシスを実現した[12]。かさ高いビナフトール部分が、触媒の一方の面をほぼ覆い隠すことにより、Z 体の生成が有利な中間体に規制されると見られる。
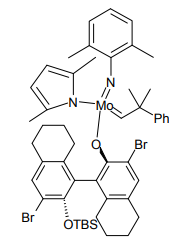
Z-選択的オレフィンメタセシス触媒
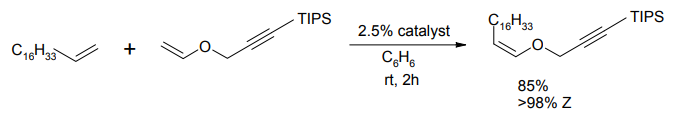
最近に Grubbs らによって、ルテニウム系触媒でも Z-選択的オレフィンメタセシスが行える事が報告された。NHC 配位子に結合したアダマンチル基が、C-H 結合活性化を受けて中心のルテニウムに結びついた構造を持つ。E-Z 選択性は 9:1 程度であるが、簡便な操作で Z-選択的クロスメタセシスが実現している。
Z-選択的オレフィンメタセシス
オレフィンメタセシスにノーベル賞が授与されてすでに 7年が経過した。しかしここに示したように、その進化はいまだとどまるところを知らない。今後、さらなる選択性や効率の向上、基質適用範囲の拡大を求め、研究レースはなお続くこととなるであろう。
すでにオレフィンメタセシスは、高分子合成、超分子化学、ケミカルバイオロジーなど様々な分野にインパクトを与えており、新たな触媒の開発は多方面に影響を及ぼしうる。今後の研究の進展を、興味深く見守りたい。
参考文献
- 最近の総説:Adv. Synth. Catal., 349, 1-265 (2007).( Special Issue: Olefin Metathesis); A. Fürstner:Chem. Commun., 47, 6505 (2011). DOI: 10.1039/C1CC10464K
- S. F, Martin, Y. Liao, H. J. Chen:Tetrahedron Lett., 35, 6005 (1994). DOI: 10.1016/0040-4039(94)88060-3
- P. Schwab et al.:Angew. Chem., Int. Ed., 34, 2039 (1995).
- M. Scholl, et al.:Org. Lett., 1, 953 (1999). DOI: 10.1021/ol990909q
- S. J. Connon , S. Blechert:Angew. Chem., Int. Ed., 42, 1900 (2003).
- J. A. Love et al.:Angew. Chem., Int. Ed., 41, 4035 (2002).
- P. E. Romero, W. E. Piers:Angew. Chem. Int. Ed., 43, 6161 (2004).
- S. B. Garber et al.:J. Am. Chem. Soc., 122, 8168 (2000). DOI: 10.1021/ja001179g ; S. Gessler et al.:Tetrahedron Lett., 41, 997 (2000).
- Q. Cai et al.:Angew. Chem. Int. Ed., 48, 7428 (2009). DOI: 10.1002/anie.200903462
- I. C. Stewart et al.:Org. Lett., 9, 1589 (2007).
- S. J. Malcomson et al.:Nature, 456, 933 (2008). DOI: 10.1038/nature07594
- S. J. Meek et al.:Nature, 471, 461 (2011). DOI: 10.1038/nature09957
- K. Endo et al.:J. Am. Chem. Soc., 133, 8525 (2011). DOI: 10.1021/ja202818v




