【特別講座】新規高活性アルコール酸化触媒 Nor-AZADO の有用性
本記事は、OrganicSquare Vol.45 (2013年9月号)において、東北大学大学院薬学研究科 岩渕 好治 様に執筆いただいたものです。

はじめに
アルコールの酸化反応は、有機合成において有用なカルボニル化合物を獲得するための重要反応として古くから研究され、これまで幾多の優れた反応剤、手法が開発されてきた。歴史的には重金属酸化物を化学量論量用いる方法がいち早く発展、普及したが、研究対象とする分子のサイズと複雑さが増加するに連れて選択性・効率性に優れた酸化反応が求められ、Swern 酸化、超原子価ヨウ素試薬などの手法、反応剤が開発されてきた。
近年、グリーンケミストリーへの移行が求められ、環境負荷の大幅な削減を可能とする触媒的酸化法が活発に研究されている。その中で、有機ニトロキシルラジカル TEMPO を触媒とするアルコール酸化反応 (TEMPO 酸化、Figure 1)1)は、禁水、低温など厳密な条件設定を必要とせず、1~5 mol%当量の TEMPO 存在下、NaOCl を始めとした安価で入手容易な酸化剤を用いて、簡便な操作のもとに常圧、氷冷〜室温程度で速やかなアルコールの酸化を実現することから、天然物合成から医薬プロセス合成まで幅広い領域で応用研究が盛んに行われている 2)。
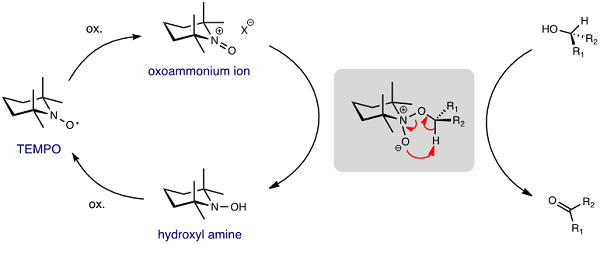
Figure 1. The proposed mechanism of TEMPO oxidation.
ところで有機ニトロキシルラジカルの応用研究の多くは、入手性に優れたTEMPOおよびその誘導体を用いて開拓されてきた経緯がある。このことは、有機ニトロキシルラジカルを触媒とするアルコール酸化にはさらなる可能性が秘められていると考えることができる。
当研究室では TEMPO が立体的に込み入ったアルコールの酸化を苦手としていることに着目し、TEMPO に比べて活性中心近傍の立体障害が緩和された有機ニトロキシルラジカルの可能性を追究してきた3,4,5)。TEMPO の N-oxyl 基を挟み込むα炭素に置換した 4 つのメチル基は、ニトロキシルラジカルの安定性を保障しており、メチル基を水素原子で置き換えたニトロキシルラジカルは速やかに不均化してニトロンとヒドロキシルアミンを与えることが知られている。
そこで Bredt 則 6)の観点からニトロンへの異性化に抵抗する分子骨格を持つ 1-Me-AZADO (2)および AZADO (3)を合成して触媒活性を検討した結果、それらの活性は我々の当初の期待を遙かに上回るものであることが判明した。特に AZADO (3)は TEMPO (1)に比べて 20 倍以上の反応速度を発揮するとともに、TEMPO では酸化困難な立体的に込み入ったアルコールの酸化を実現するものであった 3,5)。
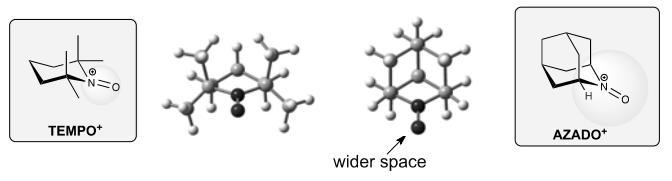
Figure 2. Comparison of structures of TEMPO+ and AZADO+.
究極の高活性アルコール酸化触媒を求めて:Nor-AZADO の可能性
触媒活性中心近傍の立体因子の低減が触媒活性の向上につながることから AZADO (3)よりもコンパクトで活性中心部を露出させた有機ニトロキシルラジカルは、より優れたアルコール酸化触媒となるはずである。しかし、環サイズを縮小した ABOO [8-azabicyclo[3.2.1]octane N-oxyl (6)]や ABHO[7-azabicyclo[2.2.1]heptane N-oxyl (7)]は「超安定ラジカル」としての安定性が低下し、徐々に分解することが報告されている 7)。
触媒活性種であるオキソアンモニウムイオンはニトロキシルラジカルよりもさらに不安定性が増大していることも懸念される。アルコール酸化触媒として活用できる有機ニトロキシルラジカル(オキソアンモニウムイオン)の構造限界はどこにあるのか?この素朴な疑問に答を与えるべく、我々は AZADO (3)の分子骨格に比べて 1 炭素分、環縮小したNor-AZADO (5)の酸化触媒としての性能を検証することとした。
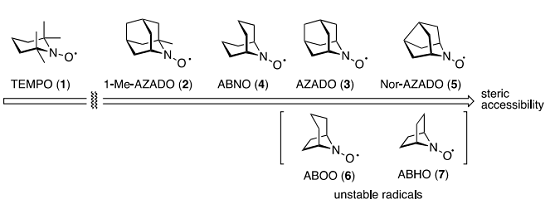
Figure 3. Structure of representative nitroxyl radicals and their reactivates.
分子モデルからは、Nor-AZADO の活性部位は AZADO に比べて剥き出した状態にあり、対応するオキソアンモニウムイオンの安定性を条件として、AZADO 以上の触媒活性と回転率を発現することが期待された。
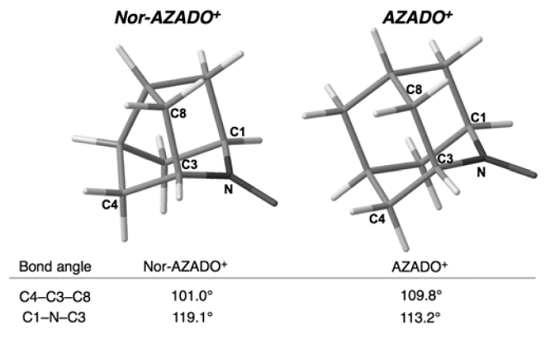
Figure 4. Calculated structures of Nor-AZADO+ and AZADO+.
Nor-AZADO は 1978 年、Rassat らによって合成され、超安定有機ニトロキシルラジカルとしての安定性が示されていたが 8)、対応するオキソアンモニウムイオンの生成や反応性については全く述べられていなかった。
Nor-AZADO の触媒活性
Nor-AZADO (5)は、佐々木・江口らによるアザノルアダマンタンの合成 9)を参考に Rassat らによる合成法に改良を加えて調製した(Scheme 1)。
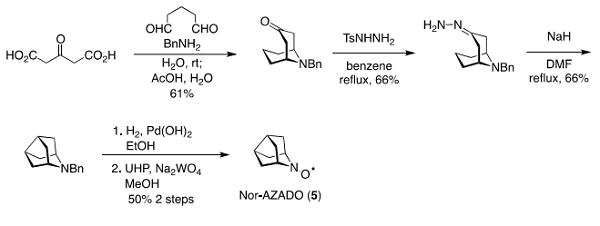
Scheme 1. Preparation of Nor-AZADO(5).
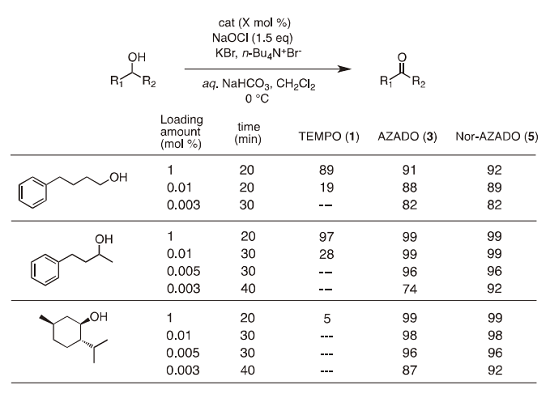
合成した Nor-AZADO (5)の触媒活性について、NaOCl を共酸化剤とする Anelli らの条件下に検討を行った。 4-フェニル-1-ブタノール、 4-フェニル-2-ブタノール、メントールの三種アルコールを基質として触媒量を順次減じてその触媒効率について検討を行った結果、Nor-AZADO (5)は AZADO (3)に比べ高い触媒活性を示すことが確認された(Table 1)10)。
Table 1. Comparison of catalytic activities under Anelli's condition.
NOx を共酸化剤とするアルコールの空気酸化における Nor-AZADO の優れた触媒活性
空気中の酸素を酸化剤として利用しつつ水を唯一の副生物とする「空気酸化」は、究極の酸化プロセスと位置付けられ、活発な研究が展開されている。先に我々は、O2 と NOxおよび NOx と有機ニトロキシルラジカルの高い反応性を利用し、これをアルコール酸化に連結した触媒的アルコール酸化システムの確立を図った。
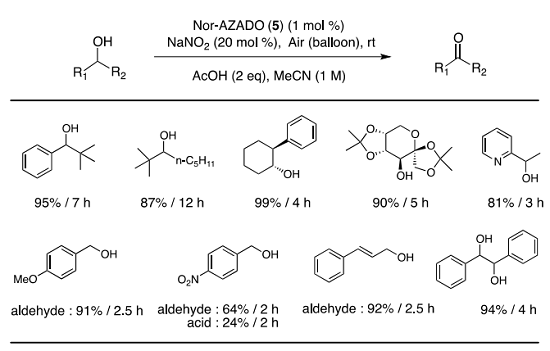
AZADO への官能基導入に基づく機能修飾を機軸として触媒効率を追究した結果、酢酸中、ニトロキシルラジカル触媒と NaNO2 を用いる常温常圧下の空気酸化反応の開発に成功した 11)。本条件では 5-F-AZADOが最良の結果を与える触媒となることが判明したが、触媒合成に多段階を要する点で課題を残していた。本空気酸化条件に Nor-AZADO を適用してみたところ、5-F-AZADO と同等の結果を与えることが確認された 10) (Table 2)。
その基質適用性について検討を行った結果、 Nor-AZADO (5) は5-F-AZADO と同様に種々のアルコール基質において効率的に空気酸化が進行した。1,2-ジオールは、酸化的開裂を起こすことなく高収率で 1,2-ジケトンを与えた。p-ニトロベンジルアルコールの反応では、カルボン酸への酸化が伴いアルデヒド選択性に課題を残した。
Table 2. Scope of Nor-AZADO (5) catalyzed aerobic oxidation.
光延試薬 DIAD を共酸化剤とするアルコール酸化反応 12)
有機ニトロキシルラジカルを触媒とするアルコール酸化反応では、経済性と簡便性から次亜塩素酸ナトリウムが共酸化剤の第一選択となっている。しかしながら,次亜塩素酸ナトリウムは、オレフィンや電子供与基の置換した芳香環と直接反応することから基質適用性には制限を与えてしまう。このような基質に対しては、ジアセトキシヨードベンゼンを用いる条件が有効であることが知られているが 13)、ジアセトキシヨードベンゼンも1,2-ジオールの酸化的開裂反応が進行する 14) など問題を有しているため、新たな共酸化剤の開発が望まれている。
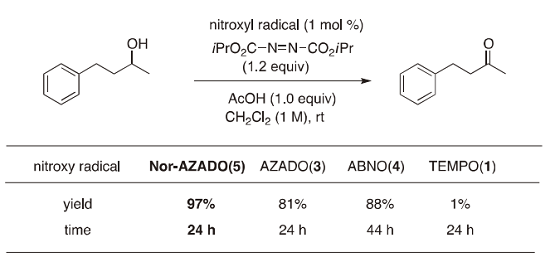
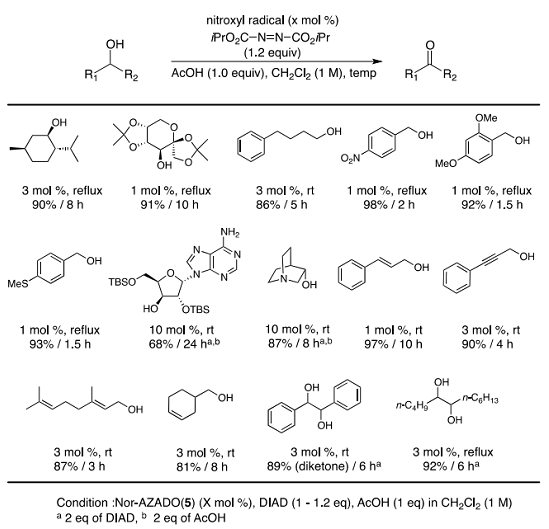
我々は、ヒドロキシルアミンをニトロソ化合物へ酸化することが知られていたアゾジカルボキシレート 15) に着目して、共酸化剤の開発を行った。その結果、AZADO (3)、ABNO (4)、Nor-AZADO (5)を触媒として、ジクロロメタン中、酢酸添加条件において、diisopropyl azodicarboxylate (DIAD)を共酸化剤とするアルコール酸化反応が進行することを見出した。特に、Nor-AZADO (5)は、AZADO (3)や ABNO (4)を用いた場合に比べ短時間で反応が完結した。本反応条件においては、TEMPO (1)を 3 mol%用いてもほとんど反応は進行しなかった(Table 3)。
Table 3. Comparison of catalytic activities.
Nor-AZADO (5)と DAID を用いる反応条件の基質適用性について検討を行った結果、次亜塩素酸ナトリウムを用いる条件が適用できない二重結合を有する基質にも適用可能であるばかりでなく、ジアセトキシヨードベンゼンを用いる条件の適用が難しい 1,2-ジオール基質においても収率よく酸化反応が進行した。空気酸化でアルデヒド選択性が問題となったp-ニトロベンジアルアルコールにおいても、高選択的にアルデヒドが得られた(Table 4)。
Table 4. Scope of Nor-AZADO (5)/DIAD/AcOH System.
おわりに
AZADO (3)と Nor-AZADO (5)はメチレン一つが異なるだけにもかかわらずその触媒活性には確かな影響を与えることが明らかになった。Nor-AZADO は AZADO では解決できない問題を解決するポテンシャルを有している。本稿で紹介した有機ニトロキシルラジカルを触媒とするアルコール酸化反応が、カルボニル化学に基づく有機合成の発展の一助となることを願っている。
謝辞
本稿に記載された内容の一部は第一三共株式会社プロセス化学研究所 林 政樹博士との共同研究によって得られたものである。
参考文献
- Adam, W., Saha-Möller, C. R., Ganeshpure, P. A.:Chem. Rev., 101, 3499 (2001). DOI: 10.1021/cr000019k
- Ciriminna, R., Pagliaro, M.:Org. Process Res. Devel., 14, 245 (2010). DOI: 10.1021/op900059x
- Shibuya, M., Tomizawa, M., Suzuki, I., Iwabuchi, Y.:J. Am. Chem. Soc., 128, 8412 (2006). DOI: 10.1021/ja0620336
- Shibuya, M., Tomizawa, M., Sasano, Y., Iwabuchi, Y.:J. Org. Chem., 74, 4619 (2009). DOI: 10.1021/jo900486w
- Shibuya, M., Sasano, Y., Tomizawa, M., Hamada, T., Kozawa, M., Nagahama, N., Iwabuchi, Y.:Synthesis, 3418 (2009).
- Fawcett, F. S.:Chem. Rev., 47, 219 (1950). DOI: 10.1021/cr60147a003
- Mendenhall, G. D., Ingold, K. U.:J. Am. Chem. Soc., 95, 6395 (1973). DOI: 10.1021/ja00800a039
- Dupeyre, R. M., Rassat, A.:Tetrahedron, 34, 1501 (1978).
- Sasaki, T., Eguchi, S., Kiriyama, T.:Tetrahedron, 27, 893 (1971).
- Hayashi, M., Sasano, Y., Nagasawa, S., Shibuya, M., Iwabuchi, Y.:Chem. Pharm. Bull., 59, 1570 (2011). DOI: 10.1248/cpb.59.1570
- Shibuya, M., Osada, Y., Sasano, Y., Tomizawa, M., Iwabuchi, Y.:J. Am. Chem. Soc., 133, 6497 (2011). DOI: 10.1021/ja110940c
- Hayashi, M., Shibuya, M., Iwabuchi, Y.:J. Org. Chem., 77, 3005 (2012). DOI: 10.1021/jo300088b
- De Mico, A., Margarita, R., Parlanti, L., Vescovi, A., Piancatelli, G.:J. Org. Chem., 62, 6974 (1997). DOI: 10.1021/jo971046m
- Nicolaou, K. C., Adsool, V. A., Hale, C. R. H.:Org. Lett., 12, 1552 (2010). DOI: 10.1021/ol100290a
- Taylor, E. C., Yoneda, F.:Chem. Commun., 199 (1967).




