【特別講座】アミド縮合剤の進歩
本記事は、OrganicSquare Vol.46 (2013年12月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

アミド結合は、有機合成において最も頻出する官能基のひとつである。生命にとっての最重要物質であるタンパク質は、アミド結合の塊というべきものだし、各種の天然物、医薬、ナイロンやケブラーなどの人工高分子に至るまで、アミド結合を含む化合物は身近にも数知れない。アミド結合を形成する反応が、長く有機化学における重要課題であり続けているのは、当然のことといえよう。
温和な条件で、他の官能基に影響を与えず、効率よくアミド結合形成が行える縮合剤の開発は、現在もたゆみなく続いている 1)。本稿では、そうした縮合剤について、まとめてご紹介したい。
アミド結合を作る
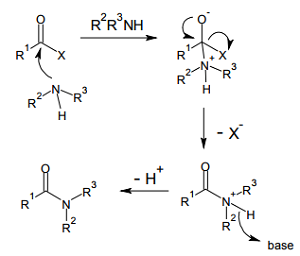
アミド縮合反応は、カルボン酸誘導体(R-COX)のカルボニル炭素に対してアミンが求核攻撃し、脱離基が HX の形で抜けていく形で進行する。X- の脱離能が高いほど、反応は速いといえる。脱離能の高さは、おおむね「HX の酸性度の高さ」に比例すると考えてよい。
すなわちアシル化剤の反応性の高さは、だいたい次の順となる。活性エステルは、通常のアルキルエステルなどより脱離能の高い、特殊なエステルを指す。
酸塩化物 > カルボン酸無水物 > 酸アジド > 活性エステル
ただし反応性が高ければいいというものではなく、αアミノ酸の縮合などの場合には、一般に隣接する不斉点のエピ化も速まってしまう。酸塩化物などはエピ化が極めて速く、このためペプチド合成の際にはほとんど適用されない。反応性とエピ化速度という相矛盾する要求を満たすため、様々な縮合剤が工夫されてきた。
Schotten-Baumann 反応
信頼できるアミド結合形成反応として、最も古くから化学者たちに愛用されているのは、Schotten-Baumann 反応であろう。1880 年代に報告された反応ながら、コスト面などで優れており、簡単な基質の場合には現在もよく用いられる。「縮合剤」の範疇には入らないが、比較対象として取り上げておきたい。
水または含水溶媒中で、酸塩化物とアミンを塩基存在下に撹拌するのが標準的な手法である。塩基としては、水酸化ナトリウムや炭酸ナトリウムなどを用いることが多い。塩基は多すぎれば酸塩化物と反応してしまうし、少なければ発生する酸を中和できず、アミンの反応性を落としてしまう。このため、酸塩化物と塩基を別々の容器から、少しずつ滴下していくという方法も用いられる。また反応の際に発熱するので、特に大スケールの際には効率よく冷却を行う必要がある。
近年では、非プロトン性の有機溶媒を用い、トリエチルアミンやピリジンなどを塩基として用いることが多く、これも Schotten-Baumann 反応の変法とみなすことができる。
カルボジイミド系縮合剤
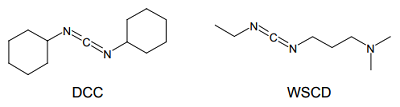
縮合剤の始まりは、1955 年に報告された N,N'-ジシクロヘキシルカルボジイミド(DCC, DCCD あるいは DCCI とも)であろう 2)。カルボジイミド(R-N=C=N-R')という官能基は一般に不安定だが、両端のシクロヘキシル基によって立体的に保護されているため、安定に取り扱える。
DCC は、アミン及びカルボン酸と混合するだけでアミドが得られるため、一時期広く用いられた。しかし強い発がん性やアレルギー誘発作用がある上、副生成物が不溶性のため処理が面倒であるなど、非常に欠点の多い試薬でもある。そこで近年では、この欠点を解消した水溶性カルボジイミド(Water Soluble Carbodiimide, WSCD)がよく用いられるようになった 3)。この試薬は毒性も低く、副生成物も水溶性であるために、除去が容易なのが特長である。
これらカルボジイミドによるアミド形成は、カルボン酸から酸無水物を作り、これがアミンと反応してアミドを形成するのが主要な経路と考えられている。酸無水物もまた活性が高いため、エピ化を完全には避け切れない。
そこで、ある種のアルコールを 1 当量加え、いったん活性エステルとしてからアミド化を行う方法が考案された。アルコールとして様々な試薬が試されたが、活性が高く、弱塩基による洗浄で簡単に除去できる 1-ヒドロキシベンゾトリアゾール(HOBt)がよく用いられる 4)。
カルボン酸とアミン、当量または小過剰の WSCD と HOBt を溶媒中撹拌するという条件は、長らくペプチド合成におけるスタンダードな手法として用いられている。ペプチド合成以外でも、酸塩化物が使えないような基質であれば、この条件が有力な選択肢となる。
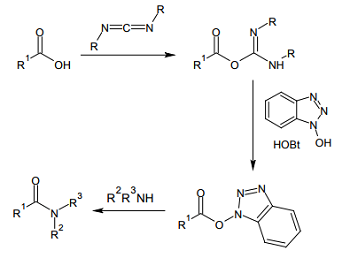
ただし、無水の HOBt は爆発性があり、融点近い温度まで加熱すると危険である。高温かつ多量に用いる場合には、一水和物を用いるのが安全である。
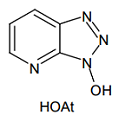
また HOBt の 7 位の CH 単位を窒素に置き換えた 1-ヒドロキシ-7-アザベンゾトリアゾール(HOAt)は、さらに活性が高い 5)。これは、7 位窒素が基質アミンと水素結合することにより、反応点近くに引き寄せる効果があるためと見られる。アミンの求核性が低い、立体障害が大きいなどの理由で縮合反応が進行しにくいときには、これを試す価値がある。
酸アジドを経由する縮合剤
ジフェニルリン酸アジド(DPPA)が登場したのは 1972年のことだが 6)、現在も広く用いられており、有機化学系の研究室ならたいてい棚に並んでいる試薬のひとつだ。この試薬の特徴は、カルボン酸を直接に酸アジドへと変換できる点にある。
酸アジドはアミンと反応してアミドを形成するが、活性化の度合いが温和なため、水酸基などが分子内に共存していても問題がない。また、ペプチド鎖同士のカップリングに用いても、最もエピ化の度合いが少ない縮合法とされている。DPPA による縮合のメカニズムは、下図のようなものであると考えられる。
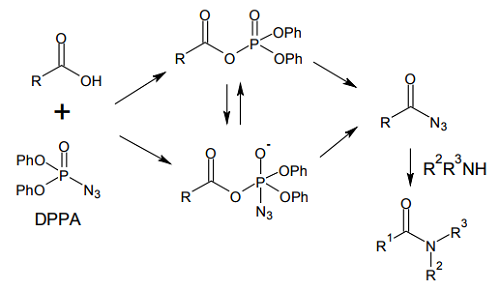
DPPA はアジドを含んでいるが、リン原子の安定化効果があるため、爆発などの危険はないとされる。反応終了後は、弱アルカリによる洗浄によって、簡単に副生成物を除去可能なのも大きな長所である。また、カルボン酸との反応で生じた酸アジドをそのまま加熱すれば、Curtius 転位によってアミンへと変換できるなど、応用範囲は幅広い。
BOP 系試薬
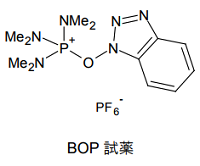
DPPA はリン酸とアジドの組み合わせによって、カルボン酸を酸アジドに変換する試薬であったが、これと同じ着想で活性エステルへ変換する試薬が、Castro らによって開発された 7)。まず登場したのが BOP 試薬と呼ばれるもので、ヘキサメチルリン酸トリアミド(HMPA)と HOBt を組み合わせたような構造を持つ。
BOP 試薬も、DPPA と類似のルートで活性エステル(R-COOBt)を形成するものと考えられる。ただしこの試薬は、副生成物として発がん性の HMPA を生じるという難点がある。
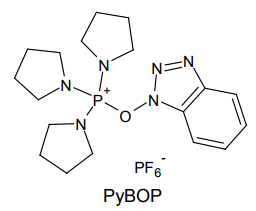
そこでジメチルアミノ基をピロリジノ基に置き換えた PyBOP が開発された 8)。これにより発ガン性の問題が解決できるため、近年ではオリジナルの BOP 試薬は用いられなくなっている。
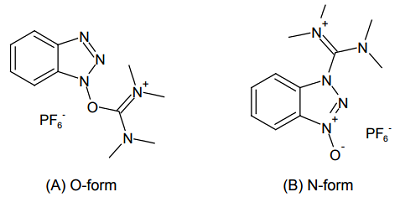
また、BOP 試薬のリンを炭素に置き換えることで、ウロニウム型縮合剤と呼ばれる試薬も開発された。代表的な試薬として、O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロホスファート(HBTU)がある。
これは下図(A)のような構造を想定して合成されたため「ウロニウム」の名がついたが、実際にはほとんどが(B)のような構造をとっていたことが判明している。カウンターアニオンとしてテトラフルオロホウ酸イオン(BF4-)を持ったもの(TBTU)も市販されているが、カップリングの性能にはほとんど差はない。
またこの骨格を HOAt と組み合わせた、HATU 及び TATUと呼ばれる試薬も知られており、さらに優れた反応性を示すことがわかっている。
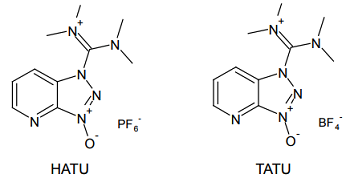
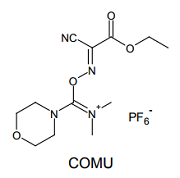
こうしたウロニウム系縮合剤の最新版は、2009 年に登場した COMU と呼ばれる試薬だろう 10)。やはり活性エステルを経由してアミド化が進み、HATU と同等またはそれ以上の速度で反応が進行する。立体障害の大きい基質でもスムーズに反応は進行し、爆発性の HOBt などの使用が避けられる点も優れている。
トリアゾール系縮合剤
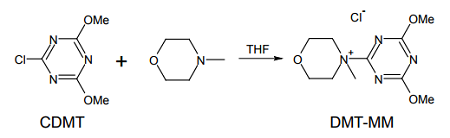
このように、近年の縮合剤はウロニウム系試薬を中心に研究が進められてきたが、トリアゾール系化合物の縮合剤としての機能に近年注目が集まっている。すなわち、安価な塩化シアヌルとメタノールから得られる、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)は、三級アミンなど塩基の存在下、カルボン酸と反応して活性エステルを形成する。これはアミンと反応し、収率よくアミドを与える。ただし CDMT は刺激性が強く、縮合剤として他より取り立てて優れた面があるわけでないため、今まで注目されてこなかった。
国嶋らは、この CDMT は三級アミン、例えば N-メチルモルホリンと反応して下図のような塩(DMT-MM)を作り、これがそのまま優れたアミド結合生成機能を持つことを見出した 11)。縮合速度やラセミ化の度合いなど、これまで開発された各種縮合剤に比べても全く遜色ない。
DMT-MM は水やエタノール中でも安定に存在し、アミド縮合反応も問題なく進行する点が特徴的である。多くの有機溶媒への溶解度は低いが、懸濁状態でもアミド縮合は十分な速度で行える(通常、室温で数時間程度)ため、基質に合わせて最適な溶媒を選択することができる。
水やアルコール系溶媒でも反応が行えること、試薬を混ぜて撹拌し、反応終了後は水で洗浄するだけの操作で、目的のアミドが高収率で得られる点など、これまでの縮合剤に比べてもずっと簡便であることが特長といえる。有機合成の技術に習熟していない他分野の研究者などでも、安心してアミド結合形成を行えるのは大きなメリットであろう。もちろん本職の有機合成化学者にとっても極めて魅力的な縮合剤であり、その応用範囲は年々広がりつつある。
アミド結合形成などは日常よく行う反応であり、さほど考えることもなく手慣れた条件を使ってしまいがちだ。しかしその奥は深く、少し条件を変えるだけで驚くほど効率が改善されることも少なくない。こうした基本的な反応のレパートリーを増やしておくことも、優れた研究者になるための条件ではないだろうか。
参考文献
- アミド結合形成に関して、多くの成書や総説がある。例えば、「ペプチド合成の基礎と実験」 泉谷信夫 丸善(1985);「実験化学講座 16 有機化合物の合成 IV カルボン酸・アミノ酸・ペプチド」 日本化学会 編 丸善出版(2005).
- J. Am. Chem. Soc., 77, 1067 (1955). DOI: 10.1021/ja01609a099
- J. Org. Chem., 26, 2525 (1961). 10.1021/jo01351a093
- Chem. Ber., 103, 788 (1970).
- J. Am. Chem. Soc., 115, 4397 (1993). DOI: 10.1021/ja00063a082
- 有合化, 31, 666 (1973).
- Tetrahedron, 36, 3413 (1980). DOI: 10.1016/0040-4020(80)80193-1
- Tetrahedron Lett., 31, 205 (1990). DOI: 10.1016/S0040-4039(00)94371-5
- ウロニウム系縮合剤総説:Tetrahedron, 60, 2447 (2005).
- Chem. Eur. J., 15, 9404 (2009). DOI: 10.1002/chem.200900615
- Tetrahedron Lett., 40, 5327 (1999). DOI: 10.1016/S0040-4039(99)00968-5 : Tetrahedron, 57, 1551 (2001). DOI: 10.1016/S0040-4020(00)01137-6




