【総説】高性能ホスフィン配位子:Silica-SMAP
本記事は、和光純薬時報 Vol.84 No.4(2016年10月号)において、和光純薬工業 試薬化成品研究所 三宅 寛が執筆したものです。
はじめに:Silica-SMAPとは
トリアルキルホスフィンは強いσ-供与効果から金属配位子として、有機合成化学や有機金属化学、錯体化学と広い分野で利用されている。一般に不安定であり、取扱いに注意を要する(グローブボックスなど)。
高活性なホスフィンというと不安定(=酸素に弱い)という認識があるため、本稿では『空気中で酸化されないトリアルキルホスフィン』であるSilica-SMAPを高性能ホスフィンと区別することにする。
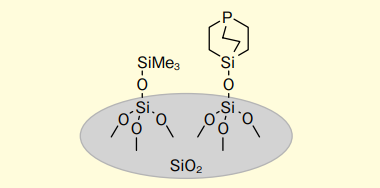
図1.Silica-SMAP の概略図
Silica-SMAP(Silicon-constrained Monodentate Alkyl-Phosphine)は北海道大学大学院 理学研究院教授の澤村先生によって開発されたトリアルキルホスフィンであり、SMAPと呼ばれるかご型構造を持つホスフィンをシリカゲルに固定化している。
立体的にも電子的にもPMe3とは対照的に、本品は『空気中で酸化されない』特長がある。これはかご型構造の剛直性のため、空気酸化の際に必要とされるP原子を中心とする結合角の変化が起こりにくいことが原因と考えられている。(空気に対する安定性に関しては2年経過しても性能に問題がないことを当社にて確認している。)
また、シリカゲル上のホスフィンが離れた位置で金属と1:1の錯体を形成し、金属のまわりに広い触媒空間を作り出すことが可能なため、高い性能を有している。さらに、反応後の処理では固定化触媒と同様、濾過するだけで金属触媒及びSilica-SMAP共に除去することができる。
上述した特長を有するSilica-SMAP(P:約0.07 mmol/g)はさまざまな金属触媒と錯体を形成し、(1)C-Hほう素化反応、(2)塩化アリールのほう素化カップリング反応、(3)鈴木-宮浦クロスカップリング反応、(4)ケトンのヒドロシリル化反応にしようできる。
お客様の反響が大きく、当社としてもバルク供給を目指して合成検討し、現在では1kg合成できる製法を確立している。以前に(1)C-Hほう素化をメインとして原稿を澤村先生に執筆いただいているため(和光純薬時報 Vol.82, No.1 (2014))、今回は(2)塩化アリールのほう素化カップリング反応例を紹介する。
Silica-SMAP-Pd系による塩化アリールのほう素化カップリング
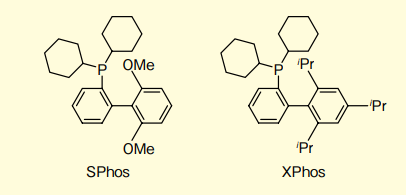
図2.SPhos と XPhos の構造式
一般にクロスカップリング反応において、使用するハロゲン化アリールの反応性はI>Br>Clとなることから、よう化アリールまたは臭化アリールが多く使用されている。一方、価格面で観るとCl>Br>Iであり、さらに市販されている化合物数でも同様にCl>Br>Iとなる。
即ち、塩化アリールで効率的にクロスカップリング反応が進行すれば、コストが低く基質選択性の幅も広がるメリットがある。従来、反応性の低い塩化アリールをクロスカップリングに用いる場合、SPhosやXPhosのような電子リッチで嵩高いホスフィン(図2)が必要であった1)。
しかし、Silica-SMAPはコンパクトなホスフィンでありながら効率的に反応が進行する2)。尚、反応液を濾過した後の濾液に含まれるPdはICPにて検出限界以下である。
Silica-SMAP-Pdを用いる塩化アリールのほう素化カップリング反応では、電子供与性置換基または電子吸引性置換基のいずれも高い収率で目的物が得られる(図3)。
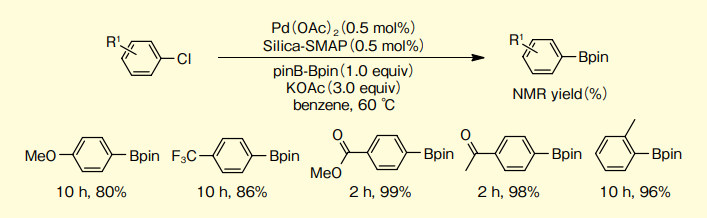
図3.さまざまな置換基を有する塩化アリールのほう素化カップリング
4-クロロトルエンとpinB-Bpinのカップリング反応では、さまざまなホスフィンは不活性であるのに対し、Silica-SMAP及びXPhosは有効であることがわかる(図4)。
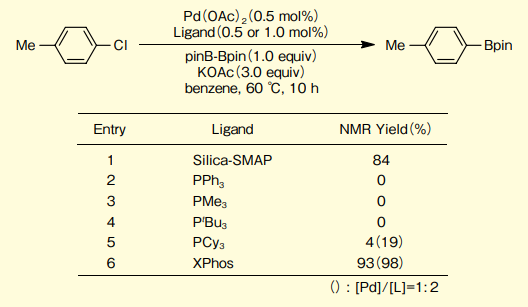
図4.4- クロロトルエンのほう素化カップリングでの配位子効果
基質に2,6-ジメチルクロロベンゼンを用いた場合、本品がSPhos及びXPhosを上回る触媒性能が示された(図5)。
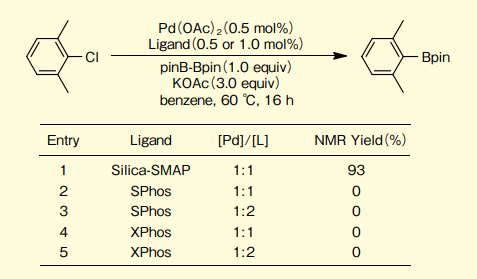
図5.2, 6- ジメチルクロロベンゼンのほう素化カップリングでの配位子効果
特筆すべきは、2,6-ジフェニルクロロベンゼンや2,4,6-トリイソプロピルクロロベンゼンのような嵩高い塩化アリールでも良好な収率で対応するほう素体を与える(図6)。
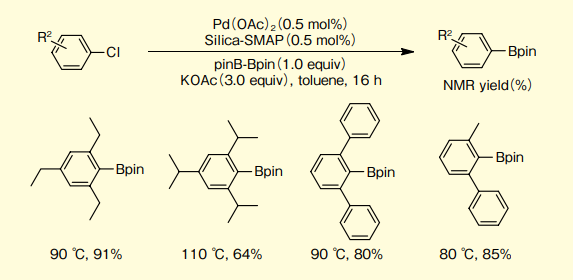
図6.2, 6- 二置換塩化アリールのほう素化カップリング
本品はパラジウム触媒を用いた塩化アリールとアリールボロン酸の鈴木-宮浦クロスカップリング反応にも優れた反応性を示す(図7)。

図7.活性化されていない塩化アリールを用いた鈴木 - 宮浦クロスカップリング
Silica-SMAP-Ir系によるオルト位選択的芳香族C-Hほう素化
Silica-SMAPと[Ir(OMe)(cod)]2(Silica-SMAP-Ir)を用いるとジボロン化合物による芳香族C-Hほう素化が官能基オルト位で進行する3)。従来報告されていたビピリジン系配位子と[Ir(OMe)(cod)]2から調製される触媒では、立体障害を避けて進行する点で異なる4)。
エステル、アミド、カルバメート、スルホン酸エステルなどの官能基またはエーテル系官能基、塩素原子でオルト位のC-Hほう素化が起こる(図8)。安息香酸メチルのほう素化反応では、室温にて89%でほう素体を与えるが、PPh3、PtBu3、PCy3、PMe3では全く反応しない。
特に、無溶媒100℃の条件で触媒回転数20,000回を記録している。また、この触媒系はヘテロ芳香族化合物のオルト位C-Hほう素化反応5)、2-アルキルピリジンのピリジンN原子のγ位に位置するsp3-C-Hほう素化反応6)に適用できる。
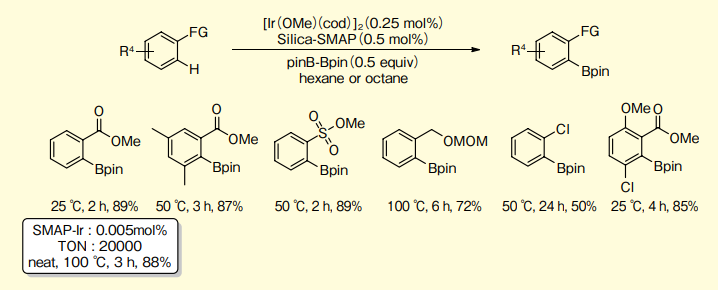
図8.オルト位選択的芳香族 C-H ほう素化
Silica-SMAP-Rh系によるN官能性芳香族化合物のオルト位C-Hほう素化
Silica-SMAPと[Rh(OH)(cod)]2の触媒系はN官能基を持つ芳香族化合物のオルト位C-Hほう素化に効果的である7)。2-フェニルピリジンのほう素化では98%で目的物を与えるが、他のホスフィンであるPMe3、PCy3、XPhosでは低収率となり、PPh3、PBu3、PtBu3、dtbpyでは全く反応が進行しない。
他の気質の例を図9に示す。また、イミン系官能基を有する基質の場合、類似ホスフィンであるSilica-TRIPが適している。
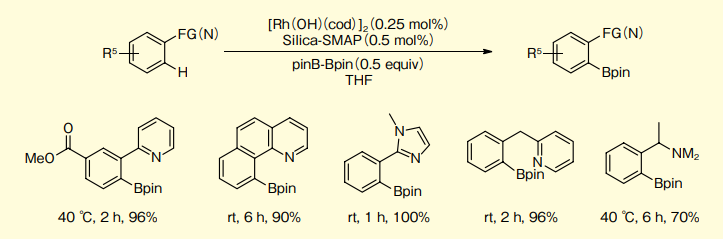
図9.N 官能性芳香族化合物のオルト位 C-H ほう素化
終わりに
さまざまな特長ある反応に適応できる高性能なSilica-SMAPの反応例を紹介した。当研究所でもスケールアップ合成に関して特に力を注いだ商品であり、これを用いた製造または研究が色々な分野で展開されることを期待する。
参考文献
- Martin, R. and Buchwald, S. L., : Acc. Chem. Res., 41, 1461 (2008). DOI: 10.1021/ar800036s
- Kawamorita, S., Ohmiya, H., Iwai, T. and Sawamura, M. : Angew. Chem. Int. Ed., 50, 8363 (2011). DOI: 10.1002/anie.201103224
- (a) Kawamorita, S., Ohmiya, H., Hara, K., Fukuoka, A. and Sawamura, M. : J. Am. Chem. Soc., 131, 5058 (2009). DOI: 10.1021/ja9008419 ;(b) Yamazaki, K., Kawamorita, S., Ohmiya, H. and Sawamura, M. : Org. Lett., 12, 3978 (2010). DOI: 10.1021/ol101493m
- (a) Mkhalid, I. A. I., Barnard, J. H., Marder, T. B., Murphy, J. M. and Hartwig, J. F. : Chem. Rev., 110, 890 (2010). DOI: 10.1021/cr900206p ;(b) Boller, T. M., Murphy, J. M., Hapke, M., Ishiyamma, T., Miyaura, N. and Hartwig. J. F. : J. Am. Chem. Soc., 127, 14263 (2005). DOI: 10.1021/ja053433g
- Yamazaki, K., Kawamorita, S., Ohmiya, H. abd Sawamura, M. : Org. Lett., 12, 3978 (2010). DOI: 10.1021/ol101493m
- Kawamorita, S., Murakami, R., Iwai, T. and Sawamura, M. : J. Am. Chem. Soc., 135, 2947 (2013). DOI: 10.1021/ja3126239
- Kawamorita, S., Miyazaki, T., Ohmiya, H., Iwai, T. and Sawamura, M. : J. Am. Chem. Soc., 133, 19310 (2011). DOI: 10.1021/ja208364a




