【テクニカルレポート】スモールスケールエレクトロポレーションにおけるCEPT試薬の細胞死抑制効果の検証 ―従来のROCK阻害剤Y-27632との比較―
本記事は、和光純薬時報 Vol.94 No.1(2026年1月号)において、愛知県医療療育総合センター 発達障害研究所 遺伝子医療研究部 加藤 君子 様に執筆いただいたものです。
はじめに
ヒトiPS細胞は、2006年の山中伸弥博士らによる樹立以降、再生医療や疾患研究における中核的な研究素材として確立されている。iPS細胞が研究素材として優れている理由として、以下の特性が挙げられる。
倫理的優位性:ES細胞と異なり、受精卵を使用せずに体細胞から作製可能であり、倫理的制約が少ない。
患者特異的モデルの構築:患者由来の体細胞から直接作製でき、個人の遺伝的背景を保持した疾患モデルを構築可能。原因遺伝子が未同定の疾患研究にも有用。
無限増殖能と多分化能:自己複製能を維持しながら、三胚葉系すべての細胞種へ分化可能。さらに近年では、ナイーブ型iPS細胞、8細胞期胚様細胞、胎盤前駆細胞への誘導や、3次元ヒト胚モデル(ブラストイド)の構築など、ヒト初期発生の様々な段階を再現可能。
ゲノム編集との高い親和性:単一細胞からのクローン樹立が可能であり、均一な遺伝子改変細胞株の作製に最適。
薬剤スクリーニングへの応用:同一遺伝的背景を持つ細胞を大量に作製できる潜在能力をもつ。
特に、CRISPR-Cas9等のゲノム編集技術との組み合わせにより、疾患関連変異の導入・修復による精密な疾患モデリングや、遺伝子機能解析が飛躍的に進展している。しかしながら、効率的な遺伝子導入法であるエレクトロポレーションには、大量の細胞(通常106細胞以上)を必要とし、iPS細胞の培養コストが高額であることから、研究の大きな負担となっている。
この問題を解決するため、少ない細胞数(104-105細胞)で実施するスモールスケールエレクトロポレーションが理想であるが、細胞数の減少に伴い細胞死が著しく増加することが新たな課題となっている。iPS細胞は特に単細胞解離に脆弱であり、従来使用されてきたROCK阻害剤Y-27632では、スモールスケール条件下で十分な保護効果が得られないケースが多い。
本研究では、細胞死抑制剤としての効果を有するCEPT(Chroman 1、Emricasan、Polyamine supplement、Trans-ISRIB)カクテル1, 2)を用いて、スモールスケールエレクトロポレーションにおけるヒトiPS細胞の生存率向上を検証した。特に、従来のY-27632と比較し、CEPTがより優れた細胞死抑制効果を示すことを実証することを目的とした。
| 手法 | 利点 | 欠点 |
|---|---|---|
| 通常スケールエレクトロポレーション | ・比較遺伝子導入効率が高い | ・大量のiPS細胞が必要 ・高額な培養・試薬コスト ・処理後の細胞死リスク |
| スモールスケールエレクトロポレーション | ・少ない細胞数で実施可能 ・コスト削減 |
・細胞死の著しい増加 ・クローン取得率の低下 |
| リポフェクション | ・少ない細胞数で実施可能 ・細胞への負担が少ない |
・iPS細胞での導入効率が低い |
表1.遺伝子導入法とその利点・欠点
スモールスケールエレクトロポレーションの課題と解決策
ヒトiPS細胞へのゲノム編集用プラスミドやリボ核タンパク質複合体(RNP)の導入手法には表1のようなトレードオフが存在する。
スモールスケールエレクトロポレーションの最大の課題は、細胞数減少に伴う生存率の急激な低下である。これは、電気刺激による直接的な細胞膜損傷に加え、iPS細胞特有の細胞間相互作用(E-カドヘリンを介した接着等)の減少によるアポトーシス誘導が原因と考えられる3)。この問題に対し、CEPTカクテルは複数の細胞死経路を同時に阻害することで、Y-27632を上回る保護効果を発揮することが期待される。
使用細胞と試薬
- ヒトiPS細胞株:201B7(山中因子導入により樹立された株)
- 培養培地:AK02N (Ajinomoto)
- 細胞死抑制剤:CEPTカクテル(富士フイルム和光純薬)またはY-27632(ROCK阻害剤、対照群)
エレクトロポレーション条件
- 装置:NEPA21(ネッパジーン)
- 細胞数:5×104-1×105個/サンプル(スモールスケール条件)
- 導入遺伝子/タンパク質:4 ug Cas9 (ニッポンジーン), 1 ug gRNA (crRNA+ATTO550 tracrRNA, IDT), 1 ug HDRプラスミド
- パルス条件(表2)
| Voltage(V) | Pulse length(ms) | Pulse interval(ms) | Number of pulses | Decay rate(%) | Polarity switching | |
|---|---|---|---|---|---|---|
| Poring pulse | 125 | 5 | 50 | 2 | 40 | + |
| Transfer pulse | 20 | 50 | 50 | 5 | 50 | ± |
表2.エレクトロポレーションの条件
評価方法
- 占有率評価法:細胞占有率の定量化には、局所的コントラスト差分法を用いた画像解析を実施した。この方法では、局所的な背景との差分を計算し、特定の閾値を超えた領域を細胞として検出した。サンプル特性に応じてパラメータを最適化し、検出結果を視覚的に検証した。
結果
CEPTとY-27632の細胞生存促進効果の比較
細胞占有率による生存評価を行った結果、CEPT処理群はY-27632処理群と比較して有意に高い細胞生存率を示した(図1)。
Y-27632を基準(100%)とした場合のCEPTの相対生存率は155.76±1.31%であり、約1.56倍の細胞保護効果が確認された(p < 0.001, Welchのt検定)。また、ATTO550陽性細胞の割合は、CEPT処理群とY-27632処理群の間に有意な差は認められなかった(データ示さず)。このことから、CEPTの使用が遺伝子導入そのものに悪影響を与えないことが確認された。
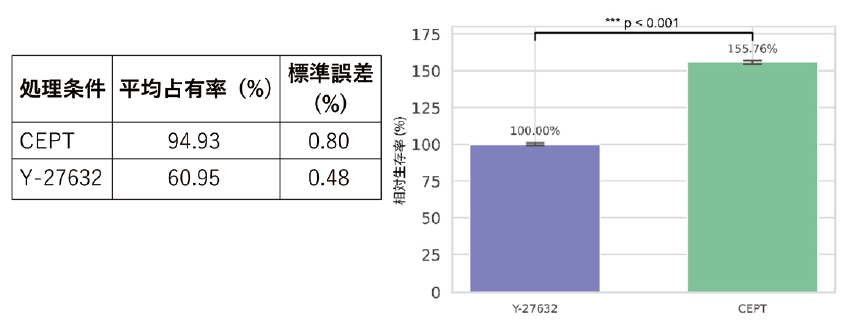
図1. CEPTとY-27632による細胞死抑制効果CEPTではエレクトロポレーション24時間後の細胞生存率が大幅に上昇した。
考察
本研究により、富士フイルム和光純薬のCEPTがY-27632と比較して優れた細胞死抑制効果を持つことが明らかとなった。CEPTの使用により、スモールスケールでのエレクトロポレーションにおける主要な問題点である細胞死を大幅に軽減することが可能となった。
終わりに
近年、CEPTカクテルを用いることにより、ナイーブ多能性幹細胞からのブラストイド形成効率が上昇するとの知見が相次いでいる(Yu et al., 2023, PMID : 37683605 ; Chen et al., 2025, PMID : 40961945 ; Pinzon-Arteaga et al., 2024, PMID : 39453814 ; Xie et al., 2025, PMID : 39814012)。プライム型iPS細胞からナイーブ型iPS細胞へのリプログラミングの促進効果は確認できなかったが(筆者ら未発表データ)、ナイーブ型iPS細胞からブラストイドを形成させる際には、是非とも使用したいと考えている。
参考文献
- Chen, Y. et al. : Nat. Methods, 18 (5), 528 (2021).
- 富士フイルム和光純薬株式会社,CultureSure™ CEPTカクテル(1,000x)
- Higo, S. et al. : Methods Mol. Biol., 2320, 235 (2021).
関連リンク
本製品の使用方法やその他アプリケーションは当社Webをご覧ください。




