【テクニカルレポート】試薬を用いた細胞老化検出と関連指標の併用測定例
本記事は、和光純薬時報 Vol.92 No.3(2024年7月号)において、株式会社同仁化学研究所 マーケティング部 津崎 兼土様に執筆いただいたものです。
1.はじめに
1981年Hayflickによって報告された細胞老化は、肺繊維芽細胞を8ヶ月以上継代培養した際に途中で増殖が遅くなり、細胞死に至ったことが発端となり発見された。細胞複製による老化が発端で発見された細胞老化は、その後の研究でテロメア長の縮小化だけでなく、がん遺伝子の活性化や酸化ストレス、DNA損傷等の外的要因でも引き起こされることが明らかとなった。遺伝的要因と外的要因が複雑に関与している細胞老化の誘導メカニズムや制御機構の全貌は解明されていないが、がんや種々の加齢性疾患と密接な関係性が示唆されており活発な研究が進められている。また体内の老化細胞を排除する薬剤(セノリティックドラッグ)の開発も健康寿命を延ばす可能性があるとして注目されている。
2.細胞老化の検出指標
前述の通り、細胞老化は細胞種や酸化ストレスなど生理学的な細胞の状態など、様々な要因によって引き起こされるため、これまで確認されているいずれのバイオマーカーも老化検出に特異的であるとはいえない。よって、複数の指標から判断し老化が起きているか否かを確認することが望ましいとされている。細胞老化を評価する際の一般的な検出指標として、細胞周期(DNA合成、p16/p21発現など)や細胞形態(細胞や核、核小体など)、SA-β-Gal (Senescence Assosiated-β- Galactosidase)活性、DNA損傷、酸化ストレス(ROS)、テロメア長、炎症性サイトカイン(Senescence Associated Secretory Phenotype : SASP)などが挙げられる。
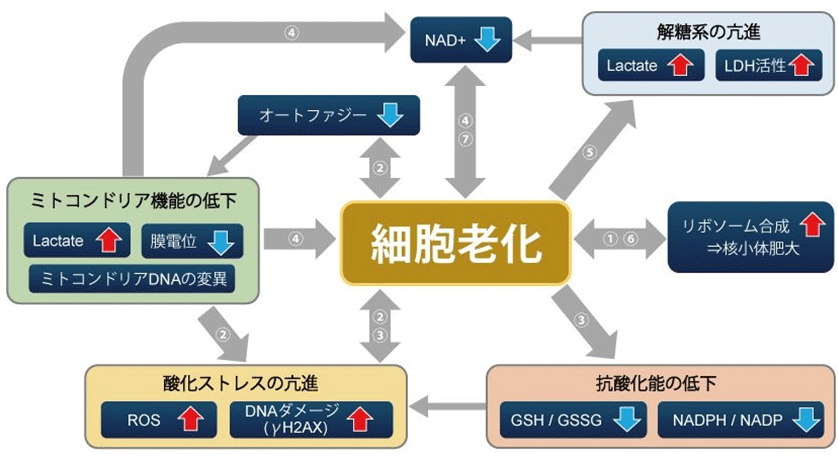
図1.細胞老化関連指標の相関マップ
3.試薬を用いた細胞老化の評価
細胞老化指標のなかでも汎用される指標(SA-β-gal活性、DNA損傷、核小体肥大)を検出可能な試薬を開発した。
1)SA-β-gal活性
開発品:Cellular Senescence Detection Kit−SPiDER-βGal
特長:代表的なSA-β-galの検出試薬としてX-gal染色が広く利用されているが、細胞膜透過性が乏しく細胞を固定化する必要がある、比色試薬であるため目視により染色費染色の細胞を判別する必要があり定量性に欠ける、染色に時間を要する、などが課題であった。本開発品に含まれるSPiDER-βGalは、高い細胞膜透過性と優れた細胞内滞留性を有したSA-β-gal検出蛍光プローブである。これにより固定化細胞での検出は勿論の事、特別な膜透過処理や固定化操作は不要となるため生細胞での測定に適応でき、短時間染色を実現できる。また、細胞膜を透過したSPiDER-βGalは、SA-β-galと反応することで蛍光を発し、かつ近傍のタンパク質と共有結合する事から蛍光顕微鏡やフローサイトメーターでの高感度検出ならびに定量性のあるデータ取得を実現している。
2)DNA損傷(γH2AX)
開発品:DNA Damage Detection Kit−γH2AX
特長:DNAダメージにより二重鎖切断が生じると、ヒストンタンパク質の一種であるH2AX が速やか、かつ広範囲にわたってリン酸化される。リン酸化H2AX (γH2AX)は、DNAダメージの鋭敏なマーカーであることから、細胞老化をはじめ、化学物質や活性酸素、紫外線や放射線などの遺伝毒性及び発がん性評価への応用が期待されている。開発品は抗γH2AX 抗体および蛍光標識二次抗体による抗原抗体反応を用いた簡便なγH2AX検出を実現している。
3)核小体肥大
開発品:Nucleolus Bright
特長: 核小体は膜を持たない核内構造体であり、内部にはリボソームを構成するリボソームRNA (rRNA) が多く存在している事からrRNAの転写やプロセシングなどリボソーム生合成の起点となる場所であることが知られている。また、核小体の変化は以前よりがんの病理診断の指標として知られていたが、近年では核小体ストレスを含め核小体とDNA損傷、ウイルス感染、オートファジーなどとの関連性が報告されており、なかでも老化細胞では正常細胞と比べ核小体の肥大化がみられることなど、多くの細胞内イベントに関与すると考えられている事から、様々な研究分野で注目されている。開発品はRNAに結合し蛍光性となる低分子蛍光色素で、RNAの中でも細胞内に最も多く存在するrRNAの産生の場である核小体で特に強い蛍光を示す。固定化した細胞に試薬を添加するだけでイメージングすることが可能であるため簡便な測定を実現している。
4.測定例:細胞老化指標および関連する細胞内指標の変化
ここではSA-β-gal活性およびDNA損傷(γH2AX)の検出を例に、老化誘導実験における細胞内複数指標の変化を捉えた実験を紹介する。
測定項目及び測定に用いた製品
① DNA損傷の蓄積(γH2AX発現亢進):DNA Damage Detection Kit−γH2AX (製品コード:G265)
② SA-β-gal発現亢進:Cellular Senescence Detection Kit−SPiDER-βGal (製品コード:SG03)
③ NAD+量:NAD/NADH Assay Kit−WST (製品コード:N509)
④ ミトコンドリア活性(ミトコンドリア膜電位):JC-1 MitoMP Detection Kit (製品コード:MT09)
⑤ ミトコンドリア活性(OCR):Extracellular OCR Plate Assay Kit (製品コード:E297)
⑥ 代謝シフト(ATP量、Lactate放出量):Glycolysis/OXPHOS Assay Kit (製品コード:G270)
実験:老化誘導によるA549細胞の代謝シフト
細胞老化が誘導されると、SA-β- galの発現亢進や不可逆的な細胞増殖停止といった現象が見られる他、DNAダメージが蓄積した老化細胞では、ミトコンドリア機能の低下によりエネルギー産生を解糖系にシフトする事が知られている。そこで、A549細胞をDoxorubicinで処理し老化誘導した際のSA-β-gal発現亢進およびエネルギー産生経路(NAD量、ミトコンドリア膜電位、ATP量、Lactate放出量)のシフトを確認した。結果より、A549細胞にDNA損傷が認められ(①)、SA-β-gal産生量が増加(②)した事から、Doxorubicin処理により細胞老化誘導が確認できた。また、DNA損傷に伴いDNA修復機構であるPARP (poly ADP-ribose polymerase)の活性化によりNAD+消費量が増加したことから細胞内NAD+量の減少(③)、およびSIRT1活性低下によるミトコンドリア機能低下(④、⑤)が確認できた。さらにミトコンドリア機能低下により酸化的リン酸化依存的なエネルギー産生を行うことができなくなり、エネルギー産生経路を解糖系へ移行する代謝シフトが確認できた(⑤)。各指標の検出は同仁化学研究所が開発した試薬を用いて測定し、その変化を捉えている(番号は図表に対応)。
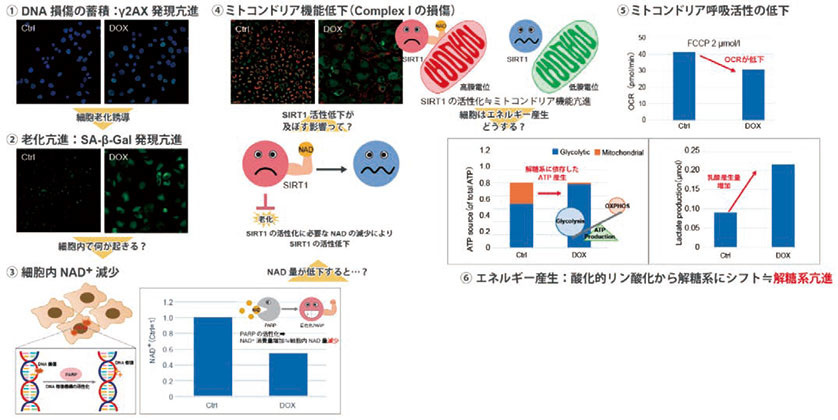
図2.同仁化学研究所製品を用いた細胞老化指標の測定例




