【連載】〈LC/MS分析 −測定原理から様々な分野での活用例− 最終回〉第4回 LC/MSのバイオ医薬品分析への利用
本記事は、和光純薬時報 Vol.92 No.3(2024年7月号)において、富士フイルム富山化学株式会社 富山研究開発センター 鹿野 真弘様に執筆いただいたものです。
背景
COVID-19パンデミックの発生に伴い、新たなタイプのワクチン製剤として複数のmRNA医薬品が上市された。mRNA医薬品とは、メッセンジャーRNA(mRNA)を原薬として内包した脂質ナノ粒子(Lipid Nano Particle、LNP)製剤である。mRNAを脂質成分で内包することにより生体内での安定性が付与され、標的である細胞まで送達される。
mRNA医薬品の利点は、mRNAにコードされたタンパク質を標的細胞で発現させることが可能で、ゲノムへの挿入変異リスクが無く、安全性が高いことである。また、目的のタンパク質に応じたmRNAの設計が容易であることから、パンデミックなどの緊急時に従来型のワクチンと比べて短期間で目的のワクチンを提供することが可能である。
mRNAの基本構造と品質管理
mRNAの基本構造は、4種類の塩基(A:アデニン、G:グアニン、C:シトシン、U:ウラシル)から構成されるポリヌクレオチドである。COVID-19ワクチンにおいては、ウイルスのスパイクタンパク質をコードし、生体内で目的となるタンパク質を翻訳される領域となる「翻訳領域」に加え、翻訳領域の前後に位置しタンパク質に翻訳されない「非翻訳領域」、mRNAの安定化に寄与する、3'末端に数十から百数十前後のアデニンが連続して付加された「ポリA鎖領域」、5'末端に三リン酸結合を介してグアノシンが結合した「5'-キャップ構造」から構成されている(図1)。
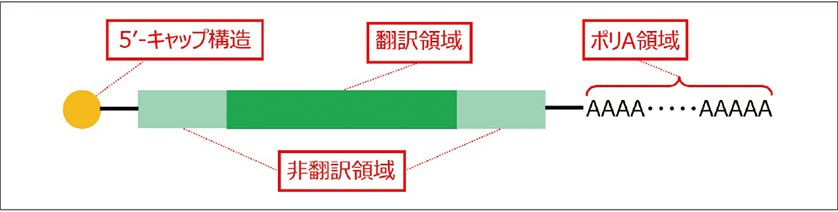
図1.mRNAの基本構造
mRNA原薬は新しいタイプの医薬品であり、その品質管理方法はmRNAの構造的特徴に準じ、これまでの医薬品では見られなかった評価項目が必要となっている1)。従来の医薬品でも必要であった含有量や、注射剤として用いるにあたり必要となるエンドトキシン試験などの良く知られた試験項目に加えて、力価を評価するためのCell based assayなどが必要と言われている。また純度試験として、製造工程で残留する可能性のある不純物である残存タンパク質や残存DNA、RNA内の核酸が相補的に結合してできる二本鎖RNAなどが知られている。これらに加えて、mRNAの構造的特徴である5'-キャップ構造についてもその状態を明らかにする必要がある。
天然型mRNAの5'末端は7-メチルグアニル基が結合しており、これを5'-キャップ構造と呼ぶ2)。この部位は、mRNAの安定性や翻訳効率の向上に寄与しており、mRNA医薬品の性能に大きく影響する重要な品質管理項目となっている。さらに、mRNAの先頭にある塩基のリボースの2'-ヒドロキシル基がメチル化されていない構造をCap 0、メチル化された構造をCap 1と呼び、Cap 1はCap 0と比較してin vivoにおける翻訳効率が向上しており、また宿主による免疫応答も回避することが可能であることが知られている(図2)。
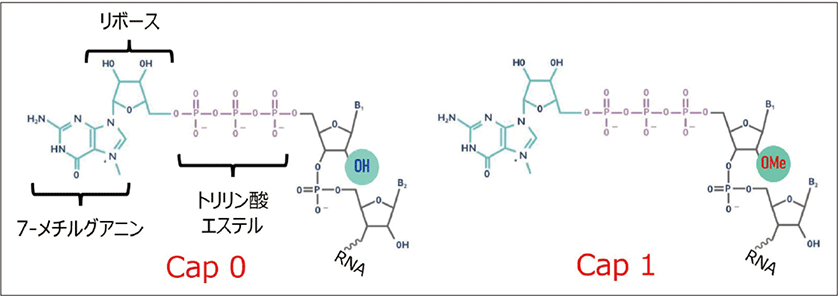
図2.5'-キャップ構造(Cap 0とCap 1)
mRNA原薬では、より安全性/有効性に優れていることが求められるため、このCap 1構造が採用されるが、この構造の詳細な情報(キャップ化の有無、Cap 1/Cap 0の構造の違い)が品質管理のために必要となる。
通常、2種類以上の成分をそれぞれ正確に分析するためには、液体クロマトグラフィーなどによる分離分析が必要となる。キャップ化の有無については構造上の違いが大きいため、LCやゲル電気泳動による分離が可能であり、比較的容易にサンプルを評価することが可能である。これに対して、Cap 1とCap 0の差異はメチル基ひとつ分の違いであり、LCなどによる分離分析の難易度が高くなるが、検出器として精密質量まで測定可能な飛行時間型質量分析装置(TOF)などを用いることにより、検出されるフラグメントの質量数の違いによりこれらを分離し、その含有量を測定することが可能である。
キャップ化率の測定
mRNA原薬の鎖長は数百~数千塩基であり、このままの状態で分析を実施することは難しいため、前処理としてmRNAを短い断片に切断し、分析試料とする。前処理方法としてはリボザイムを用いる方法とRNaseを用いる方法が知られており、今回の前処理としては、切断位置が特異的で、質量分析を行う際にターゲットとなるフラグメントが特定しやすいリボザイムにて約20 ntの断片に切断し、測定を行った。
LC/MS分析にはSCIEX ZenoTOF 7600型を使用した。測定対象である5'キャップ構造部分の親水性が高いため、カラムへの保持を向上させるために移動相にはイオンペア試薬であるジイソプロピルエチルアミンを含む組成とした。
20 ntのRNA断片は分子量約9000となるが、MS測定においてm/z = 9000の分子は検出できないため、多価イオンとして検出する必要がある。今回は10価~15価程度のイオンとして検出され、これらについて解析ソフトを用いてデコンボリューション処理することで1価のイオンに変換を行った。
測定サンプルのトータルイオンクロマトグラム、対象ピークのマススペクトル、及びデコンボリューション結果を図3~5に示す。トータルイオンクロマトグラムではほぼ一つのピークとして検出されていたものについて詳細に解析を行った結果、Cap 1成分やCap 0成分、もしくは未キャップ成分がそれぞれ検出され、その比率を測定することが可能であった。
次に、意図的にキャップ化率が異なるように合成した4種類のmRNAサンプルについて測定を行い、それぞれ適切な分析結果が得られるか検証した。
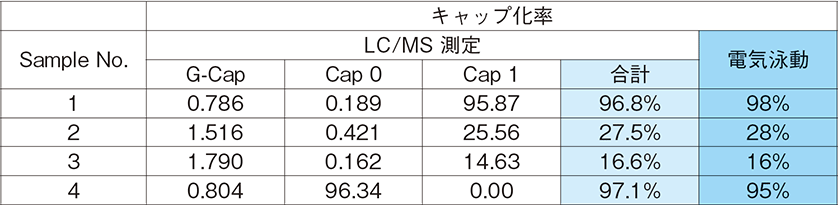
尚、あらかじめゲル電気泳動にてキャップ化率を測定し、LC/MS測定から得られた結果と比較を行った。結果を表1に示す。
この結果、LC/MS測定から得られた試験結果は電気泳動から得られた結果と良好な一致を示し、LC/MS分析においても適切なキャップ化率を測定できることが確認された。また、ゲル電気泳動など分離が不十分な測定法では確認することができなかった詳細なキャップ構造混合比率についても、LC/MSを用いることで測定可能であることが確認された。
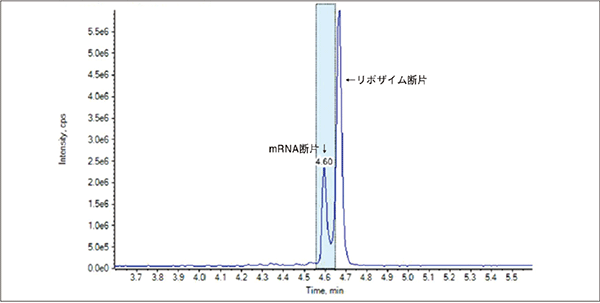
図3.トータルイオンクロマトグラム
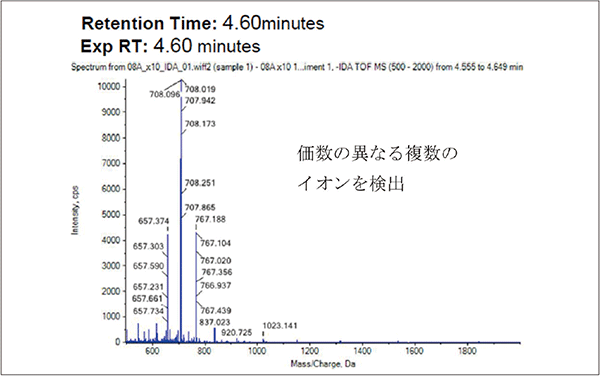
図4.対象ピークのマススペクトル
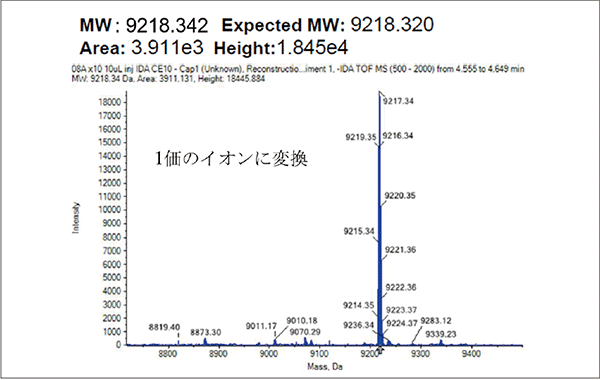
図5.デコンボリューション結果
-
表1.キャップ化率結果(LC/MSと電気泳動の比較)
まとめ
バイオ医薬品の分析、特に詳細な特性解析について、LC/MSを利用することで的確な情報を取得することが可能であった。今回のキャップ構造の特性以外にも、ポリA鎖に関する詳細な解析であったり、mRNAの配列情報を確定するためのオリゴヌクレオチドマッピングであったりなど、様々な評価においてLC/MSを利用することが必要となると考えられ、これからの技術開発を行っていく必要性があると感じている。
参考文献
- United States Pharmacopeia, Analytical Procedures for mRNA Vaccine Quality-Draft guidelines
- Banerjee, A. K. : Microbiol Rev., 1980 Jun ; 44 (2), 175 (1980)




