【総説】第十八改正日本薬局方第一追補とそのトピック
本記事は、和光純薬時報 Vol.91 No.3(2023年7月号)において、中外製薬工業株式会社 生産QA部 今若 太一様に執筆いただいたものです。
1. はじめに
日本薬局方は、学問・技術の進歩と医療需要に応じて、我が国の医薬品の品質を適正に確保するために必要な規格・基準及び標準的試験法等を示す公的な規範書である1)。
また、日本薬局方は、薬事行政、製薬企業、医療、薬学研究、薬学教育などに携わる多くの医薬品関係者の知識と経験を結集して作成されたものであり、それぞれの場で関係者に広く活用されるべき公共のものとして位置付けられており、厚生労働省ホームページ2)にて公開されている規範書でもある。
今般、「日本薬局方の一部を改正する件」(令和4年厚生労働省告示第355 号)が令和4年12月12日に告示されたことから、改めて日本薬局方の役割と改正内容について紹介する。
2. 日本薬局方の役割
日本薬局方の基本的な役割は医療に必要な医薬品全般の品質を適正に確保することである。この役割を果たすための課題として、『日本薬局方作成の5本の柱』を策定し、医薬品のグローバル化に向け、最新の学問・技術の積極的な導入・採用が行われている。
日本薬局方は医薬品医療機器等法において、「厚生労働大臣は、少なくとも10年ごとに日本薬局方の全面にわたって薬事・食品衛生審議会の検討が行われるように、その改定について薬事・食品衛生審議会に諮問しなければならない」ことが、医薬品医療機器等法上に明記されており、近年は5年ごとの改正のほか、その内に改正告示から1年6か月ごとに二度の改正薬局方追補の告示が行われている。
今回、令和4年12月12日付けで第十八改正日本薬局方第一追補による改正が行われた。次回改正は令和6年6月頃の改正(第十八改正日本薬局方第二追補)が予定されており、さらに令和8年4月頃には第十九改正日本薬局方の改定が予定されている(Fig.1)。

最近の日本薬局方は、我が国における保健医療上重要な医薬品の一覧となるとともに、国際社会の中においては、国レベルを越えた医薬品の品質確保にむけ、先進性及び国際的整合性の維持・確保に応分の役割を果たし、貢献することも求められている。
令和元年7月26日にはタイ王国保健省告示が改定され、タイ王国が日本薬局方を参照薬局方として採用した。日本薬局方はさらなる国際化の一層の推進を目指しており、アジア地域での貢献等を踏まえ、日本薬局方の国際化を図ることが求められている。
参考までに「薬局方」の由来は以下の通りである3)。
「薬局方」:名称の由来江戸時代、蘭方医中川淳庵(1739-1786)がオランダの薬局方「アポテーキ」を「和蘭局方」と訳したのが、書名での最初の使用といわれている。「局方」という言葉は中国宋代(1078-1085)に刊行された協定処方集『(太平惠民)和剤局方』に倣ったものだとされている。『和剤局方』は、日本に平安末期に伝わり、漢方製剤の適応症、薬剤名、処方量、調製法、用法用量などについて詳述され、江戸時代から明治初期まで利用されていた。
(オランダ語:Apotheek、ラテン語:Pharmacopoea、英語:Pharmacopoeia(英国)、Pharmacopeia(米国) 語源はギリシャ語の「薬」と「作り方」に由来。)
3. 第十八改正日本薬局方第一追補について5, 6)
第十八改正日本薬局方第一追補では、通則・生薬総則・製剤総則の改正は無く、一般試験法・医薬品各条・参考情報の改正が行われた(Table 1)。
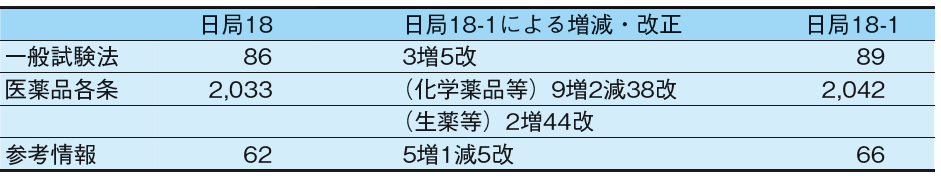
第一追補における一般試験法では、3増5改による改正が行われた。「2.00 クロマトグラフィー総論」、「2.27 近赤外吸収スペクトル測定法」、「2.28 円偏光二色性測定法」が新たに追加され、一般試験法5項目については改正が行われた。特に「2.00 クロマトグラフィー総論」はPDG(Pharmacopoeial Discussion Group:日米欧三薬局方検討会議)で調和合意された内容を総論として新設され、それに伴い、「2.01 液体クロマトグラフィー」、「2.02 ガスクロマトグラフィー」も記載整備が行われた。
医薬品各条では、化学薬品等では9増2減38改、生薬等では2増44改の改正が行われ、第一追補での医薬品各条の収載品目は2,033品目から2,042品目となった。
各条横断的な改正として、重金属試験及び個別金属不純物試験の削除(863品目)が行われた。本件については後述の『元素不純物管理への取り組み』で取上げる。
参考情報では5増1減5改による改正が行われ、新たに新規収載として「G1. 液の色に関する機器測定法〈G1-4-181〉」、「G1. クロマトグラフィーのライフサイクル各ステージにおける管理戦略と変更管理の考え方(クロマトグラフィーのライフサイクルにおける変更管理)〈G1-5-181〉」、「G2. せん断セル法による粉体の流動性測定法〈G2-5-181〉」、「G4. 微生物試験における微生物の取扱いのバイオリスク管理〈G4-11-181〉」、「G9. 製剤に関連する添加剤の機能性関連特性について〈G9-1- 181〉」が収載された。
なお、この告示による改正前の日本薬局方(以下「旧薬局方」という。)に収められていた医薬品の経過措置期間(猶予期間)について、令和6年6月30日までの間は、旧薬局方で定める基準(当該医薬品に関する部分に限る。)は新薬局方で定める基準とみなすことができるものとすることになっている。
4. 元素不純物管理への取り組み
今回の改正では第一追補における医薬品各条のトピックとして、USP-NF*、Pharma Euro(EP:European Pharmacopoeia)と同様に、各条横断的改正として、重金属試験及び個別金属不純物試験の削除(863品目)が実施された。
令和6年7月1日以降、一般試験法「2.66 元素不純物」が適用される医療用医薬品製剤(通則34**に適用)***及びその構成成分(原薬、添加剤など)では、医薬品各条の重金属及びヒ素などの個別金属不純物試験の規定に基づく管理が不要となることに伴い削除された7)。
*The United States Pharmacopeia (USP) and the National Formulary (NF).
***要指導医薬品及び一般用医薬品については、当面の間適用しない。
**日局通則34
日本薬局方の製剤は,原則として一般試験法の元素不純物に係る規定に従って適切に管理を行う.また,製剤,原薬及び添加剤などにおいて,当該管理を行った場合には,医薬品各条などで規定された重金属,ヒ素など元素不純物の管理は要しない.
削除に至った背景には、令和3年6月7日に告示・施行された第十八改正日本薬局方において、新たに通則34を設け、一般試験法「2.66 元素不純物試験法」にICH-Q3Dガイドラインの管理規定を示した参考情報「G1. 製剤中の元素不純物管理」を統合して一般試験法「2.66 元素不純物」に改正することにより、ICH-Q3Dガイドラインを踏まえた元素不純物管理を日本薬局方の製剤に適用させたことにある。
その後、令和3年6月7日付け薬生薬審発0607第1号、令和2年12月28日付け薬生審査発1228第7号により令和6年7月1日以降は一般試験法「2.66 元素不純物」による管理が求められることになった。
さらに通則34により令和6年7月1日以降は、一般試験法「2.66 元素不純物」が適用される医療用医薬品製剤及びその構成成分(原薬、添加剤など)では、医薬品各条の重金属、及びヒ素などの個別金属不純物試験の規定に基づく管理は不要となることから、今回の改正により各条横断的な改正として、重金属試験及び個別金属不純物試験の削除(863品目)が行われた。
これに伴い、元素不純物管理では重金属試験及び個別金属不純物試験が実施されなくなる一方で、そのリスクを評価するアセスメントが重要になってくる。リスクアセスメントの実施にあたっては、製販業者と製販以外の業者が歩み寄ることによって元素不純物を管理する上で必要な情報を相互に得ることにより、その質及び実効性が高まることが望まれており、医薬品における元素不純物の管理に関する両者の協力関係により、医薬品の安全性確保と医療への円滑な医薬品供給を適切に両立することが期待されている8)。
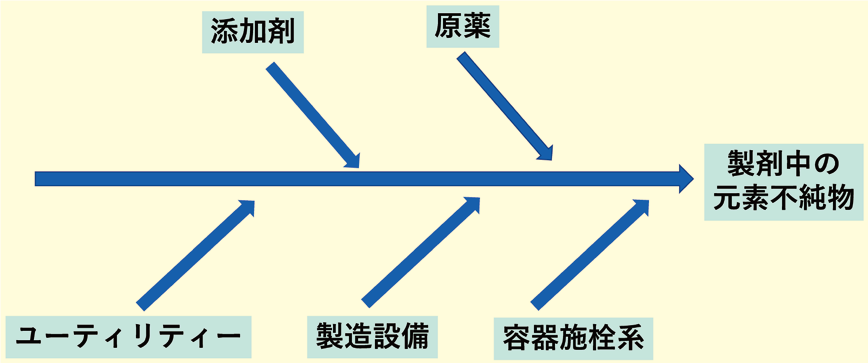
製剤中の元素不純物はFig.2の通り、5つの混入起源因子が関わってくる。適切に5つの因子に対し、リスクアセスメントはリスクのレベルに応じて実施すべきであり、必ずしも原則的なリスクマネジメントプロセスを常に要求するものではなく、状況に応じ、より簡易なリスクマネジメントプロセスを用いることも許容される9)。
また、元素不純物ガイドライン(ICH Q3D)は、逐次見直しを行いながら改正が行われている。薬生薬審発0626第1号、令和02年06月26日付け「医薬品の元素不純物ガイドラインの改正について」では、日米EU 医薬品規制調和国際会議 (以下、「ICH」という。)において、カドミウムの許容一日曝露量(PDE値:Permitted Daily Exposure ; 以下「PDE」という。)が、カドミウムの吸入暴露時PDE値算出方法の見直しに伴う数値等の修正、安全性基準の根拠となった毒性に関する知見の追加が合意され、改正が行われた。
また、直近でも薬生薬審発0120第1号、令和05年01月20日付け「医薬品の元素不純物ガイドラインの改正について」では、ICHにおいて、金、銀及びニッケルのPDEの修正、金及び銀のモノグラフの修正、並びに皮膚及び経皮曝露の元素不純物の限度値等についての合意が行われ、ガイドラインが改正されている。
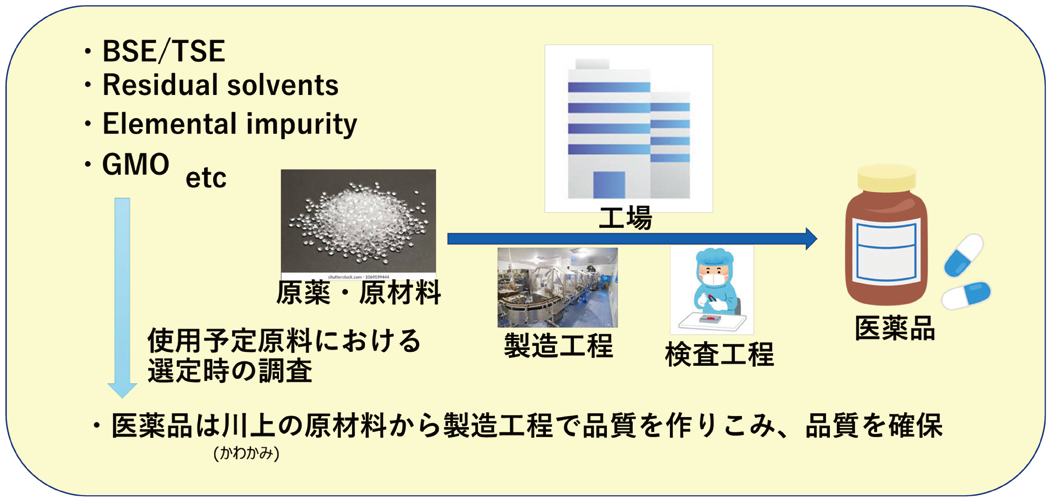
医薬品は川上(かわかみ)の原材料から製造工程を通じ品質を作りこみ、品質を確保すること(Fig.3)が基本であり、初期選定段階から添加剤・原薬・容器施栓系の各原材料の元素不純物評価を行い、製造設備、水などのユーティリティーでの混入を抑えることが大切である。
アセスメントの実施、元素不純物に関する取り扱いについては、日局一般試験法「2.66 元素不純物試験法」のほか、事務連絡、令和2年12月28日付け「医療用医薬品に係る元素不純物の取扱いに関する質疑応答集について(Q&A)について」、事務連絡、令和3年01月13日付け「「医療用医薬品に係る元素不純物の取扱いに関する質疑応答集(Q&A)について」の訂正について」、事務連絡、令和4年12月12日付け「要指導・一般用医薬品に係る元素不純物の取扱いに関する質疑応答集(Q&A)について」が発出されているので、元素不純物の取扱いの参考にしてもらいたい。
5. 第十九改正日本薬局方にむけて
令和3年6月7日厚生労働省告示第220号により第十八改正日本薬局方が告示されたところであるが、一方で既に次回の大改正である、第十九改正日本薬局方の作成にあたり審議を進めていく上での基本方針を策定すべく、薬事・食品衛生審議会薬事分科会日本薬局方部会にて審議が行われ、令和3年10月25日には厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡で「第十九改正日本薬局方作成基本方針について」が通知されている。
「第十九改正日本薬局方作成基本方針」10)においても、「5本の柱」が掲げられている。
特に医薬品のグローバル化に伴い、収載方針からも日本薬局方のさらなる一層の国際化を推進するものなど、積極的な収載が想定される。第十九改正日本薬局方にむけて、パブリックコメントの実施などその動向については注視していく必要がある。
<第十九改正日本薬局方作成の5本の柱>
(1) 保健医療上重要な医薬品を優先して収載することによる収載品目の充実
(2) 最新の学問・技術の積極的導入による質的向上
(3) 医薬品のグローバル化に対応した国際化の一層の推進
(4) 必要に応じた速やかな部分改正及び行政によるその円滑な運用
(5) 日本薬局方改正過程における透明性の確保及び日本薬局方の国内外への普及
6. おわりに
本稿では「日本薬局方の一部を改正する件」(令和4年厚生労働省告示第355号)が令和4年12月12日に告示されたことから、改めて日本薬局方の役割と改正内容について、紹介してきた。日本薬局方の改正にはPDGの動向が関与しており、厚生労働省からの局方関連通知や医薬品医療機器総合機構からのパブリックコメントなど最新情報の入手を行いながら、今後の日本薬局方の動向を注視していく必要がある。
引用文献
- 第十八改正日本薬局方作成基本方針
https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/jp18kihonsousin.pdf - 厚生労働省 日本薬局方ホームページ
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000066530.html - 独立行政法人医薬品医療機器総合機構 日本薬局方ホームページ 日本薬局方の歴史
https://www.pmda.go.jp/files/000249603.pdf - 日本薬局方の改正スケジュール(独立行政法人医薬品医療機器総合機構ホームページ)
https://www.pmda.go.jp/rs-std-jp/standards-development/jp/0003.html
https://www.pmda.go.jp/files/000246735.pdf (2023.03.24付け公開資料より引用) - 第十八改正日本薬局方第一追補(令和4年12月12日厚生労働省告示第355号)の概要_独立行政法人医薬品医療機器総合機構 審査マネジメント部
https://www.pmda.go.jp/files/000249336.pdf - 第十八改正日本薬局方第一追補(令和4年12月12日厚生労働省告示第355号)
- 元素不純物管理の経過措置期間終了後の医薬品各条からの重金属試験及びヒ素等の個別金属不純物試験の削除について (令和3年12月_独立行政法人 医薬品医療機器総合機構審査マネジメント部)
https://www.pmda.go.jp/files/000243606.pdf - 事務連絡 令和2年12月28日医療用医薬品に係る元素不純物の取扱いに関する質疑応答集について(Q&A)について
https://www.jfrl.or.jp/storage/file/gensofujunbutuqa.pdf - 第十八改正日本薬局方 一般試験法「2.66 元素不純物試験法」
https://www.pmda.go.jp/files/000241439.pdf - 第十九改正日本薬局方作成基本方針
https://www.pmda.go.jp/files/000243384.pdf
用語解説;
PDG(Pharmacopoeial Discussion Group):
日米欧三薬局方検討会議
PDE(Permitted Daily Exposure):
許容一日曝露量
ICH(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use):
医薬品規制調和国際会議




