【連載】有機分子触媒の軌跡 −基礎から応用まで− 最終回 (第4回) 「有機触媒による複雑化合物の合成」
本記事は、和光純薬時報 Vol.91 No.2(2023年4月号)において、サイエンスライター 佐藤 健太郎様に執筆いただいたものです。
前回までに、有機触媒の開発とその進展について述べてきた。最終回となる今回は、有機触媒を活用した複雑な化合物の合成例と、その特色について述べてゆきたい。
天然物全合成への応用
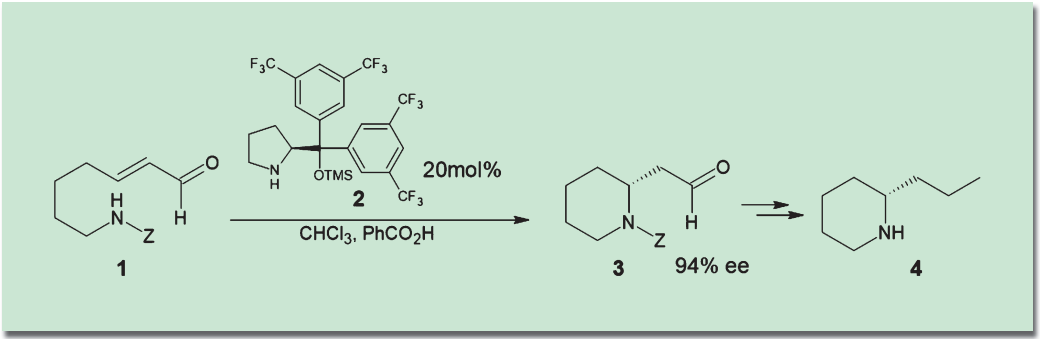
有機触媒の応用は広い範囲に及んでおり、天然物の全合成にも数多く用いられている。中でも二級アミン型の触媒(MacMillan触媒、林-Jørgensen触媒など)を利用した全合成は多い。比較的シンプルな例として、林-Jørgensen触媒(2)を用いた分子内Michael付加反応で不斉点を形成する、(+)-コニイン(4)の短工程合成が報告されている1)。
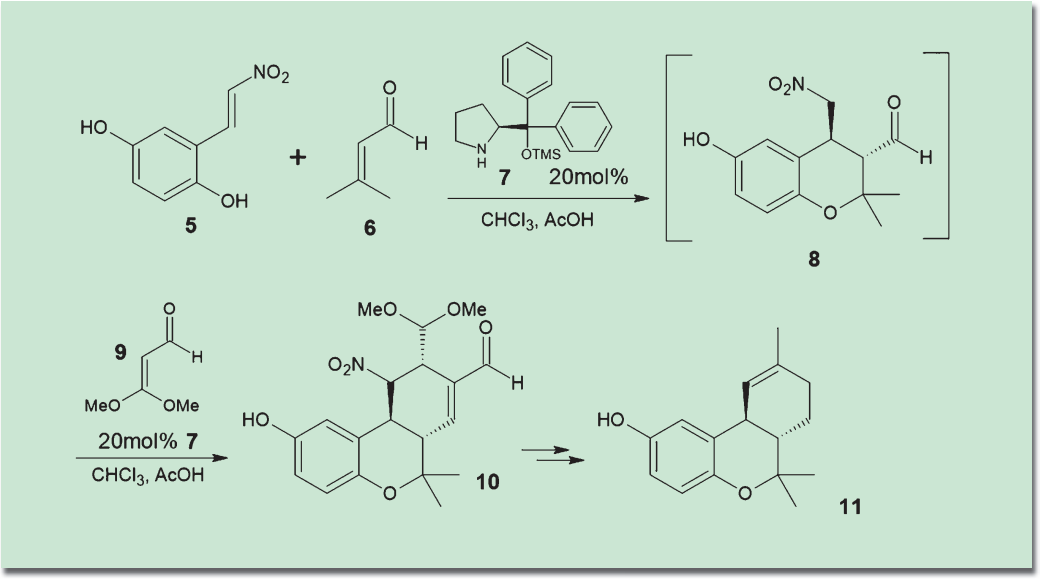
有機触媒の特性を生かした天然物全合成の例としては、Hongらによる(+)-コニコール(11)の合成が挙げられる2)。林-Jørgensen触媒(7)の存在下で、(5)とα,β-不飽和アルデヒド(6)を付加させて中間体(8)とし、ここに次のα,β-不飽和アルデヒド(9)を追加して連続的に環化を行うことで、一挙に3環性骨格(10)を構築した。後は官能基を整えることで、効率的にコニコール(11)を得ている。こうした連続的な基質の追加によるドミノ反応は有機触媒の得意とするところであり、そのポテンシャルをフルに活用した合成ルートといえる。
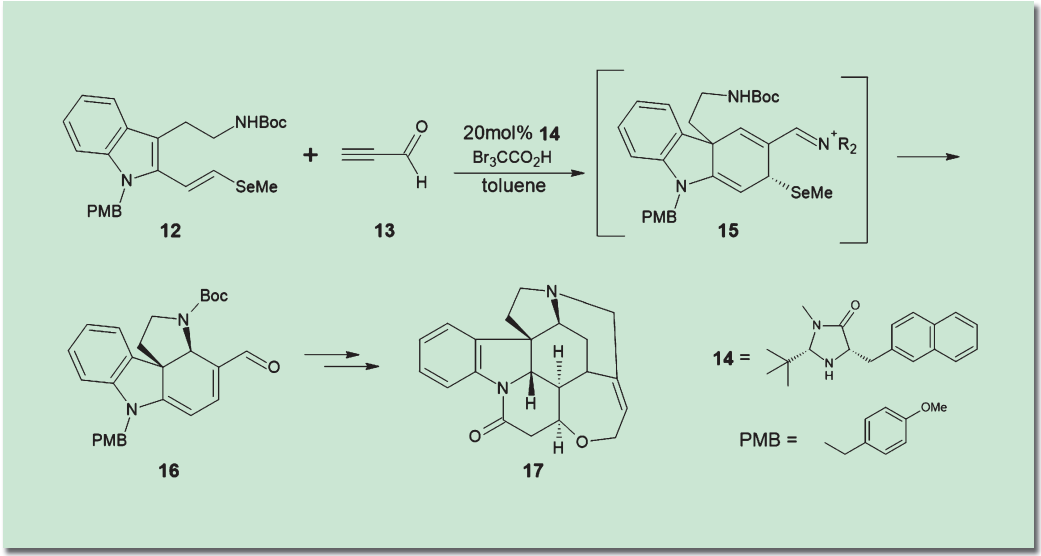
2021年のノーベル化学賞授賞にあたり、ノーベル賞委員会は有機触媒の有用性の例として、2011年に発表されたストリキニーネ(17)の全合成を挙げた3)。ここには具体的な論文の引用はなされていないが、おそらくMacMillanらによる研究を指していると思われる4)。この論文では、インドール誘導体(12)への2-プロピナール(13)の付加をMacMillan触媒(14)の存在下に行うことにより、高い不斉収率でストリキニーネの鍵中間体(16)の合成に成功している。本論文では、この中間体からストリキニーネのみならず、アスピドスペルミン、アクアミシンなど計6種の複雑なアルカロイドを作り上げるという離れ業が演じられている。
ノーベル賞委員会によるプレスリリースでは、1952年に達成されたWoodwardらによるストリキニーネの全合成では29段階を要していたものが、上記の例ではわずか12段階で達成され、収率が7,000倍も向上したと述べられている。もちろんこれは素晴らしい成果ではあるが、こうした効率化は有機触媒のみの手柄ではなく、有機合成全体の進歩に負うところも大きい。
医薬品合成への応用
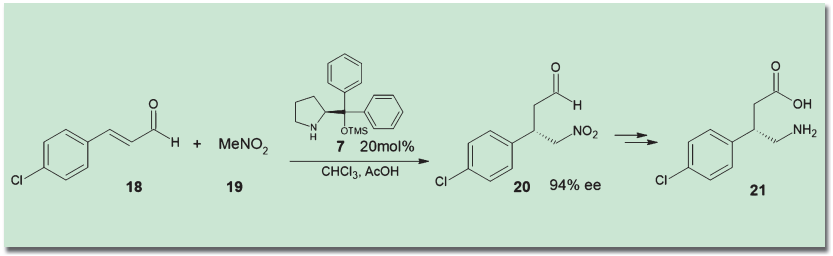
医薬品の合成にも、有機触媒を適用する試みが行われている。例えば林雄二郎らは、自ら開発した林-Jørgensen触媒を用いた、筋弛緩剤バクロフェン(21)の不斉合成を報告している5)。鍵段階となっているのは、α,β-不飽和アルデヒド(18)に対する、ニトロメタン(19)の不斉Michael付加反応だ。
一方、竹本らは同じバクロフェンの合成を、チオウレア型不斉触媒を用いることで達成している6)。こちらは、ニトロオレフィンに対してマロン酸ジエチルを求核付加させるアプローチが採られている。チオウレアの持つ2つのNH水素が、マロン酸ジエチルの2つのカルボニル酸素に水素結合することによって、活性化が行われている。またAdamoらも、シンコナアルカロイド由来の不斉相間移動触媒を用いて、バクロフェンの合成を達成している7)。一口に有機触媒といってもアプローチは様々であり、この世界の豊かさを感じさせられる一例だ。
こうした有機触媒の可能性に、製薬企業も注目している。たとえば高血圧治療薬アリスキレン(22)は、直鎖上に4つの不斉中心を含んだ複雑な構造を持つ。その不斉点構築に、林-Jørgensen触媒を用いた不斉Michael付加が用いられている8)。
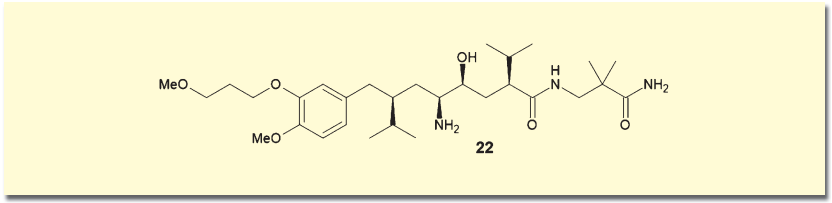
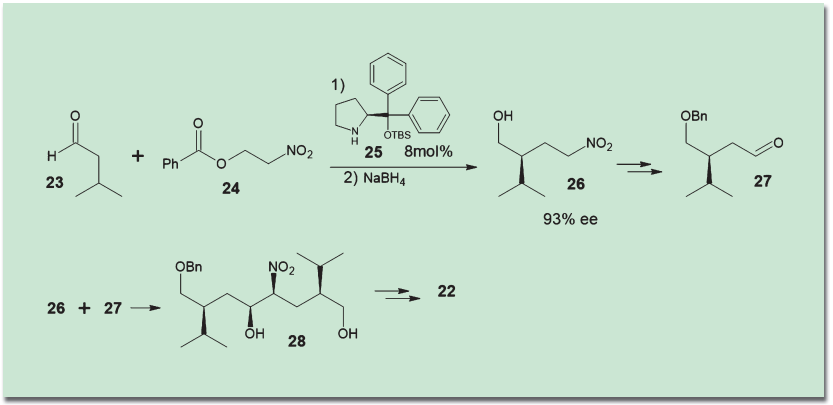
アリスキレンはペプチドホルモンであるレニンの拮抗剤であり、ペプチドを模倣した骨格を持つ。中心部分は、アミノ基とヒドロキシ基の違いを除けば対称形であり、この点が巧妙に利用されている。イソバレルアルデヒド(23)とニトロエテン前駆体(24)を、林-Jørgensen触媒(25)存在化に反応させて、付加体(26)を得る。その一部をNef反応によってアルデヒド(27)に変換し、これを(26)とニトロアルドール反応させることで、一挙に4つの不斉中心を持つ鍵中間体(28)を構築するという手法だ。ノバルティス社はこの合成ルートの特許を取得している。
医薬品は人体に入って作用を示すものであるため、不純物の残存は大きな問題となる。特に、合成過程で用いられるパラジウムや銅などの重金属については、残存量に厳しい規制が設けられているが、完全な除去は多くの場合難しい。また貴金属触媒の使用は製造コスト高騰の要因となり、長期的には供給の不安もある。有機触媒はこうした問題を回避しうるため、医薬品合成こそは有機触媒の特長を最大限に活かせる場であるといえる。今後も、医薬品合成における有機触媒の使用例は増えていくことが予想される。
タミフル合成
インフルエンザ治療薬リン酸オセルタミビル(商品名タミフル)は、6員環骨格上に連続した3つの不斉中心を持っており、分子量のわりに合成の難度は高い。
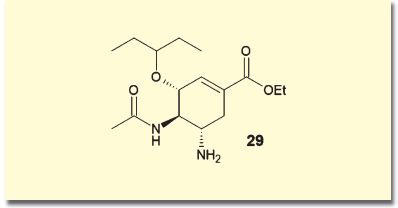
製造元のギリアド・サイエンシズ社では、やはり6員環骨格に3つの不斉点を持つ天然物である、シキミ酸からオセルタミビル(29)を合成するルートを確立している。しかし一時期、このシキミ酸の供給が危ぶまれ、製造が滞りそうになったことがあった。こうしたことから、多くの研究者によってオセルタミビルの合成ルートが研究されている。
林・石川らは、有機触媒をフルに活用したオセルタミビルの合成研究を進め、大きな成果を挙げている。まず、アルデヒド(30)とニトロオレフィン(31)の不斉付加反応と、それに続くドミノMichael反応、Horner-Wadsworth-Emmons反応により、一挙にタミフルの6員環骨格を構築するルートが発表された9)。ワンポット反応3回、総収率57%と、この段階ですでに驚異的な全合成といってよいものであった。
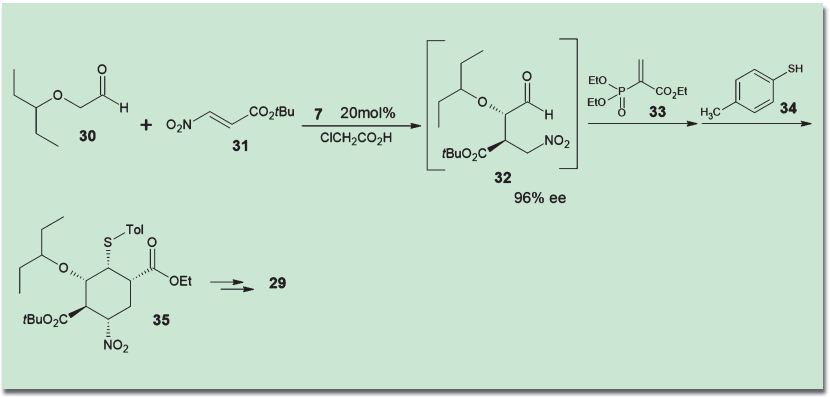
しかし林らはこの合成ルートをさらに磨き上げ、2010年には2ポット、2013年にはついに全ての工程をワンポットで行うことに成功した10)。途中での溶媒交換もなく、順次試薬を追加していくだけで、グラムスケールでオセルタミビルが合成されている。
反応後の後処理や、シリカゲルカラムによる精製といった操作は、時間やコスト、環境負荷が大きい。特に大スケールでの合成ではその影響は顕著であり、製薬企業のプロセスでは、たとえば溶媒留去の工程を一度省くだけでも大きなコストダウンとなる。この点、他の反応を妨害することが少なく、除去も比較的容易という、有機触媒の真価が発揮されたといえるだろう。
このオセルタミビル合成の研究を通して、林らは「ポットエコノミー」という考え方を提唱するに至った11)。同じ反応容器で複数の反応を進行させる「ワンポット合成」を効率よく用い、なるべく少ない反応容器で目的化合物を組み上げることを目指す考え方だ。これによって、合成にかかる時間を大幅に短縮し、廃棄物の生成を最小限に抑えることができる。
この考えに基づき、林らは2022年にはキニーネの5ポット合成を達成している12)。5ポットのうち、3ポットでは一気に5段階の反応工程を行うなど、極度の効率化が図られた。現代有機合成化学の、一つの到達点といってよいだろう。
4回にわたり、有機触媒分野の発展について記してきた。その歴史をたどって改めて感じるのは、コンセプトを確立し、適切でわかりやすい名称をつけることの重要さだ。この分野が注目されるきっかけが、プロリン触媒とMacMillan触媒であったことは間違いないが、それ以前にも有機分子のみで働く触媒はいくつも存在していた。やはり「有機触媒」(organocatalyst)という、わかりやすく切れ味のよい言葉を定めたことが、普及の大きなきっかけになったことは間違いない。その後の多様な触媒の開発、光レドックス触媒への展開、天然物・医薬品合成への応用といった大きな波及効果は、「有機触媒」という言葉なくしてありえなかったことと思う。これは2022年ノーベル化学賞の対象となったクリックケミストリーや、近年注目を集める分子編集についてもいえることだろう。
ノーベル賞の授与後にも、有機触媒分野の新たな研究は絶え間なく続いている。この枠をさらに飛び越えていくような、新しい触媒、新しい概念の登場を期待したい。
参考文献
- Fustero, S. et al. : Org. Lett., 9, 5283 (2007).
- Hong, B-C. al. : Org. Lett. , 12, 776 (2010).
- https://www.nobelprize.org/uploads/2021/10/popular-chemistryprize2021.pdf (2023年2月10日閲覧)
- Jones, S. B. et al. : Nature, 475, 183 (2011).
- Goto, H. et al. : Org. Lett., 9, 5307 (2007).
- Okino, T. et al. : J. Am. Chem. Soc., 127, 129 (2005).
- Baschieri, A. et al. : Angew. Chem. Int. Ed., 48, 9342 (2009).
- Sedelmeier, G. et al. : WO2008119804A1
- Ishikawa, H. et al. : Angew. Chem. Int. Ed., 48, 1304 (2009).
- Mukaiyama, T. et al. : Chem. Eur. J., 19, 17789 (2013).
- Hayashi, Y. et al. : Chem. Sci., 7, 866 (2016).
- Terunuma, T. and Hayashi, Y. : Nature Commun., 13, 7503 (2022).




