【テクニカルレポート】パラダイムシフトとしてのスフェロイド・オルガノイド共培養
本記事は、和光純薬時報 Vol.91 No.2(2023年4月号)において、株式会社ギンレイラボ 島崎 猛夫様に執筆いただいたものです。
はじめに
細胞培養方法としては、シャーレの上で細胞を培養して同一種の細胞を集団で解析する単層静置培養法、培養液を撹拌することで浮遊状態を保ったまま細胞を培養する浮遊培養法、ゲル状基質を用いて培養する方法など種々の方法があります。これらの技術は古くから存在しています。1962年には、Boydenらが細胞遊走アッセイ法を開発1)し、後にセルカルチャーインサートと一般呼称される培養液を介した非接触共培養に利用されるようになりました。1971年には、細胞集団を立体的に培養するスフェロイド2)という言葉も登場しています。
スフェロイドとは、細胞が相互接着による単純なクラスター(集合体)を形成し3次元状に構築されている状態を指します。「球(sphere)+oid」が示すように、球体様のものです。細胞は通常足場(スキャフォールド)を介して容器に接着しますが、足場がない、あるいは弱い場合は、互いに接着するだけで3次元立体構造を形成します。スフェロイド作製には、この特徴を利用して足場を作らせない方法が利用されています。例えば、非接着性容器を用いて作製する方法、工学系の微細加工技術による構造体を利用する方法、培養器を回転させながら培養する回転培養法、液滴の中に立体的構築するハンギングドロップ法などがあります3)。
共培養やスフェロイド培養が行われる理由は、細胞と細胞が直接あるいは間接にコミュニケーション(相互作用)できるようにすると、細胞単体では認めない機能を発揮することが明らかになっているからです。
スフェロイドや後述するオルガノイドは、それぞれ同様の意味で使われていることも多いのですが、スフェロイドは機能性の面においてオルガノイドほど発達しているとはいえず、厳密には明確な違いがあります。
オルガノイドとは、「臓器(organ)+oid」であり、臓器のようなものという意味です。一般的には、幹細胞を3次元で培養して得られる組織とされています。最近では、幹細胞から分化させた異なる種類の分化した細胞や、元から分化している細胞を混ぜ合わせて立体的に作られた細胞群もオルガノイドと呼ばれています。よって元の細胞がすべて幹細胞であるかを問わず、一般的な意味として、「細胞技術を用いて人為的に創出し、器官に類似させた組織体」と表現する方がより適切です。生物学的には、「幹細胞もしくは器官形成に寄与する前駆細胞等から、発生学における生物学的プロセスを薬剤や環境を構築する等の手段を用いて人為的に模倣することで、自律性を持って形成された器官様の集合体がオルガノイドである」と言えます。これまでの研究により、オルガノイドは、ヒト臓器の構造や生理機能を詳細に再現可能であるとされており、病態解明や薬剤開発などに利用されるようになってきました。臨床試験期間の短縮や動物実験の代替の流れから、オルガノイド研究が進んできています。生物学的研究をベースに、Organ-on-a-chipと呼ばれるような工学系技術を組み合わせて培養・解析する研究が進んでおり、総称として生体模倣システム(microphysiological systems :MPS)と呼ばれるようになっています。米国環境省からは、動物実験は2025年に30%削減し、2035年に全廃というロードマップが提示され、2023年1月6日に米国FDAから、臨床試験前に動物実験は必須とせず、細胞技術を使った実験結果を採用することを可能にする法案が成立しました4)。この法案は予定通りとはいえ、驚きをもって受け止められています。ある意味、「動物実験=ガソリン車」であり、「細胞技術・オルガノイド=電気自動車」のような関係になったことを意味しています。つまり、今後は、細胞技術を使った創薬研究が主体となり、スフェロイド・Organ-on-a-chip・MPS技術が、パラダイムシフトのキーテクノロジーとなることを意味しています。
我々は、水平方向共培養容器であるUniWells5)をOrgan-on-a-chip/MPSシステムへ進化させるために開発を行っています。その前段階となる技術の紹介として、水平方向接続のメリットとそのメリットを活かしたスフェロイドやオルガノイドの共培養について御紹介します。
1) UniWellsの水平方向接続のメリット
共培養容器として一般的に利用されているセルカルチャーインサートは、もともと、細胞の移動能や浸潤能を測定するためにBoydenらが開発し、Boyden chamber1)と呼ばれたものです。バケツの上にバケツを重ねたような構造で、上側の容器底面はフィルターです。下側の容器の培養液に細胞誘因物質を入れておき、フィルターの上で培養した細胞がフィルターの孔を通り抜けて下面に移動してきた細胞をカウントすることで浸潤度を測定していました。この容器がそのまま細胞の共培養に使用できるため、以後長く使用されています。
Boyden chamberは、細胞の浸潤や移動能を測定するために開発されているので、播種する細胞数は少数でした。細胞数が少なければ、細胞が載っていない部分のフィルターの孔は塞がらないので、培養液は上下で共有されます。ところが、細胞数が多くなると細胞がフィルターの孔を塞ぎ、培養液の共有は低下あるいは停止します5)。この事実は、考えれば当たり前ですが注目されておらず、セルカルチャーインサートは共培養の標準的な培養容器とされています。細胞数が少なければ、共培養されないといったことはありませんが、上側の容器の細胞は直接観察できませんので、気が付いたらコンフルエント(細胞占有面積率が高い状態)になっていたということがあります。その場合、共培養されていないことに気が付かないまま結果を解釈してしまうことになります。実際、電子顕微鏡写真で解析した結果をみれば当たり前が再確認できます(図1)。
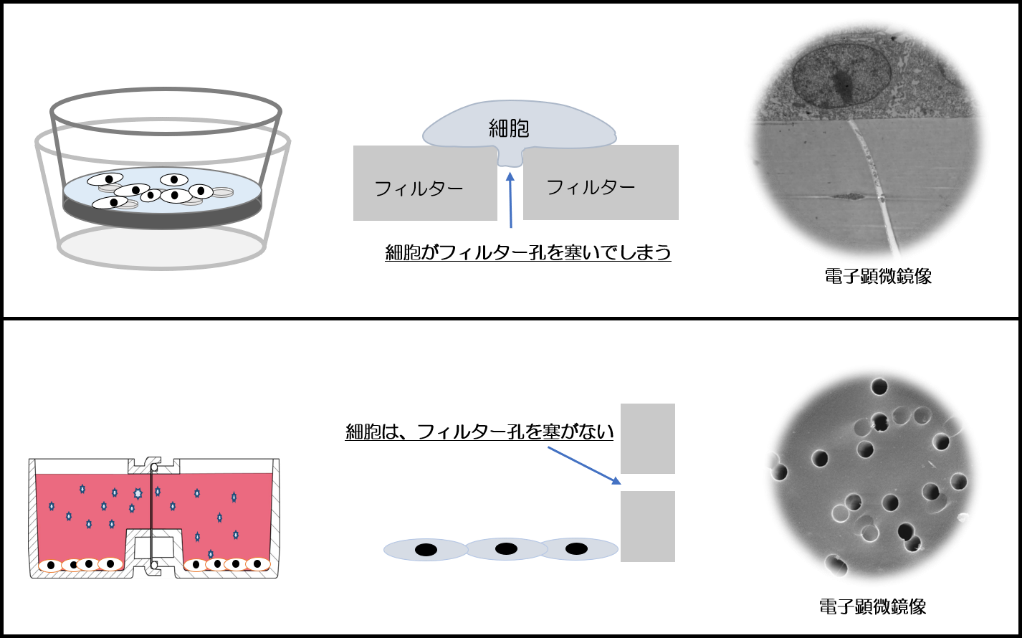
UniWellsは、細胞とフィルターの位置関係が離れていますので、細胞が多くなってもフィルターの孔を塞ぐことはありません。
2) 3次元共培養について
MPSの目標は人体を模倣することです。人体の各臓器は離れた位置にあり、直接接触せずに血液や組織液を介して情報や物質を双方向に交換、あるいは一方向性に作用しています。これらを模倣するためには、ミニ臓器同士が直接接触せずに物質を交換・影響できる仕組み、共培養や一方向性に作用する仕組みなどが必要です。さらには、実験系であることから実験誤差の評価が必要です。つまり、重要技術として、オルガノイド同士の共培養・一方向性培養、複数のオルガノイドの同時評価技術を組み込む必要があります。
MPSのうち、微小流路技術を利用したシステムが多く開発されていますが、UniWellsTMで採用しているフィルターは、流路長が非常に短い微小流路の集合体といえます。そして、前述のフィルターとの位置関係から、流路を塞がずに細胞やスフェロイド・オルガノイドを培養できるメリットがあります。我々は、UniWellsTMの次の発展形として、スフェロイド・オルガノイド共培養・MPS化に取り組んでいます。第一弾として、2023年度にUniWellsTMに装着できるPDMS製アダプタのUniWells-Cups(仮称)を発売します。微細加工技術とPDMS製造技術を利用して住友理工株式会社と共同開発したUniWellsTMのオプション製品です。複数のスフェロイドやオルガノイドをUniWellsTMで共培養でき、さらには各種組織学的評価も可能です。スフェロイドやオルガノイドには、ばらつきがあることが知られています。このシステムでは、同時に複数のスフェロイドやオルガノイドに対して共培養を行うので、同じ実験条件・同じ染色条件で同時に評価するスフェロイドアレイが可能です(図2)。
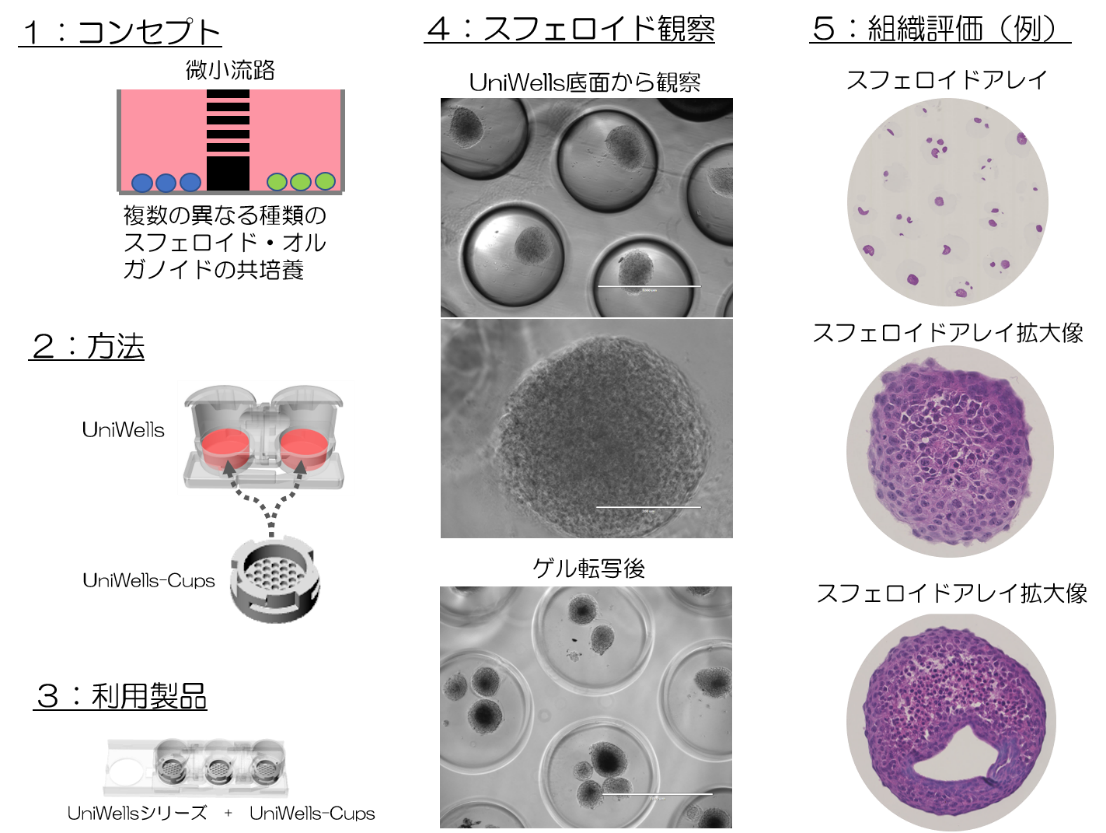
今後第二弾として、さらに発展したMPSオプションも発売予定です。
参考文献
- Boyden, S. et al. : J. Exp. Med., 115 (3), 453 (1962).
- Sutherland, R.M. et al. : J. Natl. Cancer. Inst., 46, 113 (1971).
- Jubelin, C. et al. : Cell. Biosci., 12, 155 (2022).
- The FDA Modernization Act 2.0. Available onlineより
(https://www.congress.gov/bill/117th-congress/senate-bill/5002 (2023年1月29日閲覧)). - Shimasaki, T. et al. : Micromachines (Basel), 12 (11), 1431 (2021).




