【テクニカルレポート】バイオ医薬品からの宿主細胞由来残留DNA 検出試薬の開発
本記事は、和光純薬時報 Vol.90 No.4(2022年10月号)において、弊社 生産プロセス開発部 山本 陽太郎にて執筆したものです。
はじめに
1982年に世界初のバイオ医薬品である糖尿病治療薬「ヒトインスリン」が開発されて以来、バイオ医薬品は増え続けており、2018年までの集計において316のバイオ医薬品が市場にある1)。今後も、治療薬としてバイオ医薬品の数は増加していくと考えられている。
Walshなどのまとめによれば、承認されている医薬品の中でも宿主として用いられているのはCHOや大腸菌で約70%弱を占めている1)。上記のようにバイオ医薬品の社会実装が一層進む中で、組換えタンパク質及び抗体医薬品の品質管理についてはレギュレーションが定まっている。本稿では我々が開発した宿主細胞由来残留DNAの検出試薬について紹介する。
QCdetectTM残留DNA検出キット
バイオ医薬品の安全性と品質を確保するためには、製造工程における汚染物質や不純物の検査において、迅速かつ正確なスクリーニング方法が必要である。製造宿主由来の残留DNAは発がん性や不必要な免疫の惹起を誘導するため、世界保健機関(WHO)、米国食品医薬品局(FDA)などの規制当局は、非経口投与薬におけるDNA混入量は、1 doseあたり10ngを超えないことを推奨している。さらに、FDAは、残留DNAのために使用される検出法が、1 dose用量あたり少なくとも10pgの感度を有していることを推奨している2, 3, 4)。
本品では、規制当局の要求事項を満たすために、二重標識プローブを用いたQuantitative PCR(qPCR) を採用し、qPCRの成否を確認するためのInternal control(IC)assayを内包させた。さらに、実験者のハンドリングを極限まで減らすことを考慮し、調液不要のMaster mixとして提供できるように開発した。
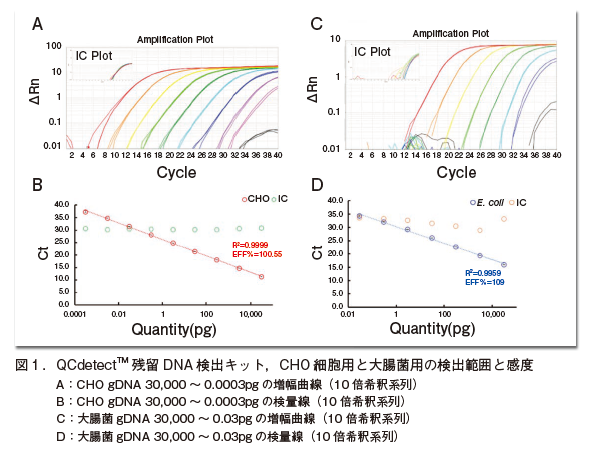
qPCRにおいて最も重要であるプライマー・プローブが標的とする配列は複数コピー存在し、特異性がある目的領域に設計することにより、感度と特異性を保証している。CHO細胞用の性能は図1AとB、大腸菌用は図1CとDに示した。CHOは0.3fg、E. coli は30fg検出できるため、10pgより低い量を検出できることから、高感度かつ検出範囲が広い試験が可能であることを示した。
QCdetectTM残留DNA検出キットの堅牢性
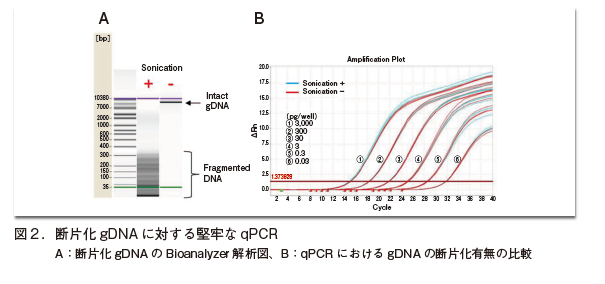
実際に検出される宿主由来残留DNAは培養中、精製中の工程において断片化されていることが想定される。本品ではgenome DNA(gDNA)を超音波破砕処理し、約300bp以下の断片に調製した溶液と処理していないgDNA溶液を比較した結果を図2に示している。超音波破砕したgDNA溶液はBioanalyzerに供してフラグメントの分布を確認した結果を図2Aに示している。
図2Aは超音波処理されたDNAが約300bp以下に断片化されていることを示している。断片化溶液と非断片化溶液を比較したqPCRの結果が図2Bであり、Ct(Threshold Cycle)に差異が無いことを確認している。つまり、本品では断片化されたgDNAに対しても検出感度、精度を低下せずに定量及び検出が可能であることを示している。
DNAエキストラクター® キットとの適合性
DNAエキストラクター® キットは高濃度タンパク質溶液、幅広いpH条件下、主要な緩衝液、添加剤共存下から高い効率でDNAを回収することができる抽出精製キットである5, 6, 7)。
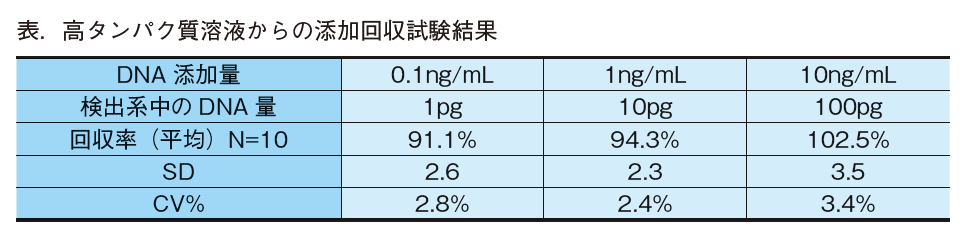
抗体溶液を想定した組成(20mg/mL human IgG溶液)にgDNAを添加し、DNAエキストラクター® キットを用いて精製し、本品で定量する添加回収試験を行った。その試験データを表に示している。低DNA量において90%以上の回収率を得ることができ、数pg DNA量においても安定した検出が実行できることを示している。
おわりに
冒頭で述べたように、バイオ医薬品の需要と期待は今後も増加し続けていくと思われる。我々はより簡便、高感度、堅牢性のあるシステムを提供することで、生命科学研究とバイオ産業の発展に貢献する。
参考文献
- Walsh, G. : Nat. Biotechnol ., 36 (12), 1136(2018).
- WHO Study Group on Biologicals & WorldHealth Organization : "Acceptability of cellsubstrates for production of biologicals :report of a WHO study group [meeting heldin Geneva from 18 to 19 November 1986]",World Health Organization( 1987).
- U.S. Food and Drug Administration Centerfor Biologics Evaluation and Research. : J.Immunother ., 20( 3), 214( 1997).
- Knezevic, I., Stacey, G., Petricciani, J., onbehalf of the WHO Study Group on cellsubstrates : Biologicals , 36( 3), 203( 2008).
- Cai, H., Gu, X., Scanlan, M. S. and Lively, C. R. :J. Pharm. Biomed. Anal ., 55( 1), 71( 2011).
- Ishizawa, M., Kobayashi, Y., Miyamura, T.and Matsuura, S. : Nucleic Acids Res ., 19(20), 5792( 1991).
- Charlebois, R. L., Sathiamoorthy, S., Logvinoff, C.,Gisonni-Lex, L., Mallet, L. and Ng, S. H. S. :NPJ Vaccines , 5( 1), 61( 2020).




