【連載】有機分子触媒の軌跡 ―基礎から応用まで―「第1 回 有機触媒の発見」
本記事は、和光純薬時報 Vol.90 No.3(2022年7月号)において、サイエンスライター 佐藤 健太郎様に執筆いただいたものです。
有機触媒とは何か
2021年のノーベル化学賞は、「不斉有機触媒の開発」をたたえて、BenjaminList及びDavid MacMillanの両博士に贈られた。有機合成反応の開発に対する授賞は、2010年のクロスカップリング反応の開発(R. Heck、根岸英一、鈴木章の三氏が受賞)以来久々のことであった。
2000年前後に勃興したこの分野は、世界中で一大ブームとなり、日本人研究者もその発展に大きな貢献をした。それだけに受賞者の絞り込みは難しかったものと想像されるが、立役者である二人が受賞することとなった。しかし筆者がSNSなどでの反応を見る限り、有機合成の専門家以外には、有機触媒の定義やその価値がなかなかわかりづらいものであったようだ。そこで本連載では4回に分けて、この有機触媒の世界についてご紹介をしてゆきたい。
有機触媒(「有機分子触媒」とも表記される)とは、金属元素を含まず、炭素・水素・酸素・窒素・イオウ・リンなどの元素で構成された、有機反応の触媒として働く低分子量化合物を指す。ただし、p -トルエンスルホン酸や4-ジメチルアミノピリジン(DMAP)のような、古くから用いられてきた比較的単純な触媒は、通常は有機触媒の範疇に含めない。近年の有機触媒研究の文脈では、精巧な分子設計のもと、エナンチオ選択的反応、位置選択的反応といった、高度な反応制御を行う触媒を指す。
酵素と金属触媒
有機触媒の登場を、歴史を追って眺めてみよう。有機化学において、高度な反応制御を行える触媒は、常に重要な地位を占めてきた。歴史的には、こうした触媒にはまず酵素があった。人類は酒造や発酵食品の製造といった形で、古くから酵素の力を利用してきたし、有機合成においてもその力は応用されてきた。リパーゼによる不斉加水分解反応、イーストを用いたケトンの不斉還元反応などがその典型だ。
こうした酵素の行う反応には、たとえばアルキル鎖の位置選択的酸化反応のように、人工的な触媒ではなかなか実現できないものも多い。ただし、酵素は一般に基質特異性が高く、広い範囲の化合物に適用できるものは少ない。また、望みの反応性を持った酵素を人工的に作り出すことも難しい。このため現代の有機合成において酵素反応が用いられる機会は、決して多くはない。
次いで、金属触媒が登場した。遷移金属元素の特異な反応性を、人工的にデザインされた配位子で制御するもので、有機合成分野に大きな進展をもたらした。様々な不斉配位子が考案され、幅広い反応が高立体選択的に行えるようになった。かつては考えられなかったような複雑な天然物や医薬化合物が、短工程で簡便に、あるいは大規模に合成できるようになったのには、これら金属触媒研究の進展が大きく寄与したといえる。ただしこれら金属触媒は、パラジウムやルテニウム、白金などといった、希少な金属元素を使用するものが多い。これらの多くは高価である上、国際情勢の変化や資源の枯渇などで供給 が途絶するリスクをはらむ。また、触媒が生成物に微量でも残存すると、品質に影響を与える可能性がある。特に医薬品では、重金属が含まれていると健康被害に直結するため、残存量は厳しく規制されている。当然ながら、その除去には相当のコストを必要とする。
また金属触媒は反応性が高く、失活しやすいものが多い。この場合、実験器具や溶媒から厳密に水分や酸素を除去する必要があり、高度な実験設備や手技が必要になる。特に工業的な規模で合成を行う場合には火災や爆発などの危険さえ伴うため、大きな障害となる。
有機触媒前史
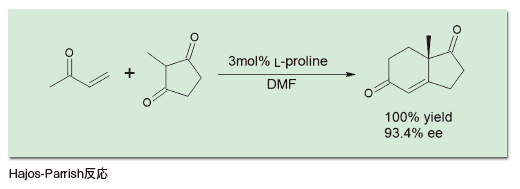
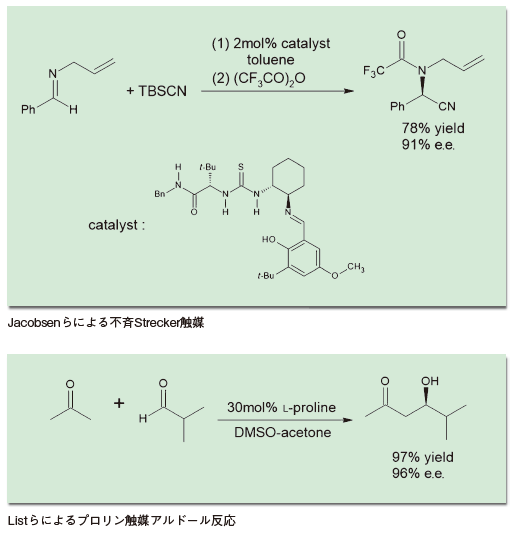
前述のように、有機触媒という分野は2000年に誕生した。だがそれ以前にも、有機触媒の定義に当てはまる触媒はいくつも知られていた。有名なところでは、1971年に報告されたHajos-Parrish反応がある1)。環状の1,3-ジケトンと、α,β-不飽和ケトンを触媒量のプロリン存在下で反応させることで、高い不斉収率でロビンソン環化が進行し、二環性の生成物が得られるというものだ。この反応は、ステロイド骨格を持った医薬品の合成に応用された他、天然物合成に広く用いられた。有機触媒前夜といえる1990年代後半になると、いくつもこうした触媒が登場してきた。たとえば1998年にはE. Jacobsenらが、チオ尿素誘導体を用いて不斉Strecker反応を行えることを報告した2)。この反応は、当初は金属触媒の最適な配位子を探索する目的で研究が進められていた。しかしその過程で、実は金属は不要であり、配位子だけで触媒作用を示すことが明らかになったものだ。後の有機触媒の展開を考える時、これは示唆に富むエピソードといえる。
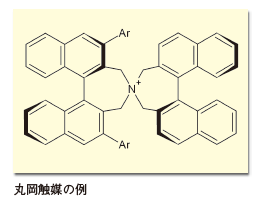
1999年には、京都大学の丸岡らによって、軸不斉ビナフチル骨格を持った不斉相間移動触媒が報告され、α-アミノ酸の不斉合成などに応用された3)。これ以前にもシンコナアルカロイドから誘導された、同様なコンセプトの不斉相間移動触媒は存在したが、丸岡らの触媒はより汎用性が高められている。
2つのブレイクスルー
こうした中、2000年に報告された2報の論文が大きな注目を浴びた。一報は、List、Lerner、Barbasらによるプロリンの触媒作用の報告だ4)。アセトンとアルデヒドを、触媒量(30mol%)のプロリンと撹拌するという極めて単純な操作で、高収率かつ高いエナンチオ選択性のもと、アルドール付加体が得られるというものだ。
不斉アルドール反応は、有機反応開発における王道ともいうべき分野で、それまで様々な技巧を凝らした手法が数多く発表されてきた。その不斉アルドール反応が、プロリンという何の細工もない単純なアミノ酸を混ぜるだけで高選択的に進行するというのだから、その驚きは大きかった。この論文のインパクトが、多くの研究者をこの分野に引きつけるきっかけになったのは確かだろう。
実のところこの反応は、先に紹介したHajos-Parrish反応を一般化したものに当たる。多くの教科書に載るほど有名であったHajos-Parrish反応が、実ははるかに広い適用範囲を持っていたこと、ノーベル賞を受賞するほど重要な概念に結びつく可能性があったことが、30年近く誰にも気づかれなかったことは興味深い。
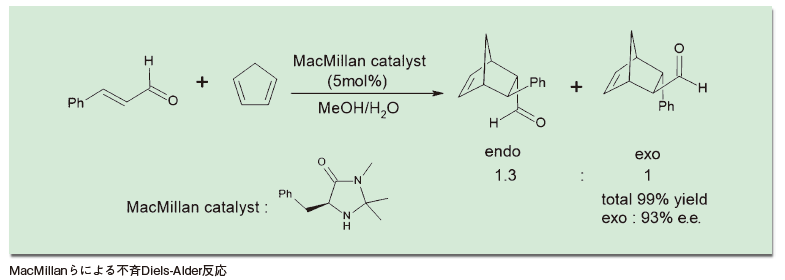
そしてもう一報は、MacMillanらによる不斉Diels-Alder反応の報告だ5)。もちろんこの反応も多くの研究例があり、たとえばルイス酸として働くアルミニウムやチタンなどに、不斉な配位子を結合させた触媒を用いるアプローチがなされてきた。
しかしMacMillanの方法は、比較的シンプルな環状二級アミンを触媒として用いるものであった。この触媒は、酸性条件下で不飽和アルデヒドと反応してイミニウム中間体を形成し、これがジエンと反応する形で進行する。しかもこの反応は、メタノール-水系溶媒中室温という温和な条件で進行し、高いエナンチオ選択性を示す。
この論文で、MacMillanは初めて「organocatalysis」という言葉を使用した。単に簡便な条件で進行する不斉反応の報告ではなく、「これは触媒の新分野を切り拓く発見だ」と宣言したわけだ。同時期に発表されたこの2報の論文は、世界的ブームの引き金となった。
こうして見てくると、有機触媒はある日突然出現したわけではないことがわかる。数十年にわたる多くの研究者による積み重ねがあり、機は熟していた。そして、金属触媒の化学の発展とその問題点が見えてきたこと、2つの重要な論文が登場したこと、「organocatalyst」というわかりやすい名称がつけられたことが重なり、一分野が形を成したといえるだろう。
有機触媒の意義
では、なぜそこまで有機触媒が注目を集めたのだろうか。前述の通り、一般に金属触媒には、高コスト、供給難、除去の難しさ、大きな環境負荷、取り扱いの難しさといった難点がある。有機触媒は、こうした問題を解消しうる潜在力を有する。また有機触媒の研究には、高度な実験技術や施設が不要であり、これが多くの研究者をこの分野に呼び込んだ要因となった。ここに中国など新興国の発展が重なったことで、爆発的な進展に結びついた。
もちろん工業的な応用を考える意味でも、有機触媒のメリットは大きい。何より有機触媒は、毒性がある重金属を使わず、溶媒の精製も多くの場合不要であることなどから、総じて環境負荷が小さい。これは現代の要請によくマッチする点であり、ノーベル賞に結びついた最も大きな要因であっただろう。
また、金属触媒は強力な配位結合で基質と結合するのに対し、有機触媒は水素結合などの比較的弱い結合で基質と結びつくことが多い。これは、反応の制御という面ではデメリットであり、このため有機触媒は反応時間が長く、比較的多量の触媒を必要とするケースも多い。
だが見方を変えれば、これはメリットにもなりうる。すなわち、有機触媒は系内に残存していても他の反応を妨害しにくい。このため、有機触媒を用いた反応の後、抽出や精製などをせず、続けて次の反応を行うようなことも可能になる。これを利用し、ワンポットでの複雑な化合物合成も達成された。また、金属触媒や光酸化還元触媒などと組み合わせて用いることで、新たな反応を編み出すような試みも盛んに行われている。
こうした有機触媒の様々な可能性について、次回以降で紹介してゆきたい。
参考文献
- Hajos, Z. G. et al . : J. Org. Chem ., 39, 1615(1974).
Eder, U. et al . : Angew. Chem. Int. Ed. Engl .,10, 496(1971). - Sigman, M. S. and Jacobsen, E. N. : J. Am.Chem. Soc ., 120, 4901(1998).
- Maruoka, K. et al . : Chem. Rev ., 103, 3013(2003).
- List, B. et al . : J. Am. Chem. Soc ., 122, 9336(2000).
- Ahrent, K. A. et al . : J. Am. Chem. Soc ., 122, 4243(2000).




