【総説】バッチならびにフロー式Fischer-Speierエステル化に適用可能な高分子酸触媒PAFR Ⅱ
本記事は、和光純薬時報 Vol.90 No.2(2022年4月号)において、理化学研究所 環境資源科学研究センター 山田 陽一様、分子科学研究所 間瀬 俊明様、魚住 泰広様に執筆いただいたものです。
はじめに
有機合成反応の原子効率(生成物/原料)の向上とE-factor(廃棄物/原料)の低減は、有機化学やグリーンケミストリーだけでなく、産業応用においても重要なファクターである。脱水反応は最も基本的な反応の一つであり、理想的な触媒を用いた脱水反応では水が唯一の副生成物となるため、生合成・化学合成のいずれにおいても頻繁に利用されている。具体的には、カルボン酸とアルコールを反応させてエステルを得るFischer-Speierエステル化反応1)が、油、香水、医薬品、化粧品、塗料、接着剤、樹脂、溶剤などの製造に工業規模で実施されている。
高活性で再利用可能な触媒を用い、脱水剤を使用せず、無溶媒の条件でエステル化ができれば、より安全で経済的な工業規模の合成経路を提供することができる。この反応は、カルボン酸とアルコールが反応することでエステルと水が生成する平衡反応である。高収率で生成物を得るためには平衡を傾けるための方法を考える必要がある。今までに様々なエステル化触媒が報告されているものの、触媒量や使用するアルコール量、反応温度、水除去などの点でまだ発展途上の段階にある2)。
私たちのグループは、Fischer-Speierエステル化反応の不均一系触媒として、多孔質フェノールスルホン酸-ホルムアルデヒド樹脂(PAFR)を開発していた3)。この触媒は、高い触媒活性(バッチ反応および連続フロー反応で触媒量0.7 mol%、最長4日間の運転時間)など、前述のエステル化反応の長所を満たしているが、触媒の再利用性は不十分だった。連続フロー反応では、4日間で触媒が失活した。そこで、水の除去を必要とせず、より安定で高活性、再利用可能かつ実用性を兼備したFischer-Speierエステル化用高分子酸触媒を開発した。
第一世代PAFRが失活した理由は、p-フェノールスルホン酸の脱スルホニル化が、高温の酸性反応条件下で容易に起こるためである(図1)。この脱スルホニル化反応を防ぐために、我々は新規なm-フェノールスルホン酸樹脂触媒PAFR Ⅱを設計した4)。ここでは、より活性が高く再利用可能な第二世代m-フェノールスルホン酸-ホルムアルデヒド樹脂触媒(PAFR Ⅱ)を開発し、バッチおよび連続フロー条件を考慮してFischer-Speierエステル化反応に適用した結果を紹介する。PAFR Ⅱは、連続フロー条件下で、市販のイオン交換型スルホン酸樹脂触媒よりも高いエステル収率を示すことが明らかになった。
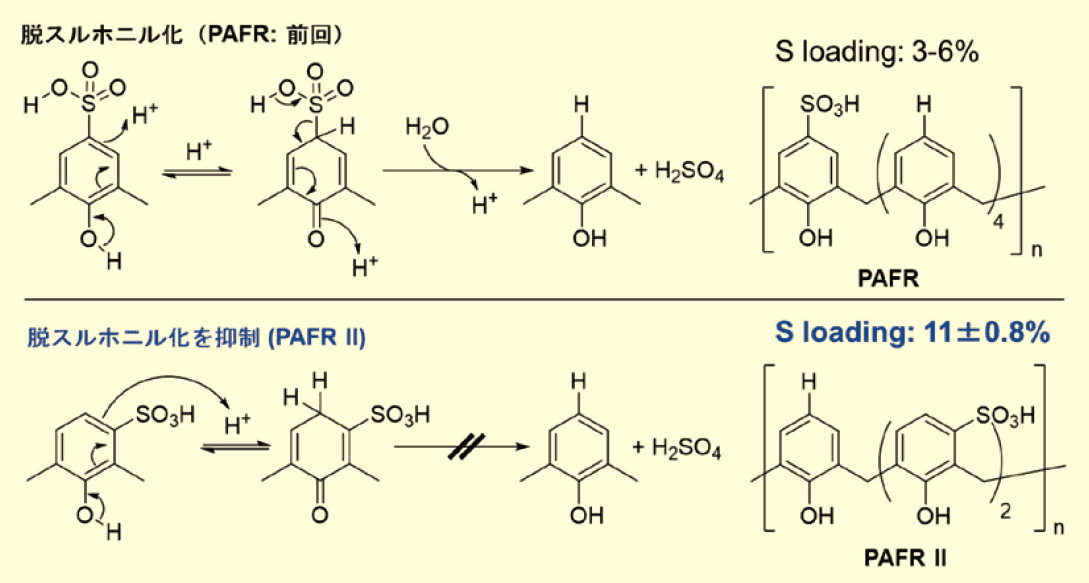
図1.PAFR の脱スルホニル化による分解とその抑制のための触媒設計 (PAFR II)
触媒調製
PAFR Ⅱは、硫酸水溶液中でm-フェノールスルホン酸ナトリウムとホルムアルデヒド(2 mol equiv)を 120 ℃(オイルバス温度)、24 時間縮合重合して調製された(図2)。溶液の色は徐々に薄くなり、重合中に暗緑色から黒色の石炭状の固体凝集体が多量に生成した。24 時間後温度を下げた。得られた固体を、水、塩酸水溶液、水、2-プロパノール、メタノールで順次洗浄した。真空乾燥後、黒色石炭状固体としてPAFR Ⅱが得られた。
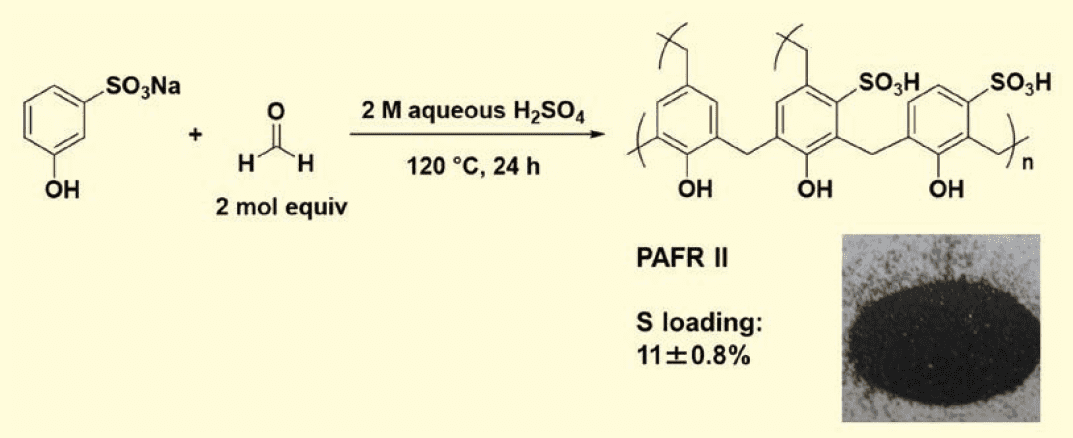
図2.PAFR II の調製
この手順により、機械攪拌式タンクリアクターを用いて、87グラムまでのPAFR Ⅱの調製を実現した。また、元素分析により触媒の再現性を確認したところ、異なる反応スケールで得られた触媒の硫黄含有量は11±0.8 wt%の範囲で再現性があることがわかった。PAFR Ⅱの表面画像を走査型電子顕微鏡(SEM)で観察した。粉砕されたPAFR Ⅱは、比較的均一な粒子径を持つ平坦な鉱石状の凝集体を示した。SEM上のエネルギー分散型X線(EDX)分光分析(EDX/SEM)では、高分子マトリックス上に硫黄原子が均一に分散しており、ナトリウムは検出されなかった。
PAFRとPAFR Ⅱの熱安定性を比較するために、熱重量測定/質量分析(TGMS)を行った。スルホン酸基の分解は、触媒が不活性化したことを示す直接的な証拠である。両PAFR触媒のスルホン酸基の分解に対応するピークを確認すると、PAFR Ⅱが、分解温度130 ℃のPAFRよりもはるかに安定している(分解温度180℃)ことが明らかになった。
PAFR とPAFR Ⅱのバッチ反応での比較
バッチ反応によるアクリル酸とメタノールの直接エステル化において、2つの触媒の再利用性を確認したところ、PAFR Ⅱの方がPAFRよりも安定であることが裏付けられた(図3)。0.5 mol%の触媒を同一の反応条件で試験したところ、最初の反応サイクルでは同様の触媒活性を示し、アクリル酸メチルがそれぞれ83%(PAFR)および86%(PAFR Ⅱ)の収率で得られた。触媒は回収され、前回の反応条件で次の反応サイクルに再利用された。PAFR Ⅱは触媒活性を失うことなく9回再利用できたのに対し、PAFRの再利用性は徐々に低下した。
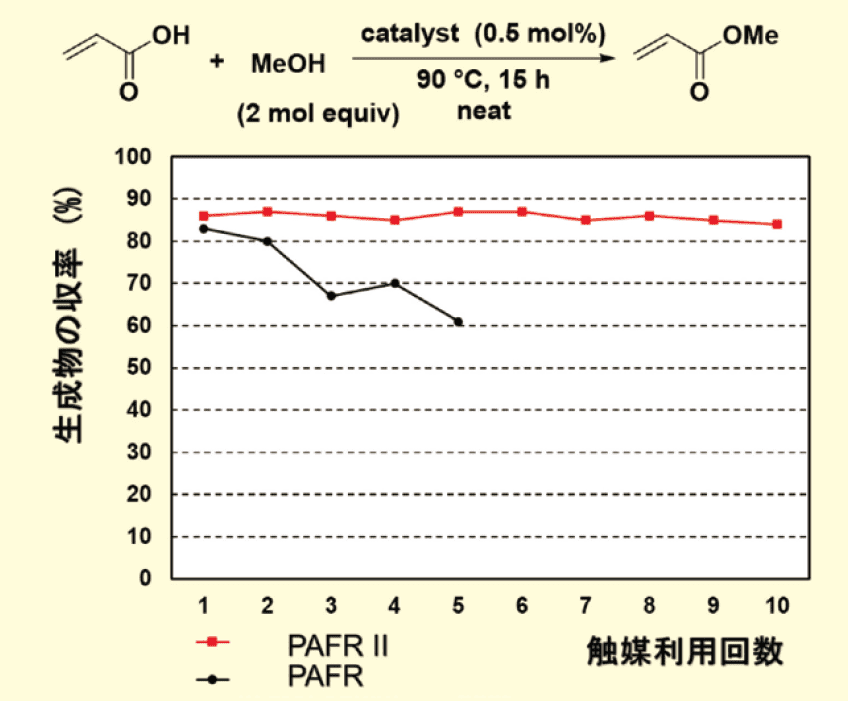
図3.PAFR とPAFR II のバッチ式反応での再利用性
フロー式エステル化での様々な固体触媒とPAFR Ⅱとの比較
高活性で安定した不均一系高分子酸触媒PAFR Ⅱが得られたので、次の段階は、連続フローでのFischer-Speierエステル化反応5)を実現することだった。PAFR IIをはじめ、市販の様々な不均一系酸触媒の触媒活性を、水を除去することなく反応温度90 ℃で比較した(図4)。
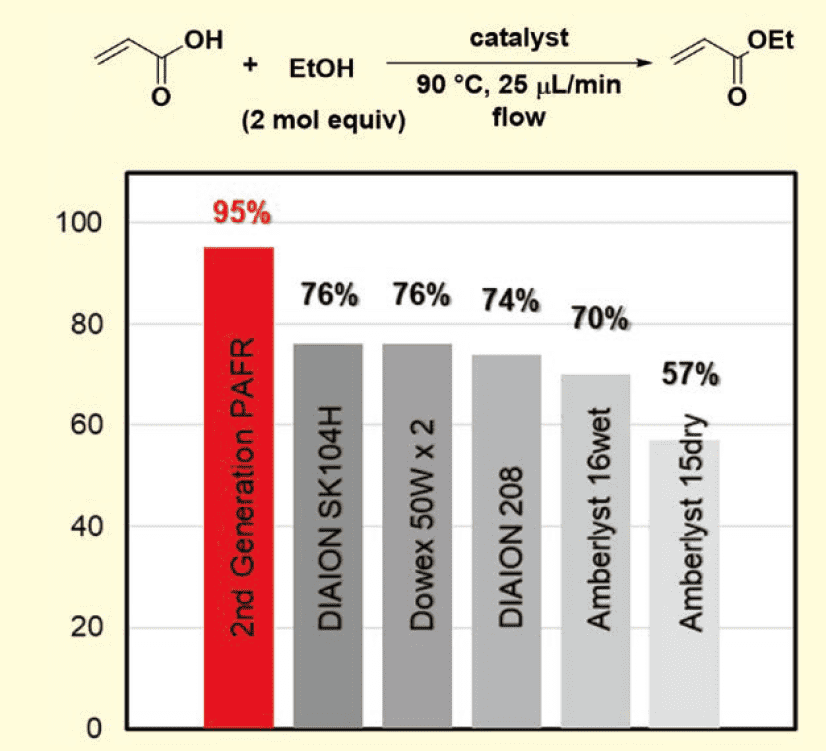
図4.フロー式エステル化での触媒活性の比較
アクリル酸とエタノール(2 mol equiv) の混合物を、1.1 mmol SO3HのPAFR Ⅱまたは他の様々な触媒を充填した触媒充填カラムに、25 μL/minの流速で通液した。PAFR Ⅱは、DIAION SK104H(収率76%)、DIAION PK208(収率74%)、Dowex 50Wx2(収率76%)、Amberlyst 16 wet(収率70%)およびAmberlyst 15 dry(収率57%)などの他の触媒に比べ高い収率でアクリル酸エチルを与えた(収率95%)。
バッチ式・フロー式エステル化での基質一般性
PAFR Ⅱが高い触媒活性を示したため、フロー式およびバッチ式の両条件で、様々なカルボン酸とアルコールの直接エステル化について検討した(図5)。
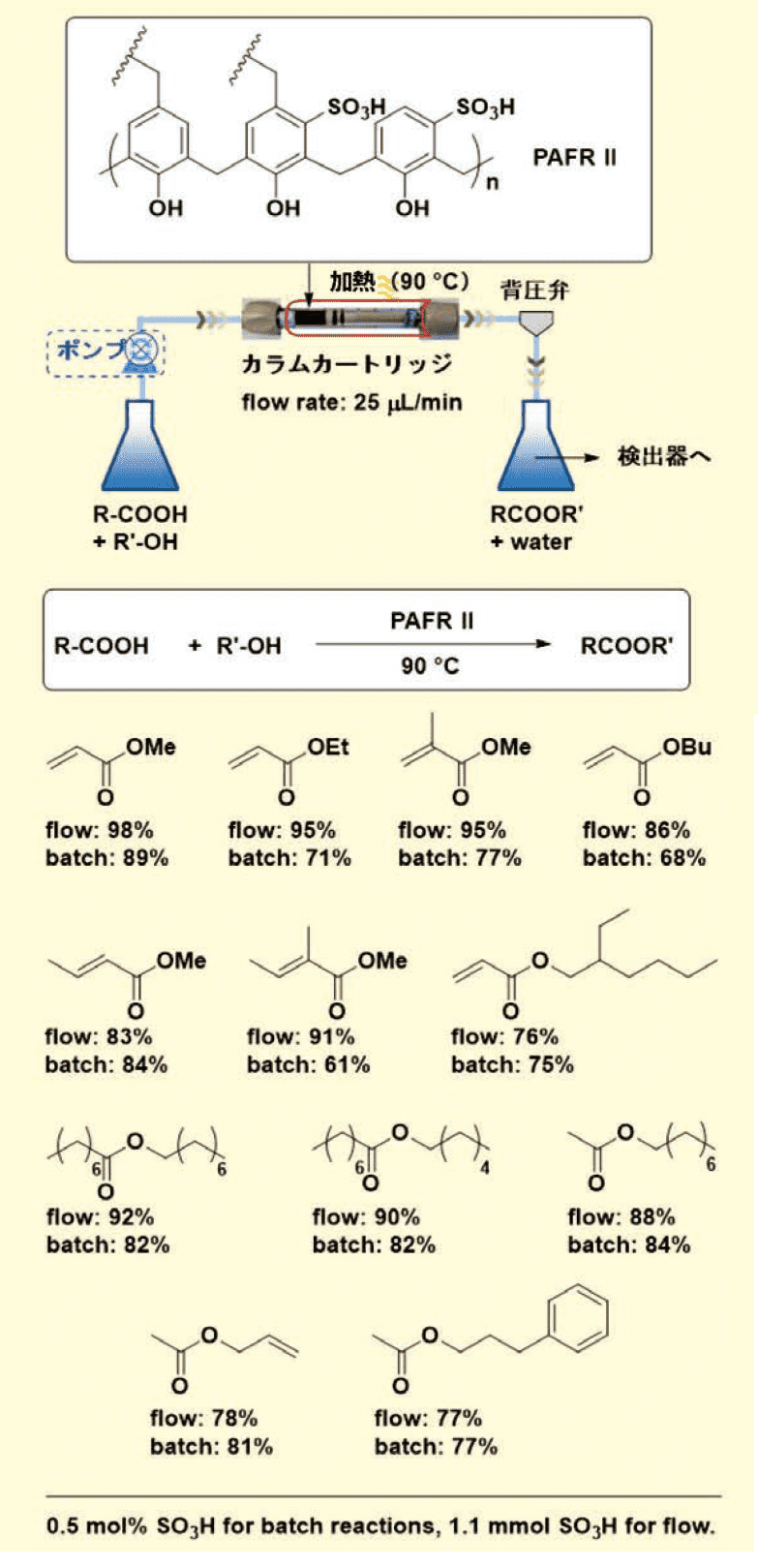
図5.バ ッチ・フロー式での基質一般性
連続フロー反応系の模式図を示す。アクリル樹脂は需要が高く、プレキシガラスなどの建築材料や装飾材料として建築業界で広く使用されている。フロー式の条件において、水の除去をすることなく、90 ℃で98%という高い収率でアクリレートエステル生成物が得られた。また、脂肪酸エステルも高収率で生成した。末端オレフィン結合を有するエステル、例えば酢酸アリルは80%以上の収率で、酢酸3-フェニルプロピルは77%で得られた。多くの連続フロー反応では、バッチ反応よりも高い生成物収率が得られた。連続フロー反応では、生成したエステルとともに水が生成したが、凝集して水滴となった。
フロー式バイオディーゼル燃料合成への応用
オレイン酸とリノール酸を主成分とするバイオマスをバイオディーゼルに変換するモデル反応にもPAFR Ⅱを適用した(図6)。連続フローによる直接エステル化は、リサイクル食用油からバイオディーゼルを製造するための有力なルートとなり得る。この用途では、固体酸触媒は、過剰なアルコールや大きな触媒負荷のために、うまく機能しないことが報告されている。
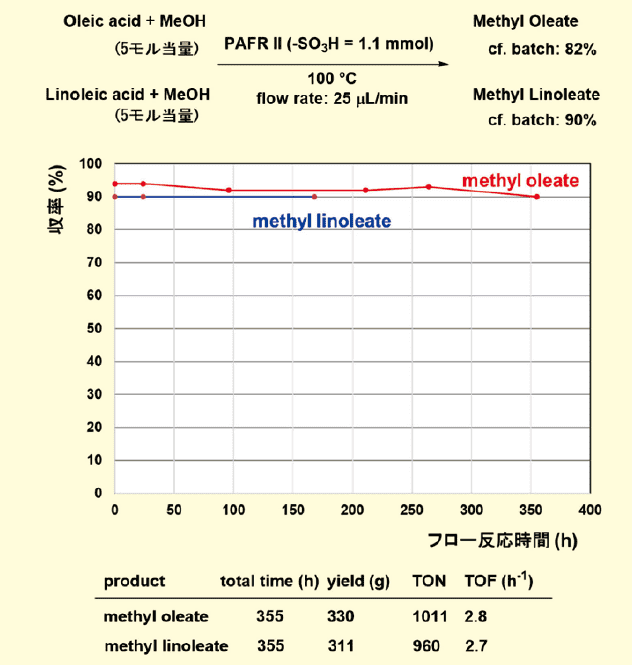
図6.フロー式連続エステル化によるバイオディーゼル燃料の合成
PAFR Ⅱによるバッチ反応条件下では、オレイン酸およびリノール酸は、それぞれ82%および90%の収率で対応するエステルに変換された。また、連続フローエステル化では、オレイン酸は2週間以上にわたって92%から94%の変換率が得られ、リノール酸は1週間にわたり90%の変換率が得られた。これらの結果は、この第二世代PAFR触媒を用いたバイオディーゼル生産プロセス応用の可能性を示すものであった。
終わりに
第一世代PAFRよりもスルホン酸含有量が高く、熱安定性に優れた第二世代メタフェノールスルホン酸-ホルムアルデヒド樹脂触媒PAFR Ⅱが開発された。より大きなスケールで調製しても、触媒活性や触媒反応温度での安定性に悪影響はなかった。この触媒はカルボン酸とアルコールの直接エステル化を連続フローとバッチ処理の両方で促進し、対応するエステルを高収率で与えた。また、PAFR Ⅱを充填したフローリアクターでは、触媒活性を失うことなく数ヶ月間基質を変換した。現在、さらなるエステル化の可能性、ならびに様々な酸触媒促進型有機変換反応への適用を進めている。
謝辞
PAFR Ⅱ開発研究は多くの共同研究者とともに実施された。理化学研究所のHao Hu博士、太田元氏、Heeyoel Baek博士、篠原賢太氏、大野綾氏に深謝申し上げる。これら一連の研究の一部はJST ACT-C(#JPMJCR12ZC)、JST ACCEL(#JPMJAC1401)、AMED(#19ak0101115h)、日本学術振興会(#24550126, #20655035, #15K05510)、武田科学振興財団、内藤記念財団、公益信託医用薬物研究奨励富岳基金、理化学研究所のご支援により進められたものである。心より御礼申し上げる次第である。
参考文献
- Fischer, E. and Speier, A. : Chem. Ber., 28, 3252 (1895).
- 最近の優れた例については以下の論文を参考にされたい。
(a)Ishihara, K. et al. : Science, 290, 1140 (2000).
(b)Manabe, K. et al . : J. Am. Chem. Soc., 123, 10101 (2001).
(c)Sakakura, A. et al. : Org. Lett., 14, 30 (2012).
(d)Pirez, C. et al. : ACS Catal., 2, 1607 (2012).
(e)Xu, X-H. et al. : RSC Adv., 3, 3848 (2013). - (a)Minakawa, M. et al. : Org. Lett., 15, 5798 (2013).
(b)Baek, H. et al. : Sci. Rep., 6, 25925 (2016).
(c)Kim, Y-H. et al. : Synlett, 27, 29 (2016). - Hu, H. et al. : Org. Lett., 22, 160 (2020).
- Furuta, A. et al. : Bull. Chem. Soc. Jpn., 90, 607 (2017).




