【テクニカルレポート】細胞内アセチルCoAを活性化して可視化する蛍光検出プローブ
本記事は、和光純薬時報 Vol.90 No.1(2022年1月号)において、東京大学大学院 薬学系研究科 山次 健三様、金井 求様に執筆いただいたものです。
はじめに
生体分子は様々な化学修飾を受けることによって多様な機能を発揮する。例えば、生体機能の中心を担うタンパク質は翻訳後修飾を受けることで、限られたゲノム情報(〜2万5千の遺伝子)から100万以上のプロテオームを形成している。その翻訳後修飾の代表がタンパク質リジン残基のアセチル化であり、アセチル化酵素がアセチルCoAを唯一のアセチル化剤として用いてヒストンをはじめとする様々なタンパク質をアセチル化し、遺伝子転写調節から代謝調節に至るまで広範な生命現象に重要な役割を果たしている1)。
最近では、アルコールの摂取によって生じた酢酸が脳内でアセチルCoAへと変換され脳細胞のヒストンアセチル化を亢進することで学習や記憶に関連する遺伝子の転写を促進することが報告されるなど2)、生体の環境応答においてもアセチルCoAが重要な役割を担っていることが分かってきた。したがって、細胞内のアセチルCoAを可視化できるプローブは有用な分子生物学ツールになることが期待されるが、そのような手法は存在しなかった。
本稿では、我々が開発した細胞内アセチルCoA検出蛍光プローブRH-NH2を紹介する3)。
RH-NH2蛍光プローブの設計
細胞内のアセチルCoAを蛍光シグナルとして検知するには、アセチルCoAにより構造変化が誘起され、蛍光強度が増大する分子が必要である。そこで、蛍光プローブとともにアセチル基転移促進剤を用いることで、細胞内でアセチルCoAから蛍光プローブへとアセチル基を転移し、それにより蛍光強度を増すことが出来ないかと考えた。アセチルCoAは主にミトコンドリアで産生されるため、ミトコンドリアに局在することが報告されていたN,N,N',N'-テトラメチルローダミンを蛍光プローブの母骨格に採用し4)、そのアミノ基がアセチル化を受けることでPhotoinduced-electron transfer(PET)メカニズムが解除されることにより蛍光強度が増大する蛍光プローブRH-NH2を設計した(図1)。
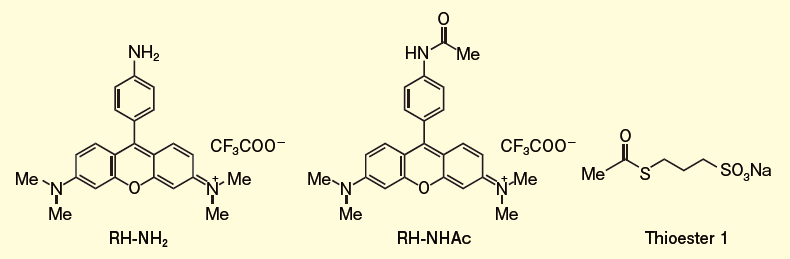
図1.細胞内アセチルCoA 可視化蛍光プローブRH-NH2
蛍光プローブRH-NH2、そのアセチル化生成物RH-NHAc、アセチルCoA 等価体Thioester 1RH-NH2は546 nmに最大吸収波長(ε = 71400 M−1cm−1)と570 nmの最大蛍光波長を有し、そのアセチル化体であるRH-NHAc(図1)は553 nmの最大吸収波長(ε= 35500 M−1 cm−1)と572 nmの最大蛍光波長を有した。PBS 緩衝液中(1%DMSO)での蛍光量子収率はRH-NH2が4.9×10−4 であるのに対し、そのアセチル化体であるRH-NHAcは0.12を示し、520 nmの励起時においておよそ50倍の蛍光強度を示した(図2a)。したがって、RH-NH2はそのアミノ基がアセチル化を受けることによって蛍光強度が増大するturn-on型の蛍光プローブであることが示された。
アセチル基転移促進剤によるRH-NH2の蛍光強度増大
次に、アセチルCoAからRH-NH2へのアセチル基の転移を促進する反応促進剤の検討を行った。複数の求核触媒を検討したところtributylphosphine(PBu3)が最も効率よくRH-NH2へのアセチル基転移を促進できると分かった。
図2bにはアセチルCoAと同じチオエステルであるThioester 1(図1)をアセチル化剤、PBu3を反応促進剤として用いた時の、RH-NH2の蛍光強度の時間変化を示す。RH-NH2とThioester 1存在下、測定開始1分後に反応促進剤であるPBu3を添加することで速やかな蛍光強度の増大が見られた。その増大の程度は2〜3倍であり、RH-NH2が完全にアセチル化された際の50倍の蛍光強度の増大(図2a)と比べると低いものの、mMオーダーのアセチルCoAを蛍光検出できることが分かった。
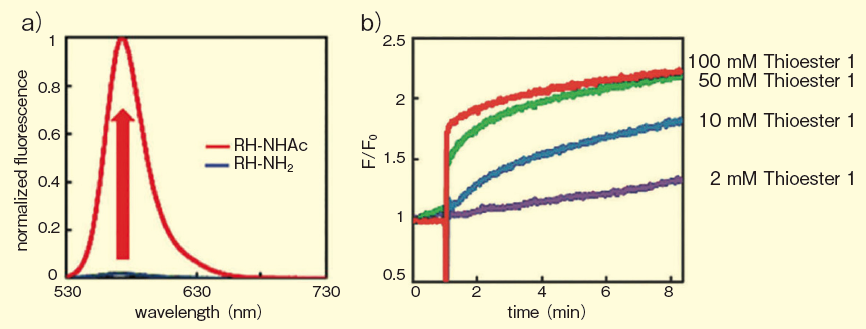
図2.RH-NH2 の蛍光特性
a)RH-NH2 のアセチル化による蛍光強度の増大(励起波長520 nm)。b)アセチル基転移促進剤PBu3 の添加によるRH-NH2の蛍光増大の時間変化。
細胞内アセチルCoAの可視化
HeLa S3細胞をRH-NH2(2μM)で処理したところ、予想通りミトコンドリアに局在して弱い蛍光を発する様子が観察された。このままでは蛍光強度の増大は見られなかったが、ここにアセチル基転移促進剤であるPBu3(5 mM)のDMSO溶液を加えたところ、1分以内に明らかな蛍光強度の増大が見られた(図3)。

図3.RH-NH2 による細胞内アセチルCoA の蛍光検出
これは反応促進剤であるPBu3がアセチルCoAを活性化してミトコンドリアに局在しているRH-NH2プローブをアセチル化し、蛍光強度の増大が起こったものと考えられる。なお、PBu3(5 mM)やRH-NH2(10μM)の添加では細胞毒性やミトコンドリアの膜電位変化が生じないことを確認している。以上より、RH-NH2は生細胞でアセチルCoAを可視化するこれまでにない有用な蛍光プローブとなることが示された。
おわりに
冒頭で述べたように、タンパク質のアセチル化は生体機能調節を担う重要な細胞内化学反応である。細胞内タンパク質のアセチル化レベルは細胞内に存在するアセチルCoAの量によって変動することが知られており5)、本研究で開発したアセチルCoA検出蛍光プローブRH-NH2はタンパク質のアセチル化修飾が有する生物学的機能を解析する有用なツールの一つとなることが期待される。さらに、細胞内の狙ったタンパク質にアセチル化修飾を人為的かつ選択的に導入することができれば、それも有用なツールになるに違いない。
我々は化学触媒を用いたヒストンの位置選択的アセチル化とエピゲノムへの介入にも成功しており6)、これらの化学的手法が細胞内翻訳後修飾解析の有用なツールや新たな医薬シーズとなることを期待している。
参考文献
- Zhao, S. et al. : Science, 327, 1000 (2010). DOI: 10.1126/science.1179689
- Mews, P. et al. : Nature, 574, 717 (2019). DOI: 10.1038/s41586-019-1700-7
- Komatsu, H. et al. : Chem. Commun., 49(28), 2876 (2013). DOI: 10.1039/C3CC40616D
- Dickinson, B. C. et al. : Curr. Opin. Chem. Biol., 14(1), 50 (2010). doi: 10.1016/j.cbpa.2009.10.014
- Weinert, B. T. et al. : Mol. Syst. Biol., 10 (1), 716 (2014). DOI: 10.1002/msb.134766
- Fujiwara, Y. et al. : Proc. Natl. Acad. Sci. USA, 118 (4), e2019554118 (2021). DOI: 10.1073/pnas.2019554118




