もっとも単純な不斉触媒「プロリン」
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。
はじめに
プロリン (proline) は、タンパク質などを構成する天然型α-アミノ酸20種類のうち、唯一の環状イミノ酸で、下に示したような単純な構造をしています。
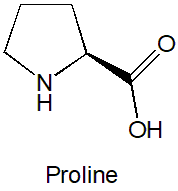
生物を学んだ方ならおなじみの分子ですが、この単純な分子が有機反応の不斉触媒として働くと聞いたときは驚いた人も多いのではないでしょうか? 「触媒」といえば一般的に金属や金属錯体が頭に浮かびますが、このようなシンプルな分子も触媒になりえるのです。
実際、プロリンを使った触媒反応の開発、ひいては有機触媒反応そのものは、現代の有機合成化学で盛んに研究されています。
有機不斉触媒とは?
触媒量の不斉源を用いて大量の光学活性な化合物を得る方法論である「触媒的不斉合成」は、医薬品化学・精密有機合成の発展に大きく貢献し、今なお世界中の研究者が競って研究を続けています。野依良治先生が2001年のノーベル化学賞を受賞された分野ということでも有名です。
この不斉触媒には、金属を活性中心とする触媒がよく用いられてきました。高活性なものが多い一方で、金属自体が高価・有毒・廃棄困難なことに加え、触媒自体も水や酸素に不安定で取扱いが困難なものが多いという面も少なくありませんでした。この欠点を解消しようと、世界中の研究者が取り組んできています。その有望な解決策になると期待されているものが、有機不斉触媒 (asymmetric organocatalyst) です。その名のとおり金属を使わず、有機分子そのものを不斉触媒として用いるという考えです。有機分子触媒は、一般に取扱いや構造のチューニングが簡単で、安定・安価・環境に優しいなどの利点があるとされています。
この思想のもと、これまでに開発されている代表的な人工有機触媒を示します。
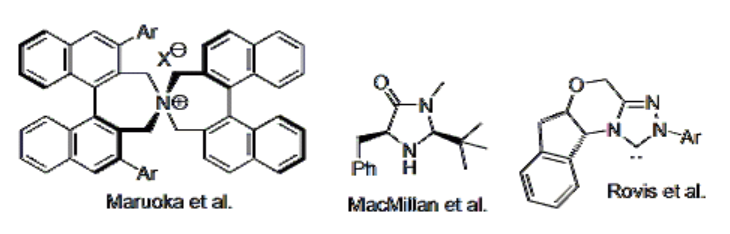
プロリンは、最も簡単な構造をしている有機不斉触媒です。アミノ酸なので天然に膨大に存在し、(天然型は) ものすごく安価です。安価なわりに比較的良い触媒性能を示すことが分かっており、プロリン触媒による反応が実用化できれば有用性は測り知れません。
歴史的背景
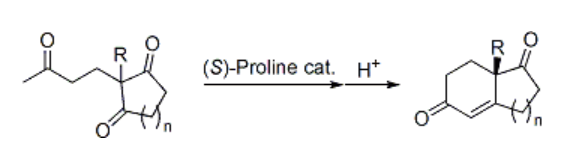
プロリンを不斉触媒として用いる反応例が初めて報告されたのは、1971年のことです1)。下図のように、合成中間体として有用なビシクロケトンを不斉合成できる優れた方法でした。しかしこの報告以来、長くプロリンは不斉触媒として用いられませんでした。
間をあけて2000年に、List, Barbasらによりプロリンを用いた分子間直接的不斉アルドール反応がアメリカ化学会誌に報告されました2)。まずプロリンとケトンが反応して活性エナミン中間体を形成し、続いてアルデヒドと反応、最後に加水分解を受けることでアルドール体が生成するとされています。
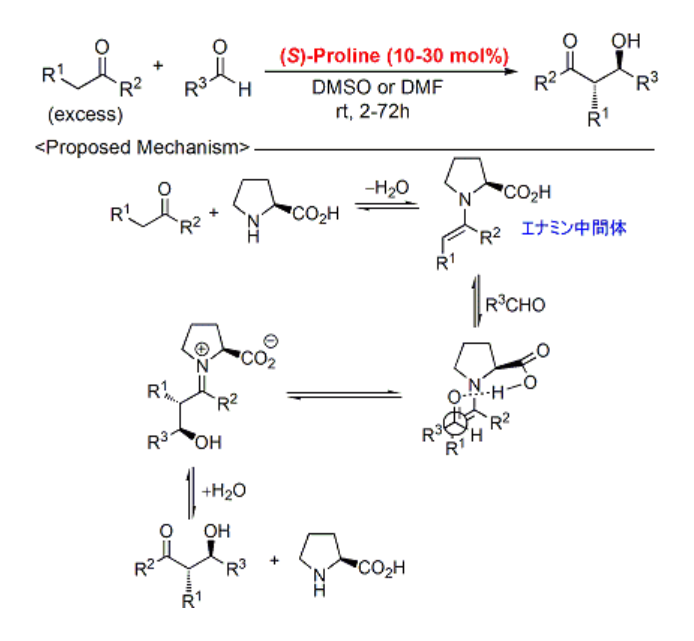
本報告は分子間反応でもプロリンが不斉触媒として有効に働くことを示した初めての例です。これ以降、有機触媒研究のブームに火がつき、世界中で活発な研究が進みました。
代表的な反応例
報告例の中には、不斉金属触媒ではいまだ達成されない優れた反応形式も少なからず見受けられ、有機触媒ならではの可能性が垣間見えます。以下に代表的な報告例を紹介します。
3成分Mannich反応3)a
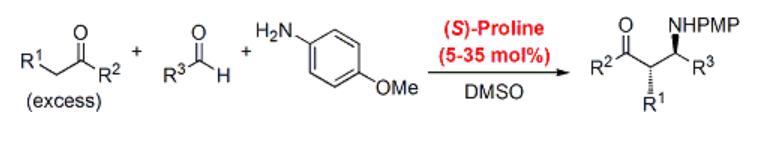
アルドール反応とほぼ同様の反応機構で進行するとされるMannich反応においても、プロリン不斉触媒は有効に機能します。通常はアクセプターであるイミンを別途調製することが多いのですが、本反応ではケトン・アルデヒド・アミンを混ぜて系中で生成したイミンと反応させています。
いくつかの基質では収率に難がありますが、低温・高圧条件下で反応する氷化高圧法により、収率・選択性ともに改善できることが後に報告されています3)b。
アミノ化4)a-b、オキシアミノ化5)a-d
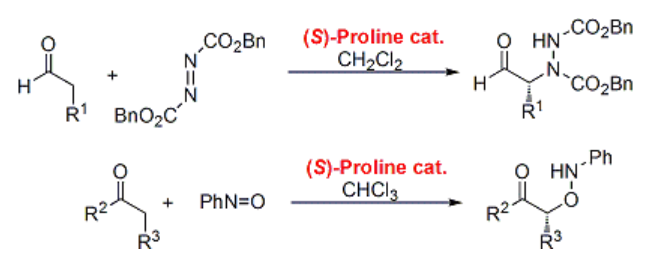
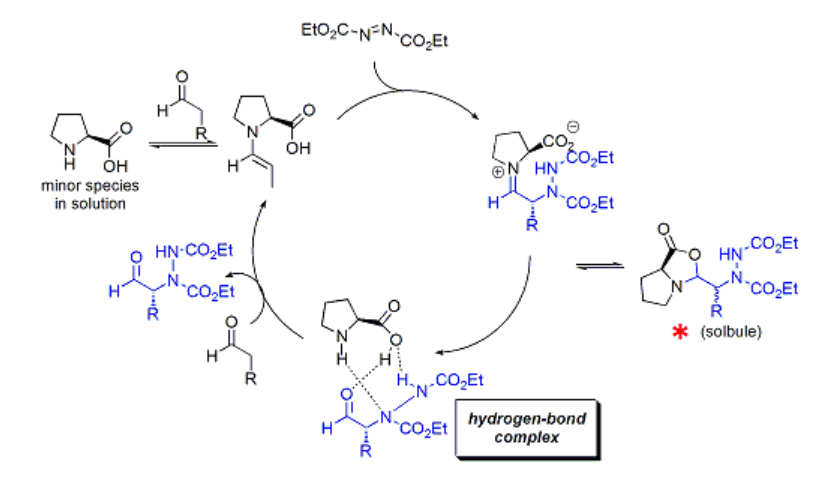
これらも基本的にはアルドール反応類似の様式ですが、反応機構面で他に類を見ない特徴を有することをBlackmondらが報告しています6)a-c。本反応の反応性が格別に高い (低触媒量・短反応時間で良い) ことに着目して、系のHeat-Flow解析した結果から、他のプロリン反応と異なる自己触媒誘起反応 (用語注) の挙動を示すことを提唱しました6)a。
その後、下図の*で示すオキサゾリジノン型化合物が単離されてきたことや、プロリンそのものが有機溶媒には溶解しにくいこと、さらに生成物の濃度が高いほど反応速度が速い結果などを考慮し、現在では以下のような修正型反応機構が提唱されています6)c。
実際にはプロリンそのものが関与する反応経路はごくマイナーであり、実際には生成物とプロリンが水素結合を介した複合体を形成し、これが実際の媒体として機能するという機構です。この複合体の存在は計算によっても裏付けられています。
用語注
自己触媒反応 (autocatalysis) とは、生成物が同じ反応の触媒 (自己触媒) として働く反応形式を指します。反応が進行するに従い、触媒として働く化合物種が増えていくので、反応速度は加速度的に増加します。
自己触媒誘起反応 (autoinductive reaction) とは、反応生成物がより効率の良い触媒の生成を促進するプロモータとして働く現象で、生成物そのものが触媒として働かない点で自己触媒反応とは区別されます。
アルデヒドの直接的交差アルドール反応7)
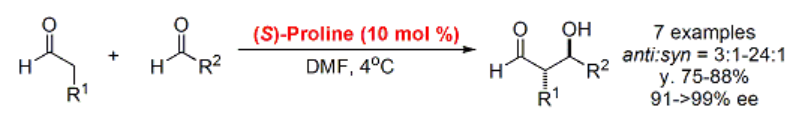
向山アルドール反応のようにシリルエノラートを経由せず、異種アルデヒド間で不斉交差アルドール反応を進行させる直接的不斉交差アルドール反応は、ホモ二量化・多量化の進行を抑えるのが難しく、効率よく進行させることがきわめて難しい反応とされています。MacMillanらは片方のアルデヒドのSlow Additionによってホモ二量化を抑え、条件を最適化して高収率・高選択性を実現しています。アルデヒドを有する生成物は、レドックス過程を経ずそのまま次の変換に使えるため、合成を劇的に効率化する可能性を秘めています。
アミノ酸から糖を合成!?
プロリン触媒反応の応用として、興味深い例は、アミノ酸 (プロリン) が触媒となって糖を合成するというものです。
糖鎖は細胞認識や免疫応答シグナル伝達の担い手として、生体内ではきわめて重要な役割を果たしているユニットです。糖は膨大に存在するので、よく研究されていそうですが、DNA、RNA (核酸) やタンパク質 (アミノ酸) などと比して、その働きが明らかになってきたのは最近のことのようです。
というのも、糖鎖は構造の複雑さゆえに、生体内でどこがどのように利いているかを調べるのが難しいのです。詳細に調べるには、膨大な種類の糖鎖を準備して網羅的に対照実験を行う必要があります。 しかし単純な構造のアミノ酸や、PCRで簡単に増やせる核酸と異なり、糖鎖は欲しい物がすぐ手に入らないという事情があります。糖鎖合成化学は、保護・脱保護の化学そのものともいえ、合成経路がどうしても長くなってしまいます。
つまり、詳細な研究をしたいと思っても必要な人工糖鎖がなかなか用意できない――このことが糖鎖の機序解明を遅らせている一因なのです。
そもそも単糖の光学純粋の形で作ること自体、それほど簡単ではありません。六炭糖を選択的に合成できる方法論のうち、有名な一つにSharpless不斉酸化反応に頼る合成法があります8)a。この方法では考えうるすべての絶対・相対配置の六炭糖を合成できますが、わりと長めの合成経路が要ります。
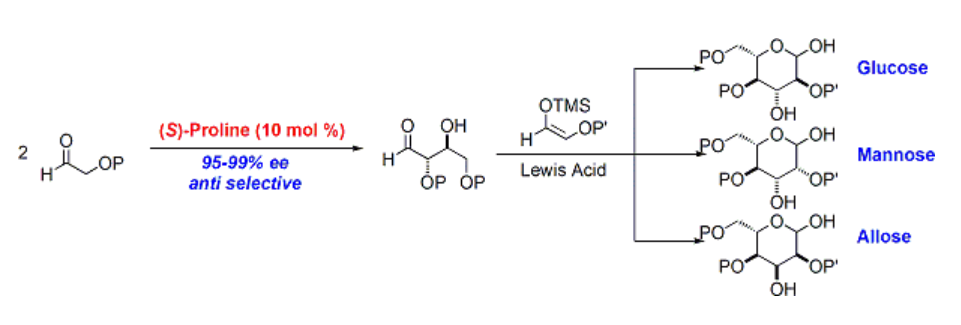
これに対して、MacMillanらは2004年、プロリンを不斉触媒として用いた六炭糖類の新規化学合成法を報告しています8)b。
先述のアルデヒド交差アルドール反応を応用し、まず原料の保護オキシアルデヒドを二量化させ、続いて立体選択的向山アルドール反応を行い、高エナンチオ選択的・ジアステレオ選択的に六炭糖を合成しています。わずか2工程で合成でき、報告されている中では最短のルートです。生成物も適度に保護され扱いやすく、窒素・硫黄の導入や13C標識も容易で、応用性の高い優れた方法といえます。
おわりに
今回取り上げた例はプロリンそのものを使うものばかりでしたが、それ以外にも、修飾・変換を施したプロリン誘導体、人工有機触媒など、様々な反応の優れた触媒が見つかっています。
参考文献
- (a) Eder, U. et al.: Angew. Chem., Int. Ed. Engl., 10, 496 (1971). DOI: 10.1002/anie.197104961
(b) Hajos, Z. G. et al.: J. Org. Chem., 39, 1615 (1974). DOI: 10.1021/jo00925a003 - (a) List, B., Lerner, R. A., Barbas III, C. F.: J. Am. Chem. Soc., 122, 2395 (2000). DOI: 10.1021/ja994280y
(b) Notz, W., List, B.: J. Am. Chem. Soc., 122, 7386 (2000). DOI: 10.1021/ja001460v
(c) List, B., Pojarliev, P., Castello, C.: Org. Lett., 3, 573 (2001). DOI: 10.1021/ol006976y - (a) List, B.: J. Am. Chem. Soc., 122, 9336 (2000). DOI: 10.1021/ja001923x
(b) Hayashi, Y. et al.: J. Am. Chem. Soc., 125, 11208 (2003). DOI: 10.1021/ja0372513 - (a) List, B.: J. Am. Chem. Soc., 124, 5656 (2002). DOI: 10.1021/ja0261325
(b) Jorgensen, K. A. et al.: Angew. Chem., Int. Ed., 41, 1790 (2002). DOI: 10.1002/1521-3773(20020517)41:10<1790::aid-anie1790>3.0.co;2-y - (a) Zhong, G.: Angew. Chem., Int. Ed., 42, 4247 (2003). DOI: 10.1002/anie.200352097
(b) MacMillan, D. W. C. et al.: J. Am. Chem. Soc., 125, 10808 (2003). DOI: 10.1021/ja037096s
(c) Córdova, A. et al.: Angew. Chem., Int. Ed., 43, 1109 (2004). DOI: 10.1002/anie.200353018
(d) Hayashi, Y. et al.: Angew. Chem., Int. Ed., 43, 1112 (2004). DOI:10.1002/anie.200353085 - (a) Blackmond, D. G. et al.: Angew. Chem., Int. Ed., 43, 3317 (2004). DOI: 10.1002/anie.200453997
(b) Blackmond, D. G. et al.: J. Am. Chem. Soc., 126, 11770 (2004). DOI: 10.1021/ja046258x
(c) Blackmond, D. G. et al. :J. Am. Chem. Soc., 126, 16312 (2004). DOI: 10.1021/ja0444177 - MacMillan, D. W. C. et al.: J. Am. Chem. Soc., 124, 6798 (2002). DOI: 10.1021/ja0262378
- (a) Sharpless, K. B. et al.: Science, 220, 949 (1983). DOI: 10.1126/science.220.4600.949
(b) MacMillan, D. W. C. et al.: Science, 305, 1752 (2004). DOI: 10.1126/science.1101710




