カール・フィッシャー滴定
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。

原理と測定法
カール・フィッシャー滴定 (Karl Fischer titration) は、試料中の水の量を滴定により求める分析手法です。その原理は、塩基性条件下メタノール溶液において、ヨウ素により二酸化硫黄が酸化される際に水を消費する反応を利用するというものです - (1)
I2 + SO2 +3 Base +H2O + CH3OH → 2 Base・HI + Base・HSO4CH3 (1)
塩基 (Base) には一般にイミダゾールなどアミン類が使われます。滴定法には電量滴定と容量滴定の2種類があります。
電量滴定法
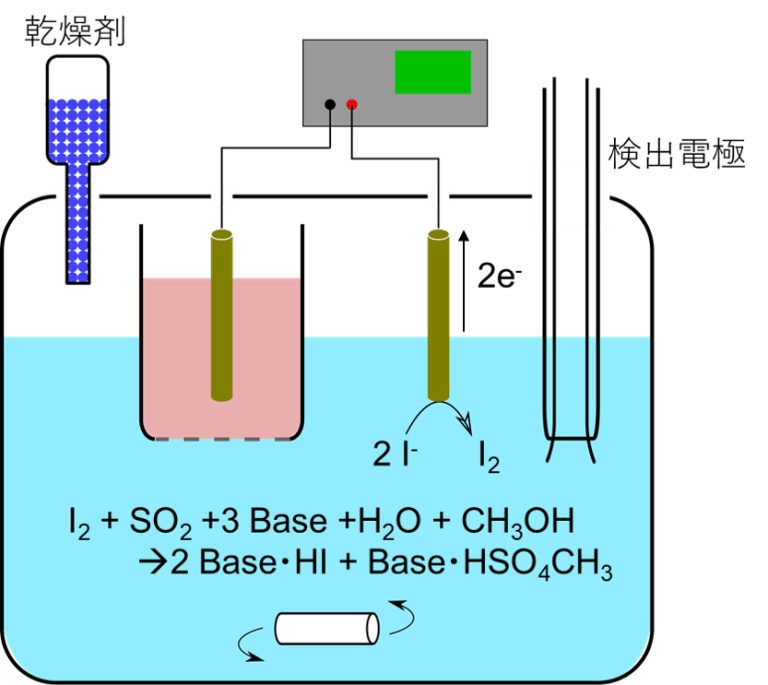
図1. カール・フィッシャー電量滴定
電量滴定法では、図1に示すような滴定セルを用います。メタノール、塩基、二酸化硫黄、ヨウ化物イオン (ヨウ化カリウムなど)、試料から成る溶液に電極を浸しており、陽陰極間はイオン透過膜で仕切られています。陽極でヨウ化物イオンを酸化してI2が生成すると (1) の反応が起こります。当量点に達するまでに要した電気量から生成したヨウ素の物質量が求まり、(1) の反応係数比よって試料中の水の量が求まります。
容量滴定法
カール・フィッシャー試薬 (メタノール、塩基、二酸化硫黄、ヨウ化物イオン) により試料を滴定します。
両滴定法共に空気中の水の吸湿を防ぐため、外気と遮断した系で塩化カルシウムやシリカゲルなどで防湿します。
終点の見極め
検出電極 (白金電極対) を用いて定電流電位差滴定を行います。これは検出電極間に微小電流を流しておき、滴定中の分極電位をモニターする形式です。当量点を超えるとI2が消費されなくなり、過剰量のI2が生成されて分極電圧が小さくなります。測定開始時の電圧以下になった点を終点としています。
利用例
- 溶媒中の含水率測定
- 二次電池の電解液中の含水率測定
- イオン液体中の含水率測定
- ティッシュペーパーの含水率測定
- プラスチックペレットの含水率測定
- グリースの含水率測定
- コンクリートの含水率測定
他の定量法との比較
カール・フィッシャー滴定法以外の水の定量法には、以下のような方法があります。
- 乾燥前後の重量変化から水の含有量を求める常圧乾燥法及び減圧乾燥法
- 水分子の赤外吸収から定量する赤外吸収法
- カラムクロマトグラフィー
- 薄膜への水の吸着による重量変化を水晶振動子で検出する水晶発振法
- 中性子が同程度の質量である水素原子と強く相互作用して減速することを利用し生成する熱中性子(高速中性子が衝突を繰り返し、熱運動と熱平衡状態に達した運動エネルギーの低い中性子)をカウントすることで定量する中性子散乱法
乾燥法で測定した値は水以外の揮発性物質の重量を含んだ値となってしまいます。近年ではカラムクロマトグラフィーにより同程度かそれ以上の精度で水の含有量測定が可能となってきています。しかし、カラムクロマトグラフィーの定量範囲はppm~数%と低濃度に限られます。水晶発振法は測定対象がガスであり、高純度ガスの精度管理に用いられています。中性子散乱法はコークスの含水率測定など固体試料に用いられる方法で定量範囲は数%です。
これらの測定法を比べるとカール・フィッシャー滴定の強みは、以下のようになります。
- 測定可能範囲が広い (ppm~100%)
- 大がかりな装置を必要としない
- 選択的に水を定量できる
- 測定対象が広い(固体、液体、気体)
現在、上記のような原理のカール・フィッシャー滴定装置が自動化され、販売されています。




