【テクニカルレポート】ヒトiPSC由来腸管上皮細胞F-hiSIEC™(エフ・ハイシーク)を用いた腸内細菌共培養
本記事は、和光純薬時報 Vol.92 No.1(2024年1月号)において、富士フイルム株式会社 バイオサイエンス&エンジニアリング研究所 山﨑 奈穂様、望月 清一様に執筆いただいたものです。
F-hiSIEC™とは
ヒトiPSC由来腸管上皮細胞 F-hiSIEC™(エフ・ハイシーク)は、FUJIFILMが保有するiPS細胞関連の技術と名古屋市立大学の松永教授が持つ分化誘導技術を組み合わせて作製した細胞です。本細胞は、iPS細胞から内胚葉、腸管幹細胞、腸管上皮細胞へと分化誘導させて作製します。分化誘導の検討を重ねた末に、CYP3A4活性をはじめ、ヒト小腸に近い性質を安定して保持する細胞の作製に成功し、製品化に至りました1)。
本細胞は、市販のセルカルチャーインサートやウェルプレートに播種して簡便に使用できます。セルカルチャーインサート上では単層の膜構造を形成し、生体の腸管と同様にバリア機能を示します。現在、F-hiSIEC™を用いたアプリケーションとしては、食品や薬物の動態評価(吸収・代謝・酵素誘導評価)、毒性評価、免疫・炎症評価2)などが構築できており、食品メーカー、製薬企業、アカデミア等で幅広く活用されています。
腸内細菌研究におけるF-hiSIEC™の活用について
腸内には約1000種類、合計約40兆個の腸内細菌が存在し、腸内細菌叢を形成しています。これまでの研究から、腸内細菌がヒトの健康・疾患に深く関与しており、腸内細菌叢のバランス異常は、消化器疾患のみならず、代謝性疾患、がん、免疫系疾患、循環器疾患など、様々な疾患に関与していることがわかっています3)。そのため、医薬品、健康食品、バイオティクス、便移植等によって、腸内細菌バランスを調節・制御し、疾患の予防・治療を目指す研究が盛んに進められています。
そのような状況下において、従来の動物実験に加えて、ヒト腸管細胞等のin vitro評価ツールの開発が期待されています。現在、in vitro評価ツールとしては、生体の腸管から採取した初代腸管細胞やCaco2細胞等の株化細胞がありますが、前者は入手困難でロット間差や培養の難しさがあり、後者はヒト腸管と比較して性能・性質が乖離しているという課題があります。また、腸内細菌は嫌気性菌が多く、その培養には嫌気チャンバー等の装置も必要となります。
FUJIFILMでは、簡便に腸内細菌-宿主細胞の相互作用を再現するために、嫌気条件を維持する培養器具を用意し、ヒト腸管細胞の性質を有するF-hiSIEC™による「腸内細菌との共培養」を検討しました。
F-hiSIEC™と腸内細菌の共培養について
簡便な嫌気条件を用意するために、小型の培養器具(図1-a)を準備しました。
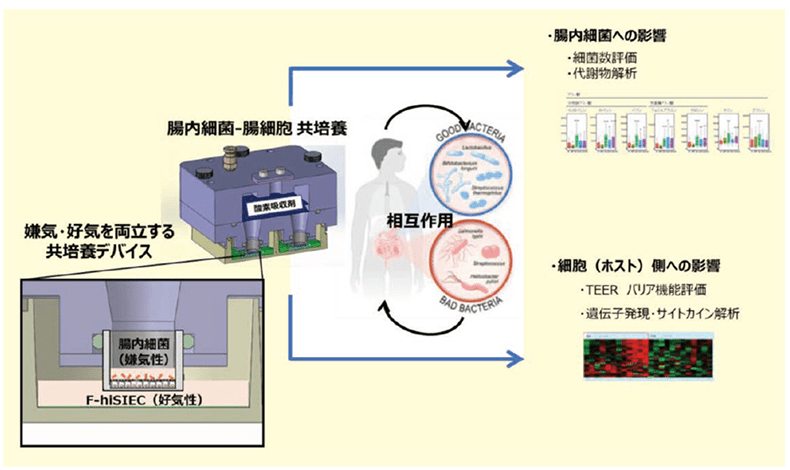
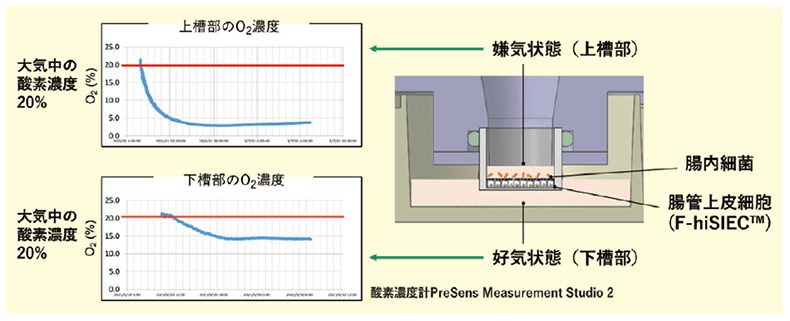
この器具では、市販トランズウェルを用いることで、腸内細菌を培養する側(Apical側)を酸素吸着剤にて嫌気状態に、細胞に栄養や酸素を供給する側(Basal側)を好気状態にすることを可能にします。具体的には、CO2 インキュベータ内で、Apical側の嫌気状態を約72時間維持することができました(図1-b)。
上記の培養条件にて、F-hiSIEC™と偏性嫌気性細菌であるBacteloides fragilis(B. fragilis)との共培養を実施し、宿主細胞への作用について評価を実施しました。
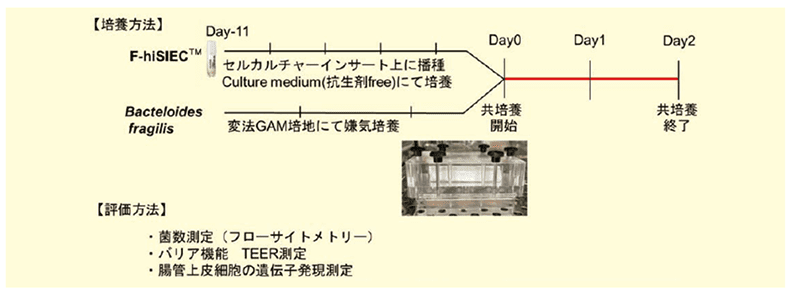
実験方法としては、F-hiSIEC™とB. fragilisを個別に前培養した後、2日間共培養を実施し、菌数変化、細胞のバリア機能と遺伝子発現の変化を測定しました(図2-a)。
その結果、嫌気(Apical側)/好気(Basal側)の条件での共培養において、B. fragilisの増殖が確認され、F-hiSIEC™のバリア機能(TEER値)の向上が認められました(図2-b)。

また、バリア機能の構築に関わるタイトジャンクション関連因子(ZO1/TJP1)、短鎖脂肪酸受容体、さらには炎症性サイトカインの遺伝子発現の上昇がみられました(図2-c)。
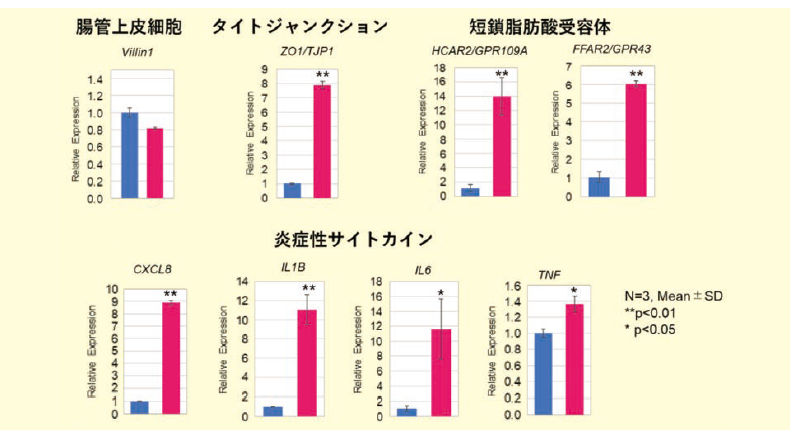
以上の結果から、B. fragilisは腸管上皮細胞に作用し、腸のバリア機能を強化する機能、免疫を調節する機能があることが示唆されました。B. fragilisについては、in vivoの実験において免疫調節・バリア強化作用が報告されており4)、今回のF-hiSIEC™を用いた検討でも同様の結果が得られたと考えられます。よって、F-hiSIEC™と腸内細菌の共培養では、生体同様に宿主細胞-腸内細菌の相互作用を評価できる可能性が示唆されました。
また、F-hiSIEC™とビフィズス菌との共培養では、ビフィズス菌による免疫調節因子の産生量が増加し、また、腸管上皮細胞が産生する代謝産物がその免疫調節因子の産生量を増加させるという報告がなされています5)。
今後、B. fragilisやビフィズス菌以外にも、様々な腸内細菌とF-hiSIEC™との共培養が実施され、研究成果として報告されることが期待されます。
今後の展望
F-hiSIEC™には、腸内細菌が産生するLPSやリポタンパク、核酸を認識するToll様受容体(TLR)、腸内細菌の代謝物である短鎖脂肪酸の受容体が発現・機能していることが確認されています2)。TLRや短鎖脂肪酸受容体は、宿主の免疫・炎症反応に関与していることから、今後、F-hiSIEC™と種々の腸内細菌との共培養により、腸内細菌による宿主の免疫・炎症反応への関与とメカニズムの解明が期待されます。
また、F-hiSIEC™では、腸内細菌等を抗原として取り込むと考えられているM細胞の存在も確認されています2)。M細胞を介した抗原取り込みのメカニズム解明、さらにはF-hiSIEC™と各種免疫細胞との共培養により、M細胞を介した抗原提示や粘膜の免疫応答メカニズム解明等、より高次な免疫反応の理解につながると考えられます。
今後、より多くの皆様にF-hiSIEC™をお使いいただき、腸内細菌およびヒト腸管に関する研究が進展していくことを期待しております。また、FUJIFILMグループでは、細胞製品、試薬、機器等のご提供および研究受託により、皆様の研究をサポートして参ります。
参考文献
- F-hiSIEC™製品HP https://labchem-wako.fujifilm.com/jp/category/02229.html
- Imakura, Y. et al. : Biochem. Biophys. Res. Commun., 692, 149356 (2024).
- 福田真嗣:改訂版 もっとよくわかる! 腸内細菌叢、羊土社(2022).
- Sofi M. H. et al. : JCI Insight, 6 (3), e136841 (2021).
- Sen, A. et al. : Fron™icrobiol., 14, 2023 (2023).




