【総説】改正GMP省令と医薬品品質システムに基づく品質確保への取り組み
本記事は、和光純薬時報 Vol.92 No.1(2024年1月号)において、(元)中外製薬工業株式会社* 生産QA部 今若 太一様
*2006年5月〜2023年12月に執筆いただいたものです。
1.はじめに
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(以下、改正GMP*1省令*2と記載)が令和3年(2021年) 4月28日公布、同8月1日付けで施行された。改正GMP省令では、国際整合、国内制度の整理のもと、品質保証の充実の観点及びグローバルな観点から「患者保護」を第一に、国際的にも通用する製造管理、品質管理として施行されたものである1)(Fig.1)。

今回、改正GMP省令と医薬品品質システムに基づく品質確保への取り組みについて紹介する。
*1:Good Manufacturing Practice 医薬品の製造管理及び品質管理に関する基準
*2:医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令
2.GMP省令の歴史
1963年に米国FDA (Food and Drug Administration:米国食品医薬品局)は薬事関連法規の大幅な改正を行い、その中の一つとして高品質な医薬品を製造するために必要な設備構造、生産管理、品質管理等に関する基準を法制化した。これが世界初のGMP(Good Manufacturing Practice:医薬品の製造管理及び品質管理に関する基準)である。さらに、1969年にはWHOがGMPを制定し、加盟国に対して医薬品貿易においてGMPに基づく証明制度を採用・実施するように勧告した。
日本におけるGMP省令は、今から1972年まで遡る(Table 1)。1972年当時、厚生省薬務局を中心にGMPの制定と実施のための準備が開始された。1974年9月14日に「医薬品の製造及び品質管理に関する基準」が都道府県に通知(局長通知)され、1976年4月から行政指導という形で実施された。1980年9月「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」(医薬品GMP省令)として施行され、その後数回の省令改正を経て、医薬品医療機器等法に基づき厚生労働大臣が定めた省令として現在に至っている2)。
3.GMP省令改正への背景
近年、医薬品業界においてはGMP違反行為に伴う不祥事が相次いでいる。2015年(平成27年)に発覚した国内医薬品製造業者における不正製造問題を契機として、厚生労働大臣による承認を得た全医薬品(32,466品目)について、2016年1月19日付けで医薬品の製造販売承認書どおり製造されていることの一斉点検を指示し、医薬品製造販売業者(646社)が点検を実施した。その結果、医薬品の品質、安全性に影響を与えるような事前承認が必要な相違は認めなかったが、事後届出(軽微変更届出)が必要な相違は479 社22,297品目(全品目の69%)に上った4)。しかし、残念なことに2020年12月に発覚した後発医薬品メーカーによる真菌症の治療薬に睡眠導入剤の成分が混入した不祥事が判明後、各地の製薬メーカーにおいても承認事項を逸脱する違法行為が判明し、行政処分が相次いで出され、医薬品の出荷停止処分による供給問題が社会問題化し、今日に至っている。
以上の状況も踏まえ、令和3年8月1日より法令遵守体制(ガバナンス) (Fig.2) の整備を義務付けた改正医薬品医療機器等法(薬機法)*3が施行された。

改正の背景には近年、上記のような許可等業者による医薬品医療機器等法違反が発生していることが挙げられる。同日付けで施行された改正GMP省令においても、製造所における医薬品品質システムの導入等により、更なる国際整合が図られるとともに、昨今の品質問題の再発防止の要素が随所に盛り込まれた。
*3:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
4.国際標準であるPIC/S GMPガイドラインとの整合化
PIC/S*4は医薬品分野における調和されたGMP基準及び査察当局の品質システムの国際的な開発・実施・保守を目的とした査察当局間の非公式な協力の枠組みであり、1970年10月にその前身であるPIC(Pharmaceutical Inspection Convention:医薬品査察協定)が、EUの枠組みの中での組織として発足後、欧州以外の国の参加が可能となった。PIC/S 発足当初はEUを中心にした18カ国のメンバー構成であったが、その後、北米やアジアなどからの参加機関が増え、2011年には米国FDAも加盟し、2014年7月に日本と韓国が加盟して43カ国、45当局となった5)。現在EU加盟国やアメリカを始め52カ国、58当局がPIC/Sに加盟している6)。
改正GMP省令では、国際整合を図ることも視野に入れられ、平成24年2月1日付け監視指導・麻薬対策課事務連絡「PIC/SのGMPガイドラインを活用する際の考え方について」に基づき、必須部分は法制化された。また、国内GMP要件の国際整合化を目的として、GMP施行通知(「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」;薬食監麻発0830第1号)に追加された「品質リスクマネジメントの活用について」(第3条の4)、「製品品質の照査」(第11条の3)、「参考品等の保管」(第11条)、「安定性モニタリング」(第11条の2、第21条の2)、「原料等の供給者管理」(第11条の4)が今回の改正GMP省令に取り込まれた7)。
以上により、2014年7月のPIC/S加盟からPIC/S GMPとのギャップになっていた項目がこの改正により整合化された。
*4:Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme:医薬品査察協定及び医薬品査察共同スキーム
5.承認事項の遵守
(第3条の2:新設)
2015年(平成27年)に発覚した国内医薬品製造業者の不正製造問題を契機として、製造販売承認書と製造所の製造実態の相違に関する一斉点検が行われたが、厚生労働大臣により製造販売承認を得た医薬品の内、約7割(全品目の69%)において相違が判明した。また、法令上の規定においては、承認事項の変更に伴う薬事手続きは製造販売業者が主体であるものの、製造業者が承認事項を把握し、製造・試験方法の変更による承認事項への影響評価・製造販売業者への連絡が不可欠であるにもかかわらず、それが出来ていなかったことが原因であった。さらに、製造拠点のグローバル化によりサプライチェーンの複雑化が進行している。以上の背景からも今回の改正GMP省令において、『承認事項の遵守』が第3条の2に盛り込まれ、改めて『承認事項の遵守』における"製造業者"の責任ある関与が示された。
もともとGMPへの適合は医薬品の「製造業」の許可要件であったが、2005年(平成17年)改正薬事法施行以降、これまでの「製造承認」から「製造販売承認」への移行に伴い、「製造販売業」は「製造業」に対し、GMP遵守の監督責任を有することになった。すなわち、「製造販売業」は製造所がGMP省令を遵守していなければ、医薬品の製造販売が認められないことを意味している。今回の改正ではさらに、「製造業者-製造販売業者の連携・情報共有」及び「製造販売承認事項の遵守」が盛り込まれ、改めて製造業者の責任ある関与が改正GMP省令において明示された。
6.医薬品品質システム
(PQS*5、ICH*6 Q10)の導入
改正GMP省令では、第3条の3に医薬品品質システム(PQS)が新設された。そもそもPQSとは、ICH Q10では「品質に関して製薬企業を指揮及び管理するマネジメントシステム」、GMP省令第2条では「医薬品に係る製品の製造業者及び法第13条の3第1項に規定する医薬品等外国製造業者が当該製品の品質に関して管理監督を行うためのシステム」と定義され8)、2017年には、PIC/S GMPガイドラインに正式に導入されている。 もともとICH Q10は国際標準化機構(ISO)の品質概念に基づき、適用される製造管理及び品質管理に関する基準(GMP)を包含し、ICH Q8「製剤開発」及びICH Q9「品質リスクマネジメント」を補完する形で成り立っているモデルである9)。すなわちPQSは医薬品の開発プロセスから始まる医薬品ライフサイクル全体を管理することを主眼としており、その根底には品質に対するQuality Cultureの醸成が挙げられる。 医薬品品質システムの目的は、1. 製品実現(顧客の要求事項を満たす適切な品質特性を有する製品の達成)、2. 管理できた状態(ICH Q10におけるState of Control)の確立・維持、 3. 継続的改善(製造工程、製品品質もしくは医薬品品質システムの改善)の 3 点が挙げられる(Fig.3, 4)。

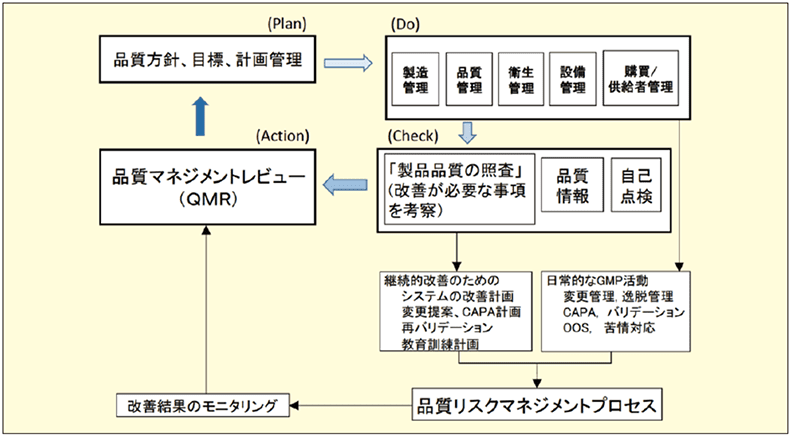
7.Quality Culture醸成の必要性
製薬企業は、生命関連企業として高い倫理観に基づく自律した企業活動が社会から強く求められている一方で、GMPコンプライアンスや製品の安定供給等において、社会からの期待に⼗分に応えているとは言い難い事象・不祥事が昨今続いている。社会からの期待に応えられる企業になるためには、各社の根幹にある企業風土の在り方が重要であり、特に製薬企業の"品質"に関わる企業文化「Quality Culture」について、その醸成と必要性が求められるようになってきた11)。
そもそも、Quality Cultureとは「品質に関わる従業員が共有する信念、価値観、⾏動規範の集合体」であると考えられており、『当たり前のことが出来ている企業は良いカルチャー』と理解すると分かりやすい。GMPに基づく、ソフト面・ハード面がいくら整備されても、医薬品業務に携わる「ひと」の行動規範が伴っていなければ、「患者保護の第一」を確保することは難しい。近年、製薬企業各社がそれぞれ培ってきた企業風土を発展させながら、「Quality Cultureの醸成」活動に取り組んでいる。
8.おわりに
本稿では、簡単ではあるが昨今の医薬品業界の状況と改正GMP省令について紹介してきた。今回の改正GMP省令は前回2004年12月以来の大改正であり、その間に国内環境・国際環境が目まぐるしく変化し、急速なグローバル化が進行する中で、PQSをはじめとした国際標準的な概念が導入されてきた。筆者もこれまで医薬品製造に携わり、長年継続的にGMPをはじめとした医薬品に対する基礎教育・倫理教育を受講のもと、高い倫理観・正義感を持ちながら日々の医薬品業務に取り組んできた。振り返ってみると、欧米は「性悪説」に基づくGMP管理が昔から基本姿勢になっていた。一方、以前の日本はもともと「性善説」を主体とした国民性に基づくGMP体制国であり、その社会環境下において医薬品製造も行われてきた。しかし、近年相次ぐ業界の不祥事や医薬品市場のグローバル化から、「性悪説」に基づくGMP管理が国際標準と化し、近年は無通告査察による当局の調査が行われ、製造業者等における法令の遵守状況、医薬品の製造実態等を効果的に把握し、重大な法令違反や品質不良等の端緒となる情報の検知及び不正行為等の抑止を目的に実施されている。今後、さらなる革新的な医薬品の登場が期待される中で、薬機法・GMP省令が適宜改正されていく。逐次、厚生労働省HP、医薬品医療機器総合機構HPによる当局通知を把握しながら、「患者保護」を第一に医薬品の品質確保に取り組んでいきたいと考える。

参考文献
- 第49回2022年度GMP事例研究会「改正GMP省令について」
https://www.jpma.or.jp/information/quality/jirei/gbkspa00000017ws-att/2022_1.pdf(閲覧日:2023年11月27日) - 今若太一:「医薬品の品質に対する取り組み」,THE CHMICAL TIMES, 255, 3-6 (2020).
https://www.kanto.co.jp/dcms_media/other/CT_255_01.pdf(閲覧日:2023年11月27日) - 第3回医療用医薬品の偽造品流通防止のための施策のあり方に関する検討会 参考資料1
https://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/iryouyouiyakuhinngiouhinnryuutuubousi3-1sannkou.pdf(閲覧日:2023年11月27日) - 医薬品の製造販売承認書と製造実態に関する一斉点検の結果, 平成28年6月1日付け厚生労働省Press Release
https://www.mhlw.go.jp/file/04-Houdouhappyou-11123000-Iyakushokuhinkyoku-Shinsakanrika/0000126270.pdf (閲覧日:2023年11月27日) - 香取典子:「日本のPIC/S加盟と薬事行政へのインパクト」,薬剤学, 74 (6), 414 (2014).
https://www.jstage.jst.go.jp/article/jpstj/74/6/74_414/_pdf/-char/ja (閲覧日:2023年11月27日) - Pharmaceutical Inspection Co-operation Scheme
https://picscheme.org/en/members (閲覧日:2023年11月27日) - 日本製薬団体連合会 品質常任委員会(全体委員会)2022/12/02 特別講演
http://www.fpmaj.gr.jp/committees/Quality/news/documents/202212.pdf (閲覧日:2023年11月27日) - 三嶋克彦:「改正 GMP 省令のポイント」, J. Natl. Inst. Public Health, 71 (2), 147 (2022).
https://www.niph.go.jp/journal/data/71-2/202271020005.pdf (閲覧日:2023年11月27日) - 医薬品品質システムに関するガイドラインについて, 薬食審査発 0219 第1号・薬食監麻発 0219 第1号
https://www.pmda.go.jp/files/000156141.pdf(閲覧日:2023年11月27日) - 医薬品製造所における品質マネジメントシステムの活用及び医薬品品質システムの取り組みに関する研究(2018年度)
https://www.pmda.go.jp/files/000220218.pdf(閲覧日:2023年11月27日) - 2020年GMP事例研究会 製薬協GMP部会におけるクオリティカルチャープロジェクト活動紹介
https://www.jpma.or.jp/information/quality/jirei/pdf/pdf_200909_04.pdf (閲覧日:2023年11月27日)




