【連載】有機分子触媒の軌跡 −基礎から応用まで−「第3回 有機触媒の新たな展開」
本記事は、和光純薬時報 Vol.91 No.1(2023年1月号)において、サイエンスライター 佐藤 健太郎様に執筆いただいたものです。
多くの化学者の努力により、2000年代までに多彩な反応性を持った各種の有機触媒が出揃った。そして有機触媒は、単なる横への広がりだけではなく、新たな可能性の世界へ足を踏み入れ始める。酸化剤や金属触媒、光触媒などとの組み合わせにより、今までにない反応を開拓する試みだ。
酸化剤との組み合わせ
金属酸化物などの酸化剤と、各種の再酸化剤を組み合わせることで、高価あるいは危険性の高い酸化剤の試薬を触媒量に減らすアプローチは、古くから行われてきた。実験室で常用される、酸化オスミウム(Ⅷ)とN-メチルモルホリン-N-オキシドの組み合わせなどはその一例だ。
高度にデザインされた有機触媒に、酸化剤を組み合わせる例も多く現れた。史一安らが開発した、糖由来のケトンを触媒として用いる不斉エポキシ化反応などはその一例だ(本連載第2回で紹介)。
2, 2, 6, 6-テトラメチルピペリジン- N-オキシド(TEMPO)(1)も、各種酸化剤との組み合わせでよく一級アルコールの酸化に用いられてきた。岩渕らがこのTEMPOを改良することで創り出されたAZADOシリーズも、いわゆる有機触媒の範疇に入れられるだろう1)。AZADOL®(2)と次亜塩素酸ナトリウムの組み合わせは、TEMPO酸化の20倍以上の触媒活性を示し、二級アルコールの酸化も可能だ。より立体障害の小さいnor-AZADO(3)は、空気を再酸化剤としても反応が進行する。アルコールからカルボニルへの酸化反応は、すでに多くの試薬が存在する激戦区だが、今やAZADOシリーズはその中で確固たる地位を築いている。
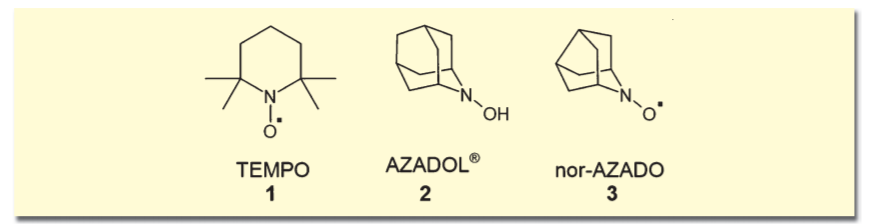
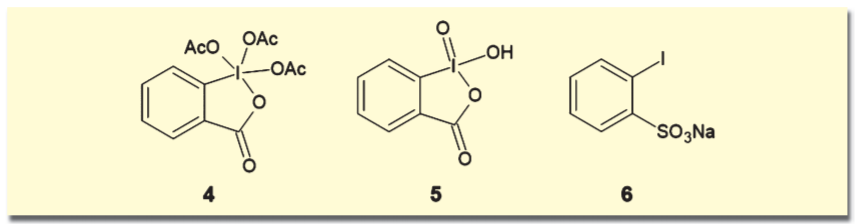
Dess-Martin試薬(4)、2-ヨードキシ安息香酸(IBX, 5)などの超原子価ヨウ素化合物も、古くからアルコール類の酸化などに用いられてきた。ただしこれらは当量以上用いる必要があり、潜在的な爆発性が指摘されているものもある。石原らは、触媒量の2-ヨードベンゼンスルホン酸ナトリウム(6)に、再酸化剤としてOXONEを加えることで、アルコールの酸化が行えることを示した。OXONEの量を加減することで生成物が変化するなどの特徴がある。これについて詳細は、siyaku blog「【特別講座】酸化触媒の最近の進展」の記事をご覧いただきたい。
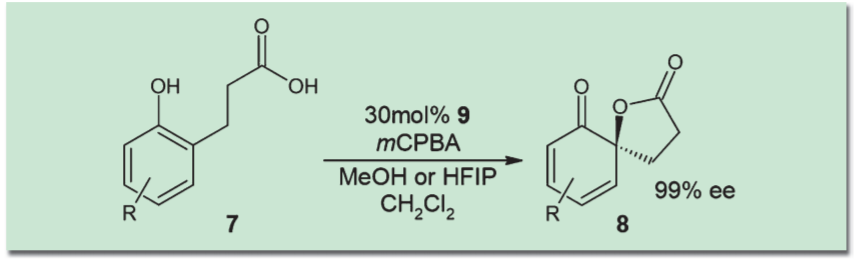
石原らは、フェノール誘導体に対してこれら超原子価ヨウ素化合物を作用させると、脱芳香化を伴ってスピロラクトンが形成されることを見出した。さらに、図のようにデザインされたヨウ素化合物(9)を用いることで、高いエナンチオ選択性のもとスピロラクトンが得られることを示している2)。
金属触媒との組み合わせ
有機触媒は、一般に遷移金属触媒に比べて反応性が低い。このため、有機触媒は添加量を多く必要とし、長い反応時間を要するなどの欠点がある。しかしこの反応性の低さは、裏を返せば長所ともなりうる。反応系中に他の物質が入っていても、妨害を受けることなく反応が進行しうる点だ。
この性質を活用し、有機触媒と遷移金属触媒を同時に使用する手法が検討された。同時使用といっても、大きく分けて2つのタイプがある。有機触媒と遷移金属触媒が協働して一つの反応を起こすタイプと、それぞれの触媒が別々に働き、基質分子を連続的に変換するタイプだ。ただし、両者を明確に区分することは難しい。
前者の協働型タイプの例としては、林-Jørgensen触媒(13)とパラジウム触媒を用いた、アルデヒドのα位アリル化反応がある3)。林-Jørgensen触媒の二級アミン部分がアルデヒド(11)とエナミンを形成して活性化し、アリルエステル(10)とパラジウム触媒から生じるπ-アリルパラジウムと反応するというメカニズムだ。
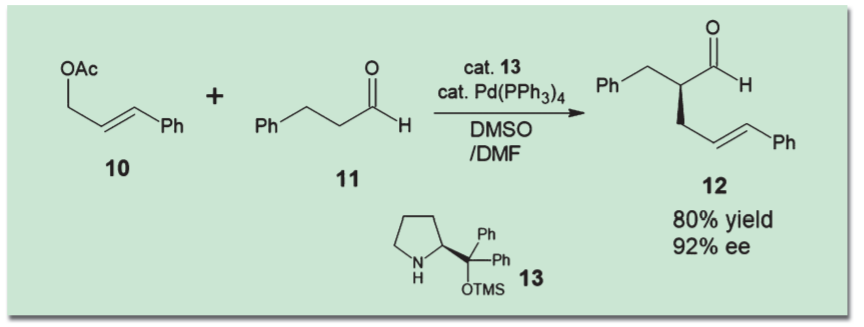
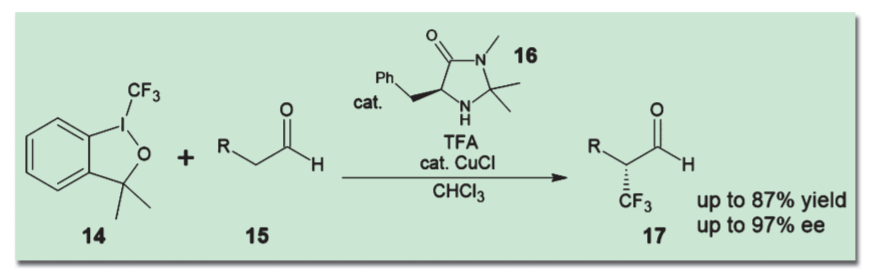
ただしこの反応では、パラジウムとアミンが錯形成して反応を妨げる可能性がある。このため、溶媒や反応温度の調整をうまく行わないと高収率・高選択性は実現できない。このように、複数の触媒をうまく協働させるには、反応条件の検討や触媒設計が重要であることが多い。 二級アミン型有機触媒でアルデヒドをエナミン型として活性化させ、遷移金属触媒と組み合わせる手法は広く研究され、さまざまなバリエーションが生まれている。たとえばMacMillanらは、Togni試薬(14)を銅(Ⅰ)イオンで活性化し、エナミンと反応させることにより、アルデヒドα位の不斉トリフルオロメチル化を達成している4)。
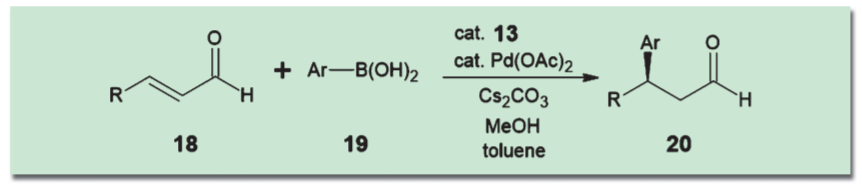
一方、α,β-不飽和カルボニル化合物に対して不斉な二級アミン型の有機触媒を作用させることで活性化を行い、遷移金属触媒を用いた共役付加を行うアプローチも優れた成果を収めている。たとえばCórdovaらは、パラジウム触媒と林-Jørgensen触媒(13)の組み合わせにより、α,β-不飽和アルデヒドのβ位にアリール基を高い不斉収率で導入する反応を報告している5)。
不斉相間移動触媒と遷移金属触媒の組み合わせ、不斉ブレンステッド酸と遷移金属触媒の組み合わせも、数多く研究されている。また、こうしたアプローチを分子内反応に適用して複雑な多環状骨格を構築するなど、多くの応用がなされている。これらは総説や成書にまとめられているので、参考にされたい6)。
光触媒との組み合わせ
有機触媒の開祖であるBenjamin Listと並んで2021年ノーベル化学賞を受賞したのは、David MacMillanであった。彼は有機触媒と一電子酸化を組み合わせるという発想から新たな領域を切り拓き、2010年代の有機化学をリードする存在となった。
きっかけになったのは、2007年にScience誌に発表された論文だ7)。MacMillanらは、二級アミン型触媒とアルデヒドから発生させたエナミンを、硝酸アンモニウムセリウム(Ⅳ)(CAN)で一電子酸化することでラジカルカチオン種を発生させ、これをアリルシランと反応させることで付加体を得ることに成功した。
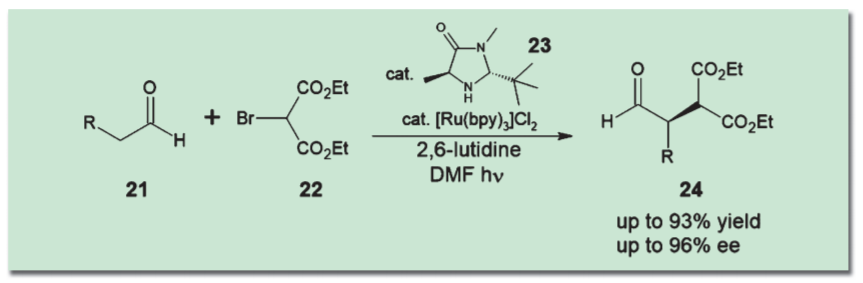
翌2008年、MacMillanらはさらに一歩を進め、CANの代わりにルテニウム錯体と可視光の組み合わせを用いる手法を編み出した。Ru(bpy)3などの錯体は、可視光のエネルギーで励起され、系内の化合物から一電子を奪って酸化する作用を持つ。これを用い、まずアルデヒドのα位をアルキル化する反応が報告された8)。その後もMacMillanはこの手法を拡大し、さまざまな求核剤との反応を開拓してゆく9)。
光レドックス反応と呼ばれることになったこの手法は、有機合成分野に大きな新しい可能性をもたらした9)。CANなどの一電子酸化剤と異なり、系中で還元剤と共存可能であるため、扱える試薬の幅が大きく広がる。また、光のエネルギーを系外から与えられるため、エネルギー的に不利な反応が実現できることも大きい。潜在的な危険のある酸化剤を用いずに済むことも、実用的な面からは無視できないメリットだ。こうして多くの有機化学の研究室がこれに取り組んだため、あちこちのドラフトがLEDの光で青く染まるという、以前には見られなかった現象が起きることとなった。
有機触媒の研究から派生する形で発見された光レドックス反応だが、MacMillan自身は有機触媒からこちらの研究に軸足を移してゆき、それまでになかった多くの変換反応を達成する。すると、これを有機触媒と絡めて、エナンチオ選択的な反応を創り出す動きが出てきた。
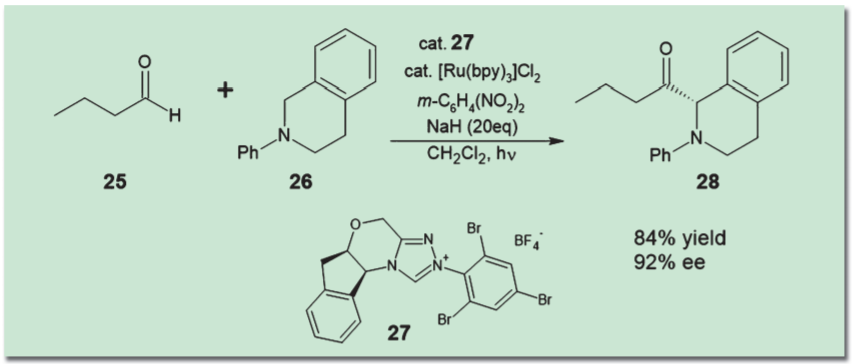
たとえば、光レドックス触媒によってアミンを酸化してイミニウムカチオンを発生させ、ここに求核剤を作用させることでアミンのα位を官能基化する反応が開発された。すると、ここにN-ヘテロサイクリックカルベン(NHC)触媒やチオウレア触媒を同時に作用させることで、不斉アシル化反応などが実現されている10)。
このような例を見てくると、有機触媒の真価はその特有の柔軟性にあると思えてくる。多くの試薬や反応条件と共存可能な有機触媒の懐の深さを見れば、今後もさらに多くの応用が生まれてくることは疑いないだろう。
参考文献
- Iwabuchi, Y. : Chem. Pharm. Bull., 61, 1197 (2013).
- Uyanik, M. et al. : Angew. Chem. Int. Ed., 52, 9215 (2013).
- Afewerki, S. et al . : Chem. Eur. J., 18, 2972 (2012).
- Allen, A. E. and MacMillan, D. W. C. : J. Am. Chem. Soc., 132, 4986 (2010).
- Afewerki, S. et al . : Chem. Eur. J., 17, 8784 (2011).
- Du, Z. and Shao, Z. : Chem. Soc. Rev., 42, 1337 (2013).
Chen, D. F. et al . : Acc. Chem. Res., 47, 2365(2014).
Chakraborty, N. et al . : Eur. J. Org. Chem., 2022, 20 (2022).
Arndtsen, B. A. and Gong, L. : "Asymmetric Organocatalysis Combined with Metal Catalysis", Springer Nature. - Beeson, T. D. et al . : Science, 316, 582 (2007).
- Nicewicz, D. A. and MacMillan, D. W. C. : Science, 322, 77 (2008).
- Shaw, M. H. et al. : J. Org. Chem., 81, 6898 (2016).
- DiRocco, D. A. and Rovis, T. : J. Am. Chem. Soc., 134, 8094 (2012).




