【総説】新規核酸誘導体コアクロル(COA-Cl)の生理活性 ―神経細胞保護効果を持つxeno free栄養因⼦―
本記事は、和光純薬時報 Vol.89 No.3(2021年7月号)において、香川大学医学部 薬物生体情報学講座 塚本 郁子様に執筆いただいたものです。
はじめに
コアクロル(COA-Cl)は筆者の研究グループが新規合成し、2010年より「2Cl-C. OXT-A」の名称で販売されている化合物である。当時は血管新生を促進する画期的な低分子として上市されたが、その後の研究で神経細胞に対する保護栄養効果の他、様々な生理活性が明らかになった。このたび、試薬名をコアクロルと改名してリニューアル販売をしていただくにあたり、新しい知見を紹介したい。
コアクロルの構造
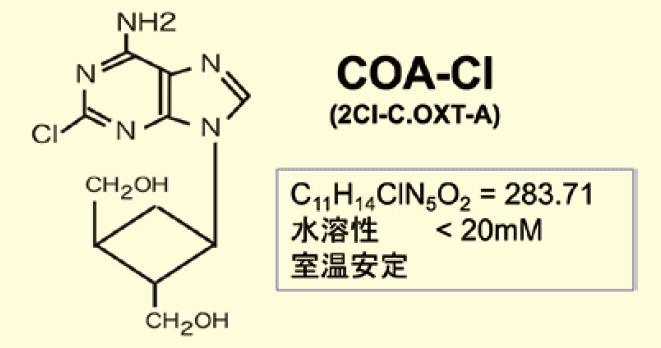
図1.コアクロル(COA-Cl)の構造
コアクロルは徳島文理大学香川薬学部で合成された新規化合物である。これは微生物から単離された抗ウィルス活性を持つ核酸誘導体 Oxetanocin Aをベースに、そのオキセタン環(C-CC-Oの環状エーテル)をシクロブタン環(Carbo Oxethane)に置き換え、アデニン塩基にClを付加した構造を持つ(図1)。
旧称の2Cl-C. OXT-Aは2位の塩素、炭素化オキセタン環(Carbo Oxetane)、結合塩基の種類(Adenine)を表していた。コアクロルとはこの旧称を短縮した名称である。コアクロルについて最初に発見した生理活性は血管新生促進作用であった。構造活性相関を調べるために数10種類に及ぶコアクロル誘導体について血管新生作用を調べたが、これまでのところ最も活性が高いのがこのコアクロルである。
血管新生作用
血管新生促進作用は血管内皮細胞HUVECと線維芽細胞NHDFを用いた共培養系における管腔形成実験、ニワトリ漿尿膜やウサギ角膜を用いるin vivo実験で確認してきた1)。HUVECは単培養しても管腔を形成しないが、共培養するとNHDFから分泌される血管内皮細胞増殖因子(VEGF)のシグナルをうけて管腔形成を開始する(図2)。
ところがコアクロルはHUVECにおいてVEGF受容体の活性には直接の影響を示さない2)。そこで筆者らはVEGFとは別の血管新生促進因子であるスフィンゴシン1リン酸(S1P)に注目し、siRNAや各種の阻害剤を用い検討した。コアクロルはS1P1受容体を介してMAPキナーゼを活性化し、HUVECの管腔形成を促進していることが明らかとなった2)。

図2.COA-Cl によるHUVEC の管腔形成の促進
HUVECに対する作用の一方で、NHDFにコアクロルを添加するとVEGF分泌が促進された( 図3a)。VEGF遺伝子発現を促進させる細胞内情報伝達経路としては、低酸素によって誘導される転写因子HIF-1αを介したものと、代謝に関連した転写補助因子であるPGC-1α(PPARγcoactivator 1α)を介したものが知られている(Nature, 451, 1008 (2008) )。
NHDFにおいてコアクロルはHIF-1αに有意な変化をもたらさなかったが、PGC-1αを遺伝子・タンパク質レベルで誘導した(図3b)。さらにcAMPの濃度上昇、CREBのリン酸化の亢進も誘発したことからNHDFにおけるコアクロルのVEGF亢進作用は低酸素で増強されるもののHIF-1αではなく、PGC-1αを介するpathwayの活性化によってもたらされていると考えられた3)。従って、コアクロルの血管新生促進作用には血管内皮細胞のS1P1受容体を介する作用と、NHDF等周辺細胞からのVEGF分泌を亢進する作用の双方が貢献すると考えられる。
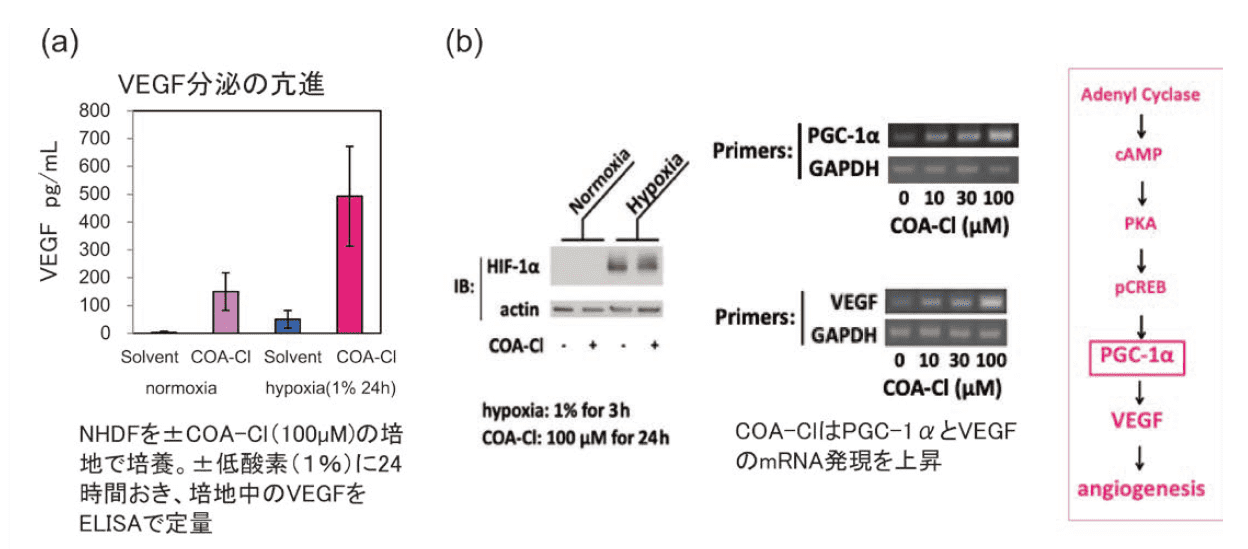
図3.COA-Cl によるVEGF の亢進
神経細胞に対する保護栄養効果
コアクロルにはMAPキナーゼの活性化作用が確認されていたので、神経細胞に対しては突起伸長作用が期待できた。神経モデル細胞PC12を用いて検証したところ、ERK1/2の活性化と突起伸長効果が確認できた(図4a)。
また、細胞を低酸素や低栄養(glucose free)といったストレスに曝して細胞障害性のマーカーであるLDH活性を測定したところ、ストレス前の投与だけでなくストレス後の投与でも変わりない保護効果が確認できた(図4b)。
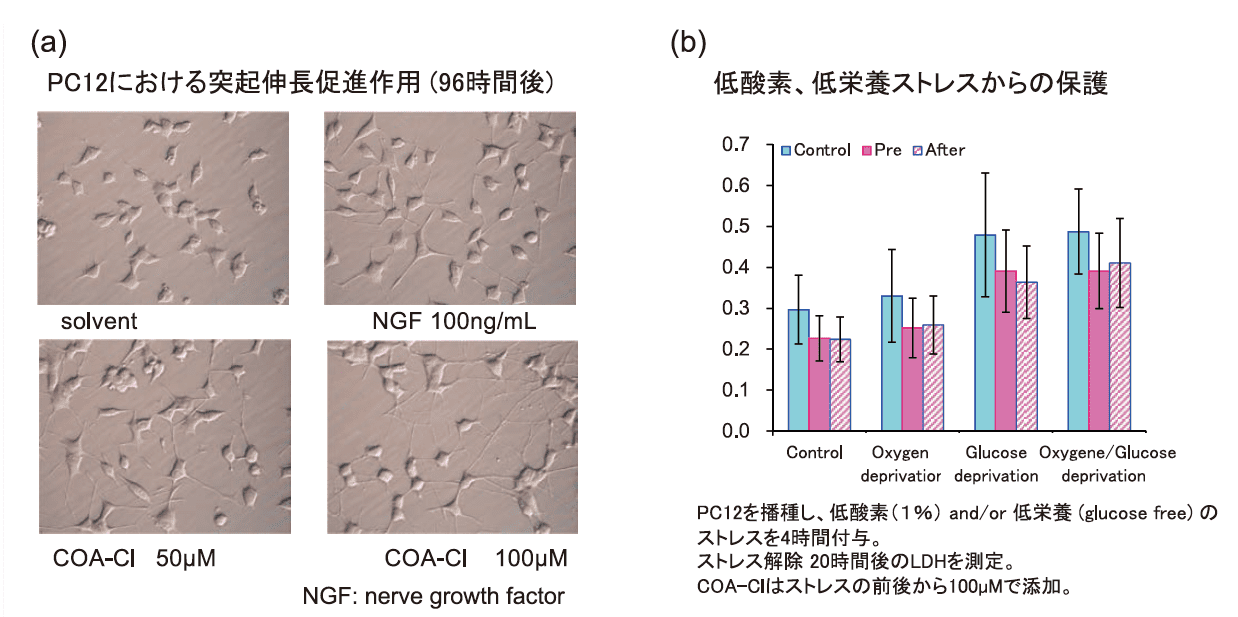
図4.COA-Cl による神経細胞保護栄養効果
この、ストレス後の投与でも有効であったという結果は、例えば脳梗塞などの虚血性障害の発生後に投薬しても効果が期待できるということであり、創薬シーズとしても有望と思われる。さらに、無血清ストレスに対する保護作用が認められた(図5)他、過酸化物によるストレスに対しても保護作用(細胞生存率の温存、アポトーシスの軽減)が確認できた。現在目覚ましい発展途上にある再生医療の現場では、その細胞培養過程においてxeno free素材が求められている。コアクロルは常温安定な低分子でありながら、代替血清やxeno free栄養因子としての活躍が期待できる画期的な物質である。

図5.無血清ストレスからの保護作用
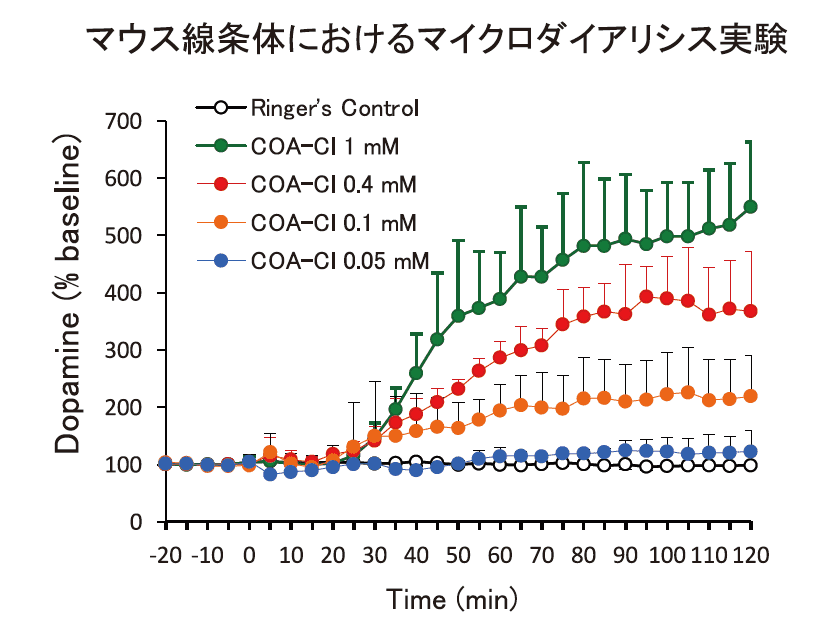
図6.COA-Cl によるドパミン分泌亢進作用
コアクロルはPC12においてERK1/2だけでなく、チロシンハイドロキシラーゼ(TH)の活性化も誘導した。THはカテコールアミン生合成の律速酵素であり、実際に培地中のドパミン濃度が上昇することも確かめた。またマウスの脳内(線条体)にマイクロダイアリシスプローブを留置し、コアクロルを含むリンゲル液を還流して脳脊髄液を含む回収液中のドパミンを定量したところ、図6に示すように濃度依存的なドパミンの上昇が明らかになった4)。ドパミンはパーキンソン病を始めとする種々の神経変性疾患と深い関わりを持つ。神経変性疾患には有効な治療薬が少ないのが現状であるが、コアクロルはここでも活躍が期待できる。
病態モデル動物実験
血管新生作用、神経保護栄養効果は侵襲を受けた生体にとって大切な作用である。そこで病態モデル動物についてコアクロルの効果を検討した。脳虚血、脳出血モデルラットや心虚血モデルマウスにおいて、障害発生後のコアクロル投与が損傷体積を縮小し予後を改善することを確かめた5-7)。さらにアルツハイマーモデルマウスの記憶学習にも改善効果があることを報告している8)。
コアクロルの可能性
以上のようにコアクロルは様々な生理活性を有しており、創薬シーズや再生医療におけるxeno free栄養因子としての応用が期待される。また、今回は紹介しきれなかったが、組織の線維化に関与する結合組織成長因子(CTGF)の抑制作用も見つかっており、TGFβ1が誘発する組織の線維化や上皮間葉転換(EMT)を抑制できることも報告している9, 10)。
現在、COVID-19や鳥インフルエンザ、エボラ出血熱などのウィルス疾患が大きな社会問題を引き起こしているが、そもそもコアクロルは抗ウィルス薬の誘導体である。これらのウィルスに対して抗ウィルス活性を有するかどうかについては大変興味の持たれるところである。室温安定な水溶性低分子という性質は創薬上の大きなアドバンテージでもある。今回のリニューアル販売を機にさらなる研究が進み、人類の健康に資することができるようにと願ってやまない。
謝辞
コアクロルの研究は徳島文理大学香川薬学部の丸山徳見先生と榊原紀和先生による新規合成から始まった。それに続く広範な研究は引用文献記載の共同研究者の方々の協力なしには成すことができなかった。この場を借りて、心から御礼申し上げます。
キーワード
xeno free(ゼノフリー)
非ヒト由来成分を含まないこと。細胞の培養環境を説明するときなどに使われることが多い。再生医療に用いられるヒト細胞加工製品を製造する際にはゼノフリー培養環境のほうが望ましいとされており、FBS などの動物由来栄養因子を使わない培養試薬の開発が求められている。
参考文献
- Tsukamoto, I. et al. : Biochem. Biophys. Res. Commun., 399, 699 (2010). DOI: 10.1016/j.bbrc.2010.08.003
- Igarashi, J. et al. : Pharma. Res. Per., 2, e00068 (2014). DOI: 10.1002/prp2.68
- Jamal, M. et al. : Brain Res., 1706, 68 (2019). DOI: 10.1016/j.brainres.2018.10.026
- Okabe, N. et al. : Brain Res., 1506, 115 (2013). DOI: 10.1016/j.brainres.2013.02.009
- Lu, F. et al. : J. Stroke Cerebrovasc. Dis., 25, 2637 (2016). DOI: 10.1016/j.jstrokecerebrovasdis.2016.07.006
- Nishikido, T. et al. : Sci. Rep., 9, 2533 (2019). DOI: 10.1038/s41598-019-39222-1
- Kishimoto, Y. et al. : Data Brief, 20, 1877 (2018). doi: 10.1016/j.dib.2018.09.044
- Kawami, M. et al. : Drug Methab. Pharmacokinet., 32, 224 (2017). DOI: 10.1016/j.dmpk.2017.05.001
- Nakai, K. et al. : J. Dermatol. Sci., 94, 205 (2019). DOI: 10.1016/j.jdermsci.2019.02.003
- 榊原紀和 他:BIO Clinica, 33, 39 (2018).




