【総説】中性付近のpHで抗体を効率的に吸着/精製する担体の開発
本記事は、国立研究開発法人 産業技術総合研究所 日本特殊陶業ー産総研ヘルスケア・マテリアル連携研究ラボ 加藤 且也様、日本特殊陶業株式会社 研究開発本部 北村 昌大様に執筆いただいたものです。
はじめに
血清や細胞培養上清中に存在する抗体、特にイムノグロブリンG (IgG) を精製する場合には、通常IgGのFc領域と強い相互作用を持つプロテインAの結合したアフィニティークロマトグラフィー担体が用いられている。しかし抗体の回収時に用いるpH 2~4 の酸性溶液が、回収後の抗体の凝集や変性を引き起こす原因ともなり、重要な活性を持つ抗体を取得できない場合がある。そのために、抗体回収溶液として酸性溶液を用いず、かつより安価で精製できる担体の開発が急務となっている。
今回、抗体を簡便かつ低コストで分離・精製する多孔質ジルコニア担体を開発した。今回の担体を使用することで、数倍に希釈した血清や細胞培養液から、吸着および洗浄、回収の3ステップを行うのみで、高純度なIgGやIgMを取得することができた1)。そのため、本ジルコニア担体は、様々な種類の抗体を簡便に精製する担体として、今後広く活用されることが期待される。
抗体精製におけるクロマトグラフィー担体の課題
近年、抗体医薬品は日本のバイオ医薬品市場の約6 割を占め、現在も、いくつもの抗体が新薬として上市されている。また抗体は医薬品としてのみならず、臨床診断用試験キットやバイオセンサーなどへの利用も活発化しており、抗体の産業利用はますます拡大している。主に血清中や細胞培養上清中に存在する抗体、特にIgGを精製するためには、IgG分子中のFc領域と呼ばれる部位に強い親和性を持つプロテインAあるいはプロテインGとの親和性結合を利用したアフィニティークロマトグラフィーが利用されている。通常、プロテインA/Gをセラミックスやポリマー表面に固定化させた担体が、IgG精製用粒子として市販されている。
しかし、精製段階で抗体をプロテインA/G担体から回収する際、その強固な結合を乖離させるために、高濃度のアミノ酸を含む酸性条件下でクロマトを行う必要があること、その際に回収した抗体が凝集や変性を起こし、抗体活性を大きく低下させる事例が知られている。またプロテインA/G自身もタンパク質であるために、大量の抗体を精製するためには、精製担体が非常に高コストになることなどが課題となっている。
これらの問題を解決する手段として、プロテインAの遺伝子改変を行い、抗体との親和性を変化させることで温和な回収条件を実現する改変プロテインAや、抗体との結合性を示す有機リガンドを担体表面にコーティングする非含有プロテインA型担体などが報告されている。しかし上述の課題解決には至っていない。
抗体を変性させることなく、可能な限り簡単に、かつ低コストで精製可能な新たなクロマトグラフィー担体が求められていた。
新規な抗体精製用担体の目標値
今回、プロテインAやプロテインGを使用せず、セラミックス粒子を用いて簡便に抗体を精製できるクロマトグラフィー用担体の開発に取り組んだ。開発担体の数値目標は、①セラミックス粒子が持つ抗体への選択的吸着能が高い、つまり血清や培養液中に存在するアルブミンなどの來雑タンパク質などへは低吸着性を示すが、IgG結合容量は市販のプロテインA担体と同等(50 mg/mL程度)であること、②精製抗体の凝集を抑えるため、中性付近の緩衝液(pH 6~8)で活性を保持した状態で抗体を回収できること、以上の2点である。
血清や培養細胞上清からの抗体精製用担体の開発

図1.作製した多孔質ジルコニア粒子の電子顕微鏡写真
ジルコニア粉体からスプレードライ法により、直径50 μm程度の球状粒子を得た (図1)。電子顕微鏡観察から、20~50 nmの一次粒子が凝集する構造体であることが分かる。
次にジルコニアおよびタンパク質の両方に強い静電的相互作用を持つことが知られているリン酸有機物:ethylenediaminetetra (methylene phosphonic acid) で、粒子表面をコーティングすることで、タンパク質吸着用サンプルとした。まず、血清中に含まれる主要な3種類のタンパク質である、IgG, アルブミン, トランスフェリンを用いた吸着実験を行ったところ、IgGのみが非常に高い吸着量を示すことが分かった (図2A)。
その際、担体への吸着用緩衝液として、10mMリン酸緩衝液 (pH7) を利用することで、IgGへの選択的吸着性も大きく向上した1)。さらにIgGの粒子表面への吸着力を弱めるために、100mMリン酸緩衝液 (pH8) で担体を洗浄することで、吸着したIgGを全量回収した。以上の方法を応用して、5倍に希釈したヤギ血清から、吸着⇒洗浄⇒回収の簡単なバッチ方式で、高純度なIgGを得ることができた (図2B及び 図3)。
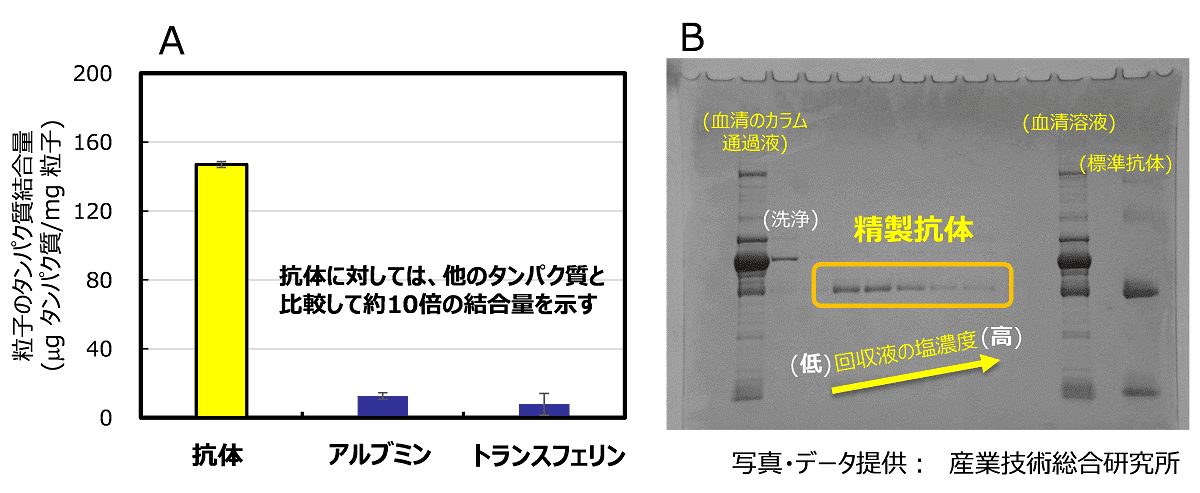
図2.ジルコニア粒子によるタンパク質吸着特性(A)とヤギ血清から抗体(IgG)を分離精製した電気泳動像(B)
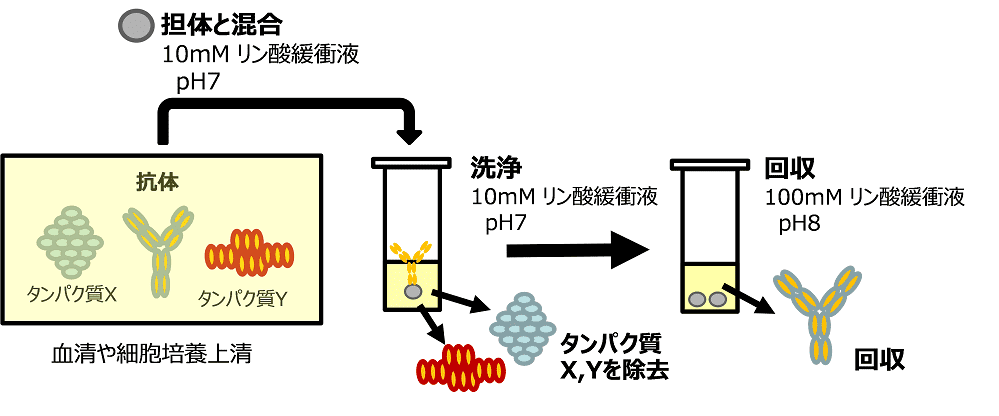
図3.バッチ方式による抗体精製の概略図
次に、アミノ酸やペプチド、IgGやIgMなどの分子を用いた、リン酸基修飾をされたジルコニア粒子への吸着メカニズム検討から、塩基性アミノ酸に対して粒子表面が強い相互作用を持ち、抗体のFab領域に存在する塩基性アミノ酸の数により、吸着強度が変化することも明らかになった2)。この結果から、本担体は、IgGのみならず、IgMやその他の抗体の精製にも応用可能であることが予測された。そのため、細胞培養液中に発現させたIgM分子を、上述の精製方法により、抗原との結合活性を維持した状態で高純度なIgMを取得することができた3)。
まとめ
今回開発した担体は以下3つの特徴をもつ。
- 中性付近のpHで担体から抗体を担溶出させるため、"抗体の凝集・変性"を低減
- 抗体のFab領域を介した吸着のため、IgGに限らずIgMへも適用可能
- セラミックスが主材料でプロテインA等のタンパク質は不使用なため、低コスト
今後は、IgGやIgM以外の抗体や、抗体以外のタンパク質への精製に活用できるよう、さらなる検証を進める予定である。
参考文献
- 加藤 且也・北村 昌大・永田 夫久江・李 誠鎬・奥田 徹哉・平野 篤・笠原 真二郎, 抗体医薬製造のコスト低減に向けて ─ 多孔質ジルコニアによる簡便な抗体精製法の開発─, セラミックス, 56, 4, 224-227 (2021).
- A, Hirano., M, Wada., M, Kitamura., S, Kasahara. and K, Kato. : Interactions between amino acids and zirconia modified with ethylenediaminetetra(methylenephosphonic acid): mechanistic insights into the selective binding of antibodies, Langmuir, 37, 1605-1612 (2021). DOI: 10.1021/acs.langmuir.0c03471
- T, Okuda., K, Kato., M, Kitamura. and S, Kasahara. : Purification of anti‑glycoconjugate monoclonal antibodies using newly developed porous zirconia particles, Sci. Rep., 11, 3233 (2021). DOI: 10.1038/s41598-021-82457-0
キーワード
ジルコニア
ジルコニア(ZrO2)は 、ジルコニウム(Zr)の酸化物である。融点は、2700 ℃と高い(シリカSiO2の場合、1710 ℃)ために、耐熱性セラミックスとして盛んに利用されている。またイットリウムのような希土類を固溶させた安定化ジルコニアは、通常のジルコニアと比較して、強度や靭性など機械的強度が優れているため、エネルギーや環境、ヘルスケア分野などへの応用も進められている。




