【クロマトQ&A】解離しやすい官能基を持つ試料の保持を調節する方法は
本記事は、Analytical Circle No.12(1999年3月号)に掲載されたものです。
HPLCの移動相条件を検討しています。解離しやすい官能基を持つ試料の保持を調節する方法を教えて下さい。
溶質(試料)の溶出挙動に影響を与える移動相の要素として、極性,pHなどがあげられます。前回のQ&Aに引き続き、今回は解離しやすい官能基を持つ試料という事で、pHの影響についてみてみたいと思います。
移動相として極性の大きい水系溶媒を用い、解離しやすい官能基を持った試料成分、特に弱酸性,弱塩基性の成分を分離する場合、溶媒の極性よりも水素イオン濃度やイオン強度が分離に大きな影響を与えます。それはこれらの成分のイオン化の程度が移動相のpHによって異なり、k'値が大きく変化するためです。
表1 pHと解離しやすい化合物の保持との関係
| pH | 塩基性の官能基 を持つ成分 |
酸性の官能基 を持つ成分 |
|---|---|---|
| 低くなる | 保持小 | 保持大 |
| 高くなる | 保持大 | 保持小 |
例えば、逆相系分配クロマトグラフィーの場合、移動相のpHが低くなると、塩基性の官能基を持つ成分の解離は進み固定相への親和性は弱まるためk'は小さくなり、酸性の官能基を持つ成分は解離が抑制され固定相への親和性が強くなるためk'は大きくなります。逆に移動相のpHが高くなると、塩基性の官能基を持つ成分の解離が抑制され固定相への親和性は強くなるためk'は大きくなり、酸性の官能基を持つ成分の解離は進み固定相への親和性が弱まるためk'は小さくなります(表1)。
すなわち、逆相系で酸性の官能基を持つ物質を分析するのであれば、より強い酸を加えpHを下げてイオンの解離を抑え、また塩基性の官能基を持つ物質であれば、より強いアルカリを加えてpHを高くして解離を抑制して保持させる方法を取ります(イオン抑制法)。
今、有機酸AHについて
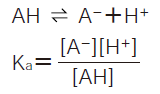
の解離平衡が成り立っている時、k'は次式で与えられます。
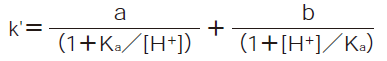
a,bは定数で、非解離型または解離型の成分の濃度が0になった時のk'の値に相当します。
有機酸のpKaを5.0とした時のpHとk'の関係を図1注)に示します。この関係より、pHがpKa値に等しくなる付近でk'が急激に変化しているのがわかります。
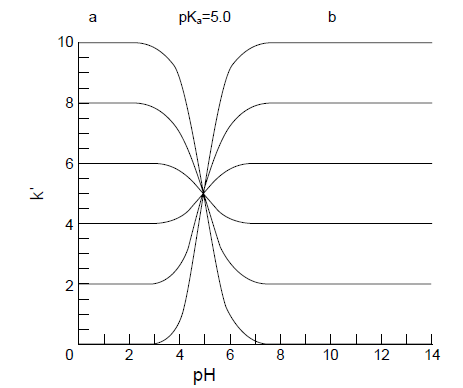
図1 pHとk'の関係
pKa=5.0の解離性成分について非解離と完全解離状態のk'に対応するa,bの値を0,2,4,6,8,10としたときの曲線イオン抑制法以外に解離しやすい官能基を持つ試料の保持を調節する方法としてイオン対クロマトグラフィー法(イオン対法)があります。
図2に逆相系イオン対法による分離の模式図を示します。水性の移動相溶媒中でイオン性またはイオン化しうる溶質に適当な対イオンを加えると、イオン性試料A-H+はイオン対試薬B+OH-とイオン対B+A-を生成します。このイオン対BAは電荷を持たないので逆相系の化学結合型固定相に保持され、普通の有機化合物同様に分離されます。イオン対の保持は、対イオンの種類と濃度、移動相のpHにより調節します。
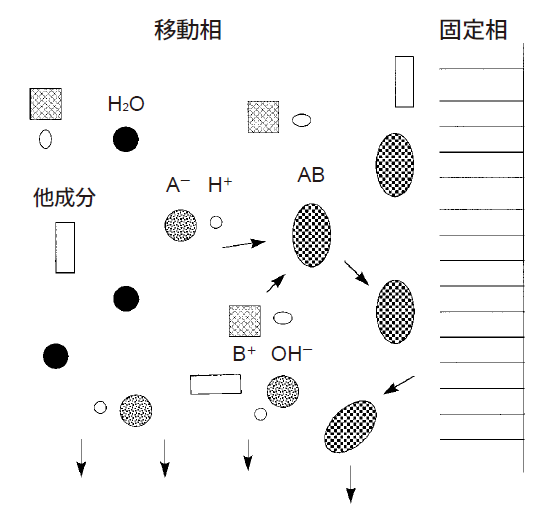
図2 逆相系イオン対法による分離の模式図
イオン対試薬としては、酸性の官能基を持つ成分に対しては第4級アルキルアンモニウム塩,第3級アミンなどが、塩基性の官能基を持つ成分に対してはアルキルスルホン酸塩,過塩素酸,アルキル硫酸などが用いられます。対イオンの使用濃度範囲は、通常0.001~0.1 Mで、対イオン濃度が高いほど保持は大きくなります。
以上まとめますと、
- 個々の成分の保持時間とpHとの関係から最適なpHを求める。
- pH変化だけでは試料成分の解離が抑制出来ない酸性イオン成分や塩基性イオン成分を分離する場合など、必要ならば対イオンを添加してイオン対法で分離する。
のが一般的です。なお、イオン抑制法,イオン対法いずれの場合も担体の使用可能pH範囲に充分注意して下さい。
参考文献
注): 日本分析化学会関東支部編:「高速液体クロマトグラフィーハンドブック」(丸善)、(1985)




