【特別講座】白金族触媒を用いた H-D 交換反応の開発
本記事は、Organic Square Vol.17(2006年10月号)において、和光純薬工業株式会社 化成品研究所 主任 伊藤 伸浩が執筆したものです。

重水素標識化合物は構造解析や有機反応機構の解明に利用できるため、様々な研究分野でその有用性が認められている。1)特に GC-MS を用いた同位体希釈質量分析法は薬物代謝の研究、食品中の残留農薬や内分泌攪乱物質(環境ホルモン)等の検出に極めて優れた方法であり、その内部標準物質として分析対象化合物の重水素標識体を用いるのが理想とされている。
また最近では重水素化ポリマーが光学材料として注目されている。これは C-H 結合を C-D 結合に変えることで、C-H 結合に由来する赤外吸収振動、および近赤外から可視光域におけるその倍音吸収振動を低減させ、ポリマーの透明性を高めることにより光学損失を低減できるためである。
このように様々な用途が期待される重水素化合物であるが、市販の重水素化合物は高価であり、品揃えも限られている。ところが、H-D 交換反応に関してはこれまでに様々な手法が報告されているものの、過酷な条件や高価な重水素ガス、特殊な装置を必要とするとともに、D 化効率が低いといった問題点を有していた。2)
そこで岐阜薬大の佐治木教授が開発した重水を重水素源とする H-D 交換反応に注目し、佐治木教授との共同研究により、低コストで簡便な新規ラベル化法を開発した。
Pd/C を用いたベンジル位選択的および不活性メチレンの重水素化 3, 4)
佐治木教授らは重水中、少量の水素存在下、Pd/C を触媒として室温で反応させると、ベンジル位に選択的に H-D 交換反応が起こることを見出した。また加熱条件で反応させると、不活性であると考えられるベンジル位以外のアルキル炭素上でも H-D 交換が効率的に進行し、重水素化率が反応温度依存的に向上することを明らかにしている(Scheme 1)。本反応は最も安価な重水を重水素源として用い、触媒量の水素を必要とし、中性条件下で反応が進行するといった特徴を有する。
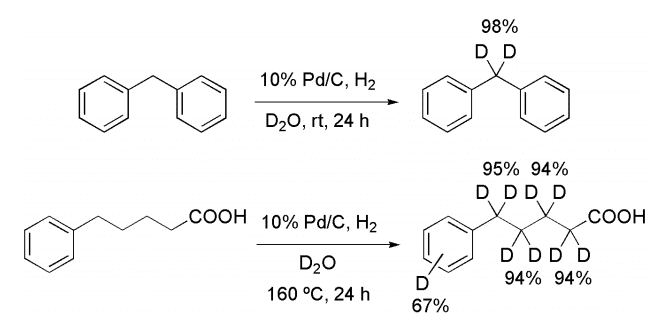
Scheme 1
Pd/C を用いた複素環化合物の重水素化
医薬品をはじめとする生物活性物質の多くは複素環、芳香環を有することから、これらを効率良く重水素化できれば重水素化ビルディングブロックとしての用途が期待できる。そこで複素環化合物の重水素化を試みた。Pd/C を触媒として用いるとイミダゾールやピリジン等の誘導体で効率良く H-D 交換反応が進行し、容易に重水素化体を得ることに成功した(Figure 1)。
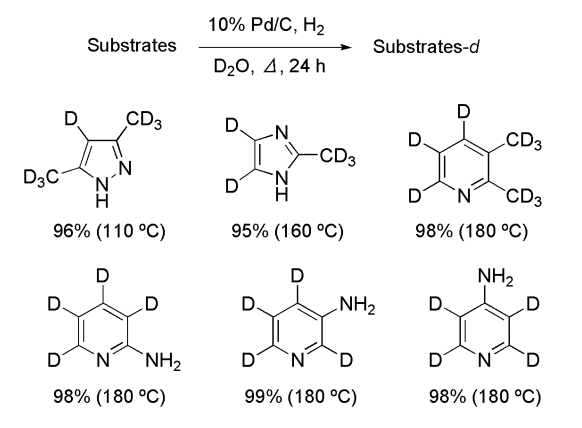
Figure 1
Pt/C を用いた芳香族化合物の重水素化 5)
本重水素化法のさらなる適用拡大を目指し、触媒のスクリーニングを行ったところ、Pd と同族の Pt/C を用いると芳香環炭素上で効率良く H-D 交換反応が進行することを見出した。
例えばフェノールは Pd/C では 180℃の高温条件が必要であるが、Pt/C を用いると室温でほぼ完全に重水素化された(Table 1)。
Table1.
Comparison of deuterium efficiency of phenol using Pt/C or Pd/C-D2O-H2 system.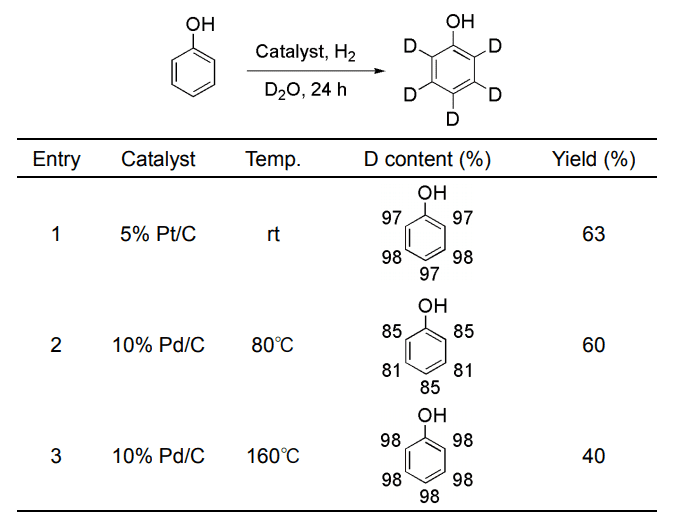
芳香族化合物の置換基効果について検討したところ、フェノール、アニリン誘導体等、電子供与基を有する化合物が温和な条件で効率良く重水素化された。一方、電子吸引基であるカルボキシル基を有する化合物では、電子供与基を有する化合物に比べ高温条件を必要とし、カルボキシル基の増加とともに重水素化率の低下傾向が見られた。
特に強力な電子吸引基であるニトロ基が導入されると重水素化反応を強力に抑制した。また、ハロゲンは H-D 交換が抑制されるとともに脱ハロゲン化が進行した。さらに Pd や Pt の触媒毒となる硫黄含有化合物でも H-D 交換反応が進行しにくいことが明らかとなった(Figure 2)。
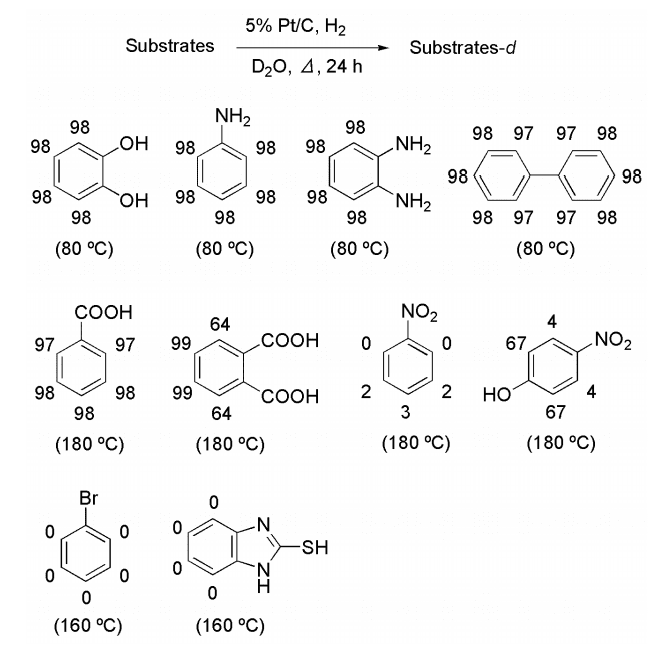
Figure 2
Pd/C-Pt/C 混合触媒による相乗効果 6)
これまでに述べたように触媒に Pd/C を用いると不活性なアルキル炭素上で、Pt/C を用いると芳香環炭素上で効率良く H-D 交換反応が進行し、Pd と Pt では重水素化されやすい部位が異なることが判明した。そこでそれぞれの触媒活性を生かすべく、アルキル側鎖を有する芳香族化合物について Pd/C と Pt/C を混合して反応させた(Scheme 2)。
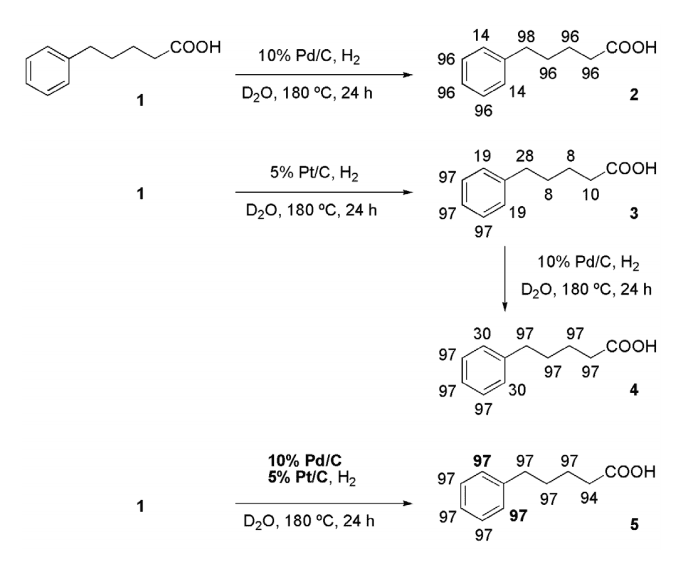
Scheme 2
5-Phenylvaleric acid (1) について触媒に Pd/C, Pt/C を単独で用いると、Pd/C ではアルキル鎖と置換基のオルト位以外の芳香環上で効率良く重水素化され (2) 、Pt/C ではオルト位以外の芳香環上で効率良く重水素化された (3) 。
何れもオルト位の重水素化率が低くなる蛍光が見られたが、おそらくアルキル側鎖の立体障害に起因すると考えられる。一方、触媒に Pd/C と Pt/C を混合して用いたところ、オルト位の重水素化率が飛躍的に向上し、ほぼ完全な重水素化体が得られた (5) 。
Pt/C を触媒として得られた (3) をさらに Pd/C で反応に付してもオルト位の重水素化率がさほど向上しないことから (4) 、Pd/C と Pt/C を混合することで何らかの相乗効果が発現したと考えられる。
この相乗効果はアルキル鎖の立体障害を有する他の基質についても発現し、複素環化合物にも適用可能であった(Table 2, entry 2)。さらに金属の担持率の低い触媒、すなわち高度に分散された触媒ほど高活性であることが明らかとなり、10% Pd/C-5% Pt/C の組み合わせでは十分に重水素化されない基質でも、5% または 1% 担持された触媒を用いることでほぼ完全な重水素化体を得ることに成功した(entries 3 and 4)。
Table 2.
Deuteration of various substrates using Pd/C-Pt/C-D2O-H2 system.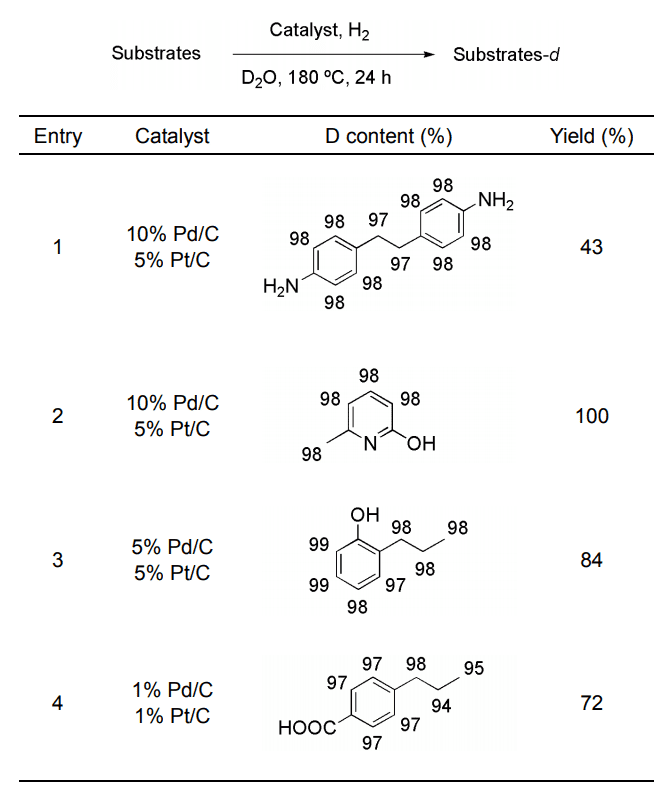
重水素化ビルディングブロックへの応用
はじめに述べたように、GC-MS を用いた同位体希釈質量分析法が医薬品の代謝の研究に盛んに用いられるようになり、医薬品の重水素化体が内部標準物質として必要不可欠となっている。それに伴い有用な重水素化された原料、すなわち重水素化ビルディングブロックの需要が高まると考えられる。
Figure 1, 2 または Table 2 に示した重水素化合物はほとんど市販されておらず、有用な重水素化ビルディングブロックであるが、その他にもさまざまな官能基を有する重水素化合物をこれまでに述べた方法を駆使して合成することができた。
例えば重水素化できなかったハロゲン、硫黄を含有する化合物の場合は、容易に重水素化可能な前駆体から誘導し、合成することに成功した(Scheme 3)。
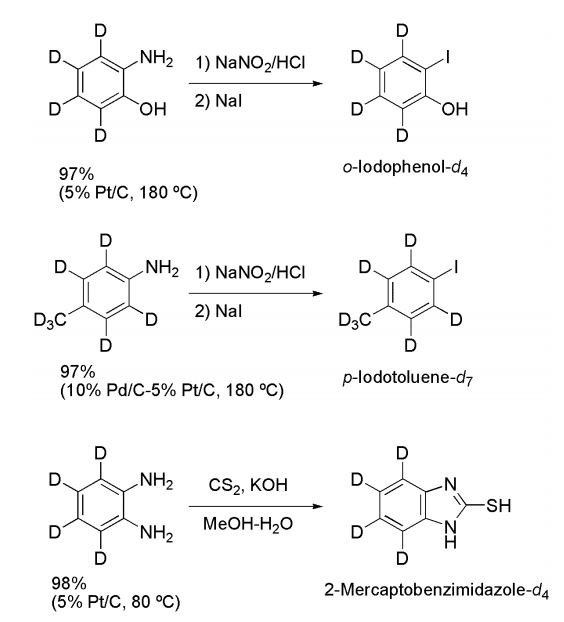
Scheme 3
おわりに
今回、重水を重水素源とする白金族触媒を用いた H-D 交換反応に関して報告した。今回は割愛させて頂いたが、アミノ酸、7) ヌクレオシド、8) カルボニル化合物、2 級アルコール類も効率良い重水素化が可能である。
本法は一般性が高く、有用な重水素化ビルディングブロックを安価かつ容易に提供できる手法であると考えている。また、近い将来、光学材料として重水素化ポリマー等への応用が期待できる。
最後に本研究に際し、多くのご助言、ご指導を頂きました岐阜薬科大学・佐治木教授に感謝いたします。
参考文献
- T. Junk, W. J. Catallo : Chem. Soc. Rev., 26, 401 (1997).
- a) N. H. Werstiuk, T. Kadai : Can. J. Chem., 52, 2169 (1974). DOI: 10.1139/v74-313
b) T. Junk, W. J. Catallo, J. Elguero : Tetrahedron Lett., 38, 6309 (1997). DOI: 10.1016/S0040-4039(97)01449-4
c) S. R. Klei, J. T. Golden, T. D. Tilley, R. G. Bergman : J. Am. Chem. Soc., 124, 2092 (2002). DOI: 10.1021/ja017219d
d) S. Matsubara, Y. Yokota, K. Oshima : Chem. Lett., 33, 294 (2004). DOI: 10.1246/cl.2004.294 - H. Sajiki, K. Hattori, F. Aoki, K. Yasunaga, K. Hirota : Synlett, 1149 (2002). DOI: 10.1055/s-2002-32605
- H. Sajiki, F. Aoki, H. Esaki, T. Maegawa, K. Hirota : Org. Lett., 6, 1485 (2004). DOI: 10.1021/ol0496374
- H. Sajiki, N. Ito, H. Esaki, T. Maesawa, T. Maegawa, K. Hirota : Tetrahedron Lett., 46, 6995 (2005). DOI: 10.1016/j.tetlet.2005.08.067
- N. Ito, T. Watahiki, T. Maesawa, T. Maegawa, H. Sajiki : Adv. Synth. Catal., 348, 1025 (2006). DOI: 10.1002/adsc.200606053
- T. Maegawa, A. Akashi, H. Esaki, F. Aoki, H. Sajiki, K. Hirota : Synlett, 845 (2005). DOI: 10.1055/s-2005-863730
- H. Sajiki, H. Esaki, F. Aoki, T. Maegawa, K. Hirota : Synlett, 1385 (2005). DOI: 10.1055/s-2005-868489




