【特別講座】ナフチルメトキシメチル:扱いやすくて酸化的に外せるベンジルオキシメチル系保護基
本記事は、OrganicSquare Vol.55 (2016年3月号)において、九州大学大学院理学研究院化学部門 鳥飼 浩平 様に執筆いただいたものです。
はじめに
ベンジル(Bn)基やその置換体は有機合成化学分野で保護基として長く利用されてきた。ベンジル系保護基最大の利点は何と言っても加水素分解(例えば H2、Pd/C)により容易かつクリーンに除去できることである。加えて p-メトキシベンジル(PMB)や 2-ナフチルメチル(NAP)基は 2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノン(DDQ)や硝酸二アンモニウムセリウムIV(CAN)といった酸化剤によっても容易に除去できるため、Bn 基との外し分けが可能な点で優れている。
しかし除去が容易である一方、Bn 系保護基の導入には通常強塩基性(例えば「NaH、BnBr、DMF」や「ジイソプロピルエチルアミン (DIPEA)、BnBr、neat、150℃」)、もしくは強酸性(例えば BnOC(NH)CCl3、TfOH)条件が必要であり、またこれらの反応は空気中の湿気の影響を受けやすいため、小スケールの実験や、トレーニングを受けた有機合成化学者以外による実施が困難であるといった泣きどころがある 1)。
酸や塩基に不安定なアルコールを保護したい場合、より弱い塩基である DIPEA により導入できるベンジルオキシメチル(BOM)基類を利用するのが一般的であり、これまで多段階合成において後に酸化的に除去したい箇所の保護基としては p-メトキシベンジルオキシメチル(PMBOM)基が用いられてきた 1)。しかしながら PMBOM 基の導入に用いられる PMBOMCl は、-20℃下 3 日も保存できないことが知られており 2)、要時調製を要する。
さらに PMBOMCl の調製では企業等での大量スケール合成に不向きな低温(-78℃)反応と、含硫黄化合物の副生が避けられない。そのため後の段階で遷移金属触媒を利用する場合、含硫黄化合物が触媒毒となり望む反応が進行しない可能性がある 3)。
その上 DIPEA を用いた導入反応も万能とは言えず、例えば 2-アセトキシ-1-オール系にはアシル転位反応等が進行してしまうため適用できない。
そこで今回我々は上述の問題点を全て解決すべく、新規 BOM 系保護基として 2-ナフチルメトキシメチル(NAPOM)基を開発したので以下紹介する。
NAPOMCl の調製・保護・脱保護

Figure 1. NAPOMCl (colorless powder).
まず NAPOMCl の調製を試みた 4)。2-ナフチルメチルアルコールとパラホルムアルデヒドの混合物に 0℃下、塩化水素ガスを通じると高収率(85%)で高純度(94%、純度低下の主な原因は乾燥剤として共存させている塩化カルシウム)の NAPOMCl が得られた(Figure 1)。
安定性を調査したところ NAPOMCl は塩化カルシウム(5.5wt%)の共存下、-20℃(冷凍保存)で 1 年半以上も安定に保存可能であった 5)。硫黄含有化合物を利用することなく 0℃下で導入剤を調製でき、また長期保存が可能(要時調製不要)であることは PMBOM 基の抱える問題点を完全に克服できたと自負している。
NAPOMCl の良好な性質に気を良くした我々は、様々なヒドロキシ及びメルカプト基を持つ基質に対し、NAPOM 基による保護・脱保護を検討した(Table 1)。
Table 1. Introduction and Removal of NAPOM groups.
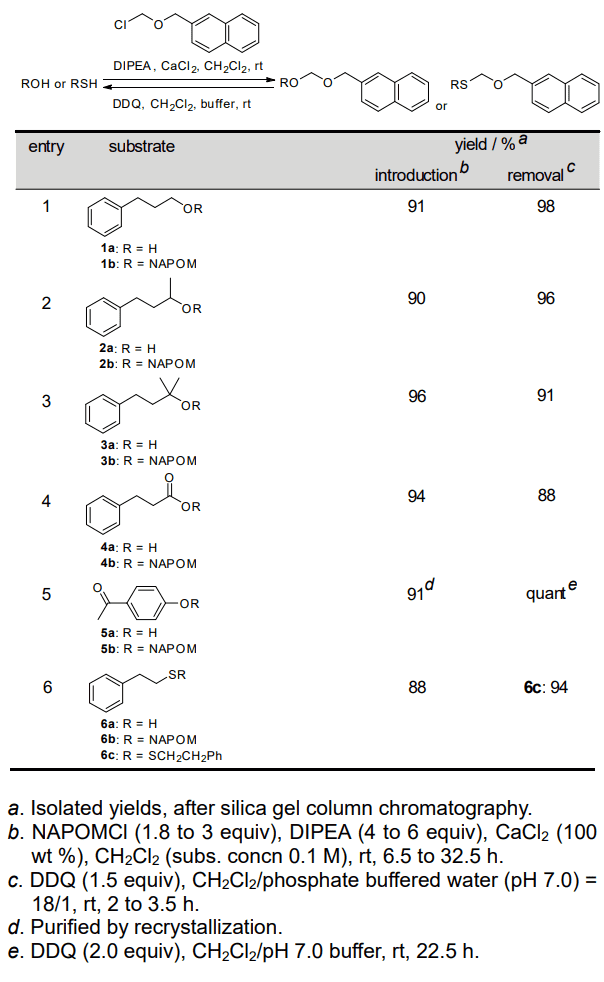
1 級(1a)、2 級(2a)、および 3 級(3a)アルコール、カルボン酸 4a、ならびにフェノール 5a に対し、DIPEA と塩化カルシウムの共存下 NAPOMCl を作用させたところ、いずれの場合も望む NAPOM 保護体を良好な収率で与えた(>90%、エントリー1-5)。反応点が嵩高い 3 級アルコール 3a の場合、反応の完結には過剰の反応剤(3 当量の NAPOMCl 及び 6 当量の DIPEA)と反応時間の延長(32.5h)を要したが別段大きな問題を生じることなく望む生成物が得られた。また、チオール 6a に関しても同様に NAPOM 保護体 6b に導くことができた(88%、エントリー6)。
次に NAPOM 基の酸化的除去に取りかかった。NAPOM 保護体 1b-5b に対し、ジクロロメタン- pH7 リン酸緩衝液 18:1 混合溶媒中、室温で DDQ を作用させたところ、反応は速やかに進行し、望む脱保護体が 88~100% の収率で得られた(エントリー1-5)。
一方 NAPOM スルフィド 6b に対して DDQ を作用させたところ、NAPOM 基の除去により生じたチオール 6a 同士が酸化的条件下ジスルフィドを形成した 6c が 94% の収率で得られることが分かった(エントリー6。なおジスルフィド(6c)からチオール(6a)への変換は文献既知 6)である)。これらの結果は NAPOM 基が、酸化的条件で除去できる新規 BOM 系保護基となり得ることを示している。
溶媒の選択
筆者は本研究開始当初から「保護・脱保護反応はできる限り多くの溶媒を許容すべきである」と考えていた。例えばアカデミアに身を置く者としてこのことを捉えた場合、複雑で分子量の非常に大きな天然物合成中間体、あるいは芳香環リッチで結晶性の高い物性有機化学分野における合成中間体に対して行う保護・脱保護どちらを想定しても、基質の溶解性が問題になることが多く、多種多様な溶媒中で反応が進行すれば有利であるためである。
一方、工業的スケールの有機合成を念頭に置けば、廃棄しやすく安全な溶媒しか利用できないという制限があるため、とも言える。そこで我々は(保護基の本 1)にも情報が少ない)溶媒の許容性について検討した(Table 2)。
Table 2. Introduction and Removal in Various Solvents.
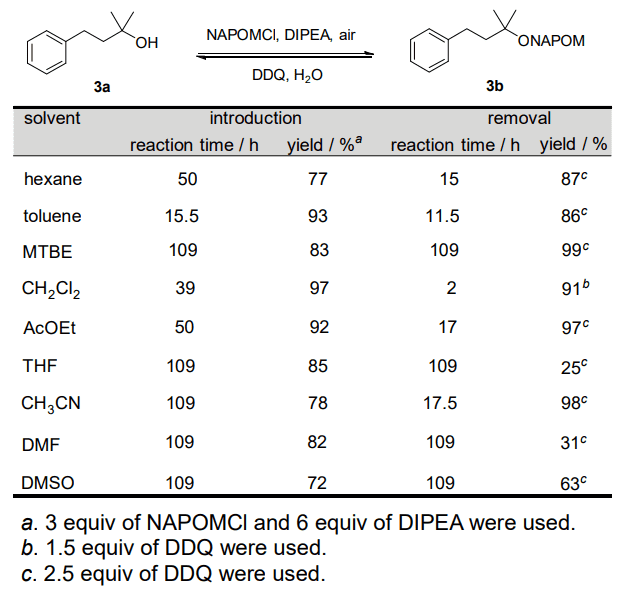
立体障害のために反応が遅いと考えられる3級アルコール 3a を基質として選択し、空気中、室温下で様々な溶媒を用いて導入反応を試みた。(ここでは利便性を重視し乾燥剤である塩化カルシウムの添加と系中のアルゴン置換を見送り、その分導入剤の当量を増やして反応を行っている。)
その結果、検討したほとんどすべての溶媒中において、中程度(ヘキサン 77%、アセトニトリル 78%、DMSO 72%、DMF 82%、メチル-t-ブチルエーテル(MTBE) 83%、THF 85%)から良好(酢酸エチル 92%、トルエン 93%、塩化メチレン 97%)な収率で目的の保護体 3b が得られた。
さらに DDQ による 3b の脱保護を行ったところ、脱保護も多くの溶媒を許容するが(塩化メチレン 91%、酢酸エチル 97%、ヘキサン 87%、トルエン 86%、アセトニトリル 98%、MTBE 99%)、一部の極性溶媒では好ましくない収率 (THF 25%、DMF 31%、DMSO 63%)を与えることがわかった。個人的には BOM 系保護基導入の王道溶媒とも言える塩化メチレンよりも、トルエン中でより効率的に反応が進行したことには少々驚いた。
不安定なアルコールに対する NAPOM 基の導入と除去
次に我々は、不安定な基質に対する NAPOM 基の導入へと研究をシフトさせた。1,2-ジオールは保護・脱保護においてしばしば予測不能な挙動を示す。中でも 1,2-ジオールの片方のヒドロキシ基がアシル基を持つ系は、酸性及び塩基性条件下アシル基転位反応を受け、異性化してしまうことが知られている。
実際我々が知る限り、BOM 基や MOM 基を 2-アシロキシ-1-オール系に異性化を起こさずに導入した例はない。そこでまず 2-アセトキシ-1-オール 7 に対し、DIPEA を用いる従来法で NAPOM 基を導入することを試みた(エントリー 1,Table 3)。
Table 3. Introduction and Removal of NAPOM Group on Sensitive Alcohols.
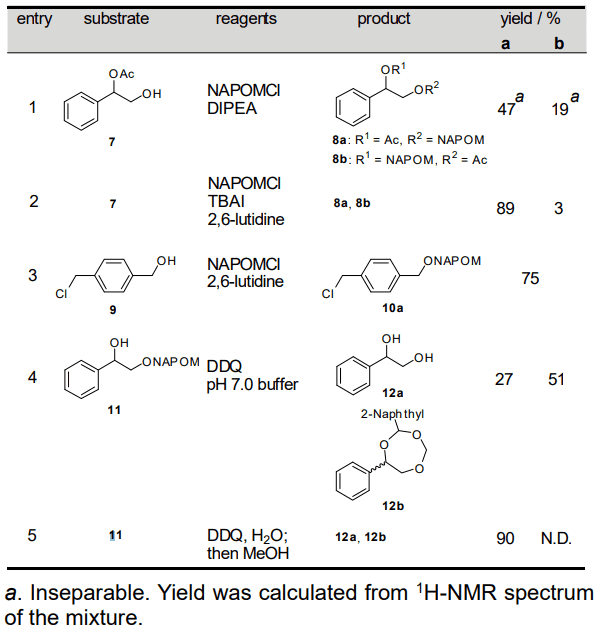
その結果、DIPEA 程度の弱い塩基を用い、かつ室温という比較的穏やかな温度でも、当初危惧した通りアシル転位反応が進行し、望む保護体 8a (47%)と転位成績体 8b (19%)の混合物が得られた。そこで種々反応条件を検討したところ、DIPEA の代わりに 2,6-ルチジンとテトラブチルアンモニウムヨージド(TBAI)を用いることで(エントリー2)、アシル転位反応を 3%にまで抑制し、望む 8a を 89%の収率で得ることに成功した。本法は反応性の高いベンジルクロリド部位を有するために Ag2O を用いるアルキル化法が適用できない、アルコール 9 の NAPOM 化にも適用できた(エントリー3、75%)。
次に 1,2-ジオールのモノ NAPOM 体 11 の脱保護における問題に取り組んだ(エントリー4)。まず 11 に DDQ を、従来法通り pH 7 の緩衝液中で作用させたところ、環状アセタール 12b が主生成物 (51%)となり、望むジオール 12a はわずか 27%しか得られなかった。ならば 12b を系中で酸加水分解し 12a へ導こうと考え、緩衝液の代わりに水を用いて反応を行った(エントリー5)。
水を用いた場合、TLC 分析により 12a がより多く生成していることを確認出来たが、12b の消失には至らなかった。そこで有機相と水相の混和を促せば、系中に存在する酸が 12b を効果的に加水分解してくれることを期待してメタノールを加えた。その結果望むジオール 12a を 90%の収率で得ることに成功した。
選択的除去
上述の結果から NAPOM 基が保護基として十分利用できることがわかったので、最後に多段階合成に保護基を利用する際に最も重要な性質である、選択的除去の検討を行った(Scheme 1)。
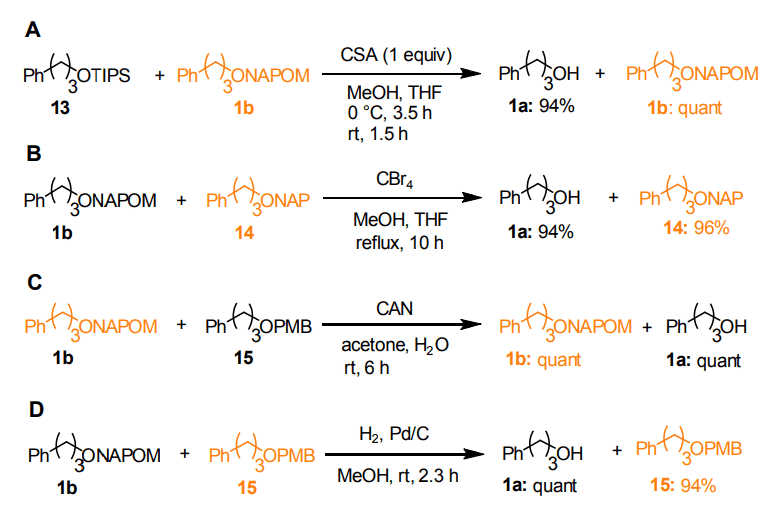
Scheme 1. Selective Cleavage.
a. 1:1 (mol/mol) mixture of substrates was used. For each entry, compounds whose protecting groups remained untouched are highlighted in orange.まずプロトン酸に対する安定性を確かめる目的で種々のシリル基との比較を行ったところ、トリイソプロピルシリル(TIPS)基よりも安定であることがわかった(A)7)。すなわち 3-フェニル-1-プロパノールの TIPS 保護体 13 と NAPOM 保護体 1b の等モル混合物をカンファースルホン酸の存在下、メタノールー THF 混合溶媒中で撹拌すると、TIPS 保護体 13 は完全に消失し、94% の収率で脱保護体を与えたのに対し、NAPOM 保護体 1b は定量的に回収された。
同様に NAP 基とNAPOM 基のプロトン酸に対する安定性を比較したところ(B)8)、NAP 保護体 14 に影響を与えることなく(96%)、NAPOM 基のみを選択的に除去できる(94%)ことが明らかになった。
一方 CAN 酸化の条件では(C)9)、NAPOM 基共存下 PMB 基のみを選択的に除去(100%)できる。逆の選択性を出す、すなわち PMB 基を残して NAPOM 基を外すこと、も可能で(D)、この場合 Pd/C を用いた接触還元条件に付すと NAPOM 基だけが定量的に外れ、PMB 保護体 15 は 94%の収率で回収された 10)。
手前みそではあるが、非常に近い性質を有する NAP 基や PMB 基との外し分けができることは複雑化合物合成の際、「痒いところに手が届く」保護基として重宝されるのではないだろうか。
おわりに
以上我々は新規 BOM 系保護基 NAPOM 基を開発し、ここに報告した 11,12)。NAPOM 基の利点として i) NAPOMCl が保存可能であること、ii) 導入・除去に様々な溶媒が使用できること、iii) 導入時 2,6-ルチジンを用いることでアシル転位等の副反応を抑制できること、iv) NAP や PMB との外し分けが可能であること、v) 湿気や空気に対する特別な配慮を必要としないことが挙げられる。
これらの利点は多段階合成に新たなルートを提案するばかりでなく、誰でも気軽に保護・脱保護が可能である点で優れていると自負している。
昨今の低 E―ファクター至上主義と C―H 活性化化学、latestage functionalizationの急速な発展により旗色の悪い保護基の化学であるが、(特に糖鎖合成など)有機合成を支える重要な役割を担い続けるのは今後も変わらないはずであると筆者は信じている。多くの研究者に NAPOM 基を使って頂ければ幸甚である。
謝辞
本稿に記載の内容は九州大学大学院理学研究院化学部門生物有機化学研究室にて行われた研究の成果である。ほとんど全ての実験を行ってくれた佐藤拓矢氏、および研究室主催者で多くのご助言を下さった大石 徹教授に深く感謝する。特許出願では橋本和彦氏、眞浦麻里子氏、井上 正氏、高橋世理哉氏に大変お世話になった、ここに感謝の意を表する。最後に資金援助を頂いた科学研究費補助金若手研究(B)(15K212210)および有機合成化学協会和光純薬研究企画賞助成金に感謝する。
参考文献とノート
- Wuts, P. G. M. and Greene, T. W. : Greene's Protective Groups in Organic Synthesis, 4th ed.; John Wiley & Sons: New Jersey (2007).
- Kozikowski, A. P. and Wu, J.-P. : Tetrahedron Lett., 28, 5125 (1987). DOI: 10.1016/S0040-4039(00)95608-9
- 例えば直前に PMBOM 保護した化合物の加水素分解による PMBOM 基の除去はしばしば失敗に終わった。
- Stefan, E. and Taylor, R. E. : Org. Lett., 14, 3490 (2012). DOI: 10.1021/ol301455p
- 室温では保存できないが(半減期約 10 日間)、4℃は数カ月保存可能である(4℃で 1 カ月保存すると 13% が失われる)。
- 例えば LiCl, NaBH4, THF. See: Rajaram, S., Chary, K. P. and Iyengar, D. S. : Indian J. Chem., Sect. B: Org. Chem. Incl. Med. Chem., 40B, 622 (2001).
- NAPOM 基は TBDPS 基よりも酸に安定だが、前者を 100% 保ったまま後者を完全に除去することは難しかった。
- Lee, A. S.-Y., Hu, Y.-J. and Chu, S.-F. : Tetrahedron, 57, 2121 (2001). DOI: 10.1016/S0040-4020(01)00062-X
- NAP 基の共存下に PMB 基を除去する方法: Wright, J. A., Yu, J. and Spencer, J. B. : Tetrahedron Lett., 42, 4033 (2001). DOI: 10.1016/S0040-4039(01)00563-9
- Bn 基の共存下にNAP基を除去する方法:Gaunt, M. J., Yu, J. and Spencer, J. B. : J. Org. Chem., 63, 4172 (1998). DOI: 10.1021/jo980823v
- Sato, T., Oishi, T. and Torikai, K. : Org. Lett., 17, 3110 (2015). DOI: 10.1021/acs.orglett.5b01408
- 特許出願済 【特願2014-206408】; 【PCT/JP2015/77835】.




