【連載】ScreenFect™通信 「Vol.3 HeLa 細胞への siRNA 導入データ」

ScreenFect™siRNA を用いた HeLa 細胞への siRNA 導入実績及びリバーストランスフェクション(1-STEP)プロトコールを紹介します。
フォワードトランスフェクション(2-STEP)プロトコールを含む ScreenFect™siRNA のプロトコール電子版は、当社データベースからダウンロードできます。
HeLa 細胞へのリバーストランスフェクションプロトコール例 (24ウェルプレート)
細胞の前培養
- 適当な培養容器 (T-75 フラスコなど)を用いて、HeLa 細胞をセミコンフルエントになるまで培養する。
トランスフェクション試薬の調製
- 滅菌処理した 1.5mL 容チューブを 2 本用意する。
- 上記工程で用意した 1 本のチューブに ScreenFect™ Dilution buffer を 24.5 μL 添加する。
- 2に 0.5 μL の ScreenFect™siRNA reagent を添加して全量で 25 μL にする。・・・溶液(A)
(ScreenFect™siRNA Reagent は使用前にボルテックスして下さい。) - 1で用意したもう 1 本のチューブに ScreenFect™ Dilution buffer を 24 μL 添加する。
- 4に 1 μL の 5μmol/L PIK3CB siRNA 溶液(5 pmol)を添加する。・・・溶液(B)
- 溶液(A)のチューブに溶液(B)全量を添加する。
- 混合したチューブをタッピングで良く混合し、卓上遠心機でスピンダウンする。
- 室温で 5 〜 20 分間インキュベーションする。
細胞懸濁液の調製
- 〈細胞の前培養〉で用意したフラスコをインキュベーターから取り出す。
- 培地を捨て、PBS で1回洗浄する。
- トリプシン溶液を 2 mL 添加し、室温か CO2 インキュベーターでインキュベーションし、細胞を培養容器から剥離させる。
- FBS 添加培地を約 5 mL 添加し反応を止める。
- ピペッティングでよく細胞を分散させ、遠沈管に全量移す。
- 150 x g, 5 分間遠心する。
- ペレットを捨てないよう上清を除く。
- 新しい培地を 5 ~ 10 mL 添加し、ピペッティングで細胞を分散させる。
- 血球計算盤などの細胞カウンターを用いて細胞数を測定する。
- 測定した細胞懸濁液の濃度から計算して、2.0 × 105 cells/mL の細胞懸濁液を調製する(調製する細胞懸濁液量は実験スケールに応じて適宜調節する)。
トランスフェクション
- 〈細胞懸濁液の調製〉で調液した細胞懸濁液 500 μL をウェルへ添加する。
- 〈トランスフェクション試薬の調製〉の工程 8 でインキュベーションしておいた DNA-lipid complex 50 μL をウェルに添加し、プレートを軽く揺すって混合させる(ウェルに予め DNA-lipid complex 50 μL を添加しておき、そこに細胞懸濁液を 500 μL 添加しても構わない)。
- CO2 インキュベータで 24 ~ 48 時間培養し、実験に供する。
実験データ
HeLa 細胞へリバーストランスフェクション法及びフォワードトランスフェクション法で PIK3CB siRNA の導入実験を行い、リアルタイム定量 PCR で PIK3CB mRNA の発現量を測定しました。定量結果を元に他社製品とノックダウン効率の比較を行ったところ、ScreenFect™siRNAは他社製品と同等以上のノックダウン効率を示しました。
リバーストランスフェクション(1-STEP)
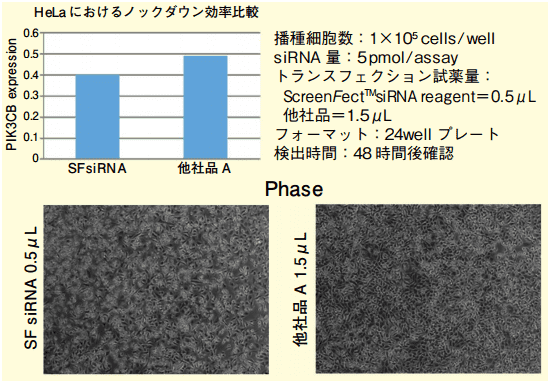
フォワードトランスフェクション(2-STEP)
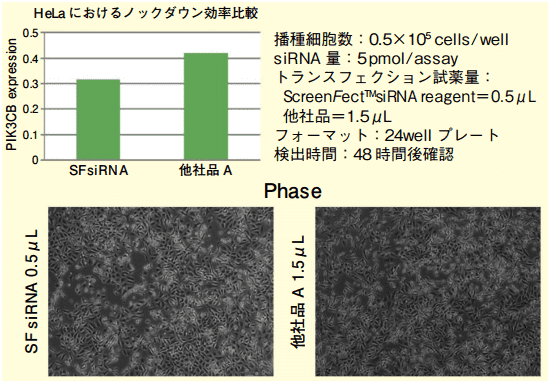
その他、ScreenFect™ シリーズの詳細情報は専用 HP をご覧ください。
さまざまな細胞に対するトランスフェクションプロトコール例をご紹介予定です。
掲載をご希望される細胞がございましたら、こちらのメールアドレスまでご連絡下さい。→ ffwk-jiho@fujifilm.com
掲載をご希望される細胞がございましたら、こちらのメールアドレスまでご連絡下さい。→ ffwk-jiho@fujifilm.com
Share




