【総説】アリル位アリール化反応を超高効率で触媒するパラジウム NNC-ピンサー錯体
本記事は、和光純薬時報 Vol.85 No.4(2017年10月号)において、自然科学研究機構 分子科学研究所 生命・錯体分子科学研究領域 錯体触媒研究部門 浜坂 剛 様に執筆いただいたものです。
はじめに
遷移金属を用いた触媒的有機分子変換工程は、様々な有用化合物を合成するための強力な手法である。特に、パラジウム触媒を用いた炭素-炭素結合形成反応は、実験室スケールから化学工業プロセスに至るまで広範に用いられている1)。一方でこれらの反応では、標的分子を高収率で得るためにはパーセントオーダーのパラジウムが一般に必要とされている。そのため、しばしば生成物中へのパラジウムの混入が問題となる。
特に、医薬品や機能性有機材料等を合成する場合、製品中への遷移金属類の混入が制限されているため、その除去には大きなコストがかかる(ICH-Q3D ガイドライン2)に従えば、例えば経口薬でのパラジウムの許容混入量の上限は 10 ppm である)。また、クラーク数が低いため資源枯渇の可能性がある等の問題もある。
これらの問題を解決しうる一つの方法として、ppm オーダー以下で機能する超高効率触媒の開発が注目されている3)。
高効率錯体触媒の一つとして、ピンサー錯体がある4)。溝呂木-ヘック反応や鈴木-宮浦反応をモデル反応とし、その触媒活性が評価されている。図 1 には溝呂木-ヘック反応を効果的に触媒する代表的なピンサー錯体触媒を示す5)。
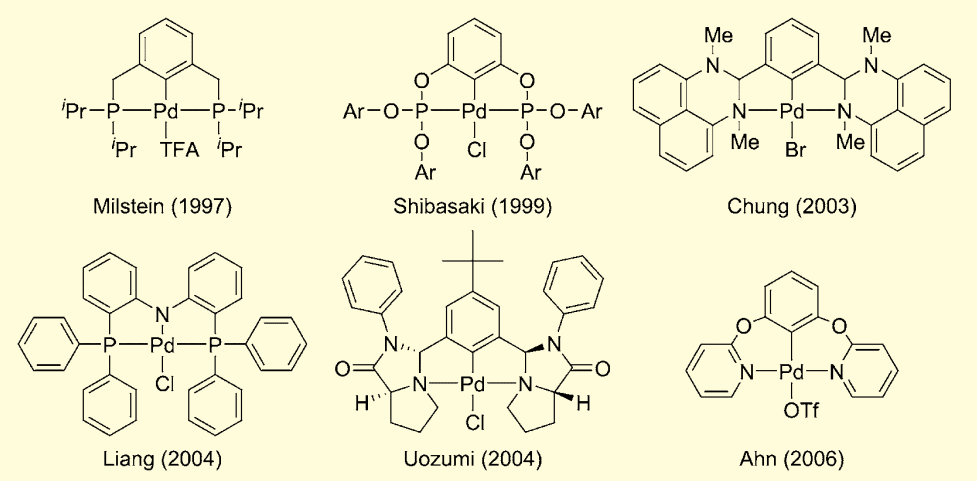
図1.代表的なパラジウムピンサー錯体
我々も高効率錯体触媒開発に興味を持ち、ピンサー錯体触媒の研究を進める中で、1,10-フェナンスロリン骨格を有するパラジウム NNC-ピンサー錯体(図 2:DPP-NNC Pd)が、酢酸アリル誘導体と有機ホウ素化合物によるアリル位アリール化反応を極めて高い効率で触媒することを見出した6)。
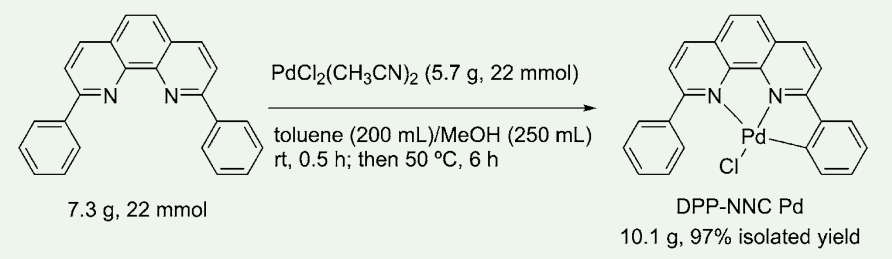
図2.DPP-NNC Pd の合成
なお、DPP-NNC Pd は 2013 年、東京大学理学研究科の塩谷先生らによってその合成が報告され7)、X 線結晶構造解析等によりその構造は明らかとされているものの、その触媒機能については未検討であった。本稿では、DPP-NNC Pd を触媒として用いた高効率アリル位アリール化反応について紹介する。
DPP-NNC Pd の合成
触媒機能検討を始めるに当たり、DPP-NNC Pd の大量合成を行うこととした。塩谷先生らの合成法に改良を加え、DPP-NNC Pd の 10 g スケールでの合成に成功した(図 2)。
すなわち、2,9-ジフェニル-1,10-フェナンスロリンとジクロロビス(アセトニトリル)パラジウムをトルエン-メタノール混合溶媒中で室温にて 30 分間攪拌後、50 ℃に昇温しさらに 6 時間攪拌後、ろ過することで標的錯体が 10.05 g、97% 収率で得られる。本錯体は空気下で安定であり、その取り扱いは容易である。
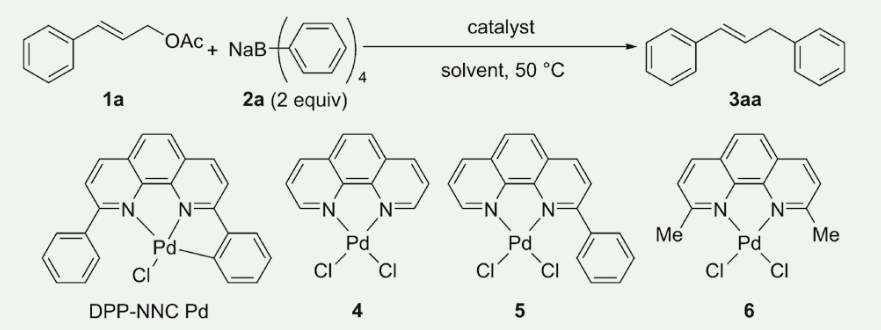
アリル位アリール化反応:錯体触媒ならびに溶媒検討
アリル酢酸エステルと有機ホウ素化合物によるアリル位アリール化反応は、触媒的炭素-炭素結合形成反応の一つである8)。本反応では、一般に、標的生成物を得るためには 1 mol% 以上の触媒量が必要とされており、ppm オーダー以下の触媒量で本反応を実現している例は限られている9)。
我々は DPP-NNC Pd がアリル位アリール化反応を ppm オーダー以下の触媒量で効果的に進行させることを見出している。本節では、DPP-NNC Pd を触媒として用いたアリル位アリール化反応の条件検討について述べる。
DPP-NNC Pd を 0.1mol% 量用い、酢酸シンナミル(1a)とテトラフェニルホウ酸ナトリウム(2a)の反応をメタノール中 50 ℃にて実施したところ、反応は 1 時間以内に完結し、標的生成物 3aa が 91% の単離収率で得られた(表 1, entry 1)。
この結果を受け、本触媒系では触媒量の更なる低減が可能であると考え、触媒量を 1 mol ppm(0.0001 mol%)まで減らし、反応を試みた。0.1 mol% の触媒量にて行った反応条件と同様に、メタノール中 50 ℃にて反応を実施したところ、反応開始 24 時間後には原料は完全に消費され、3aa が 87% の単離収率で得られた(entry 2)。なお、本反応は出発原料の酢酸アリルを 10 mmol 用いて行っており、比較的大きなスケールでも本触媒システムが問題なく機能することを示している。
また、無触媒下では反応は進行しない(entry 3)。溶媒検討したところ、THF あるいは水中では 7 割程度反応が進行することを確認した(entries 4 and 5)。DMF、テトラクロロエタン、トルエン中では反応は進行しなかった(entries 6-9)。メタノールが本反応において最も適した溶媒であると言える。
表1.酢酸シンナミルとテトラフェニルホウ酸ナトリウムとの反応
| entry | catalyst | solvent | time, h | yield, % |
|---|---|---|---|---|
| 1 | DPP-NNC Pd (0.1 mol%) | MeOH | 1 | 91 |
| 2 | DPP-NNC Pd (1 mol ppm) | MeOH | 24 | 87 |
| 3 | none | MeOH | 24 | nr |
| 4 | DPP-NNC Pd (1 mol ppm) | THF | 24 | 76 |
| 5 | DPP-NNC Pd (1mol ppm) | H2O | 24 | 69 |
| 6 | DPP-NNC Pd (1mol ppm) | DMF | 24 | nr |
| 7 | DPP-NNC Pd (1mol ppm) | 1,1,2,2-TCE | 24 | 1 |
| 8 | DPP-NNC Pd (1mol ppm) | toluene | 24 | nr |
| 9 | 4 (1 mol ppm) | MeOH | 24 | 16 |
| 10 | 5 (1 mol ppm) | MeOH | 24 | 45 |
| 11 | 6 (1 mol ppm) | MeOH | 24 | 56 |
さらに触媒量の低減を試みたところ、1 mol ppb(0.0000001 mol%)の触媒量でも反応が進行した(図 3)。反応時間 24 時間では収率が 27% であり、触媒回転数(TON)は 270,000,000 回、触媒回転頻度(TOF)は 11,250,000 h-1であった。この触媒回転数は我々が知る限りにおいて、アリル位アリール化反応の世界最高記録である。
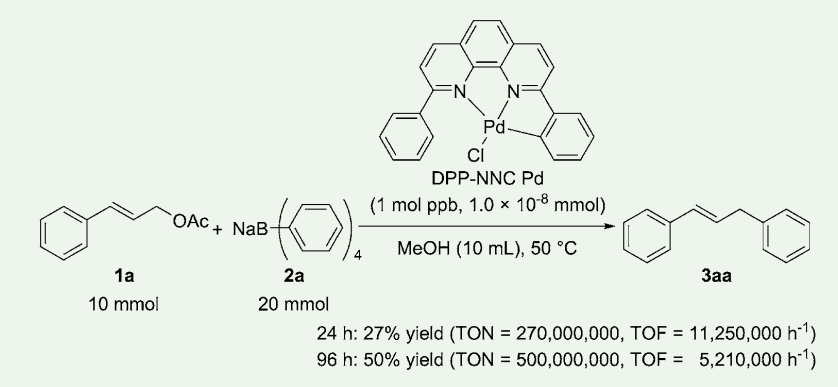
図3.1 mol ppb の DPP-NNC Pd を用いたアリル位アリール化反応
DPP-NNC Pd と同様に 1,10-フェナンスロリン骨格を有する錯体について、その触媒活性を検討した。1,10-フェナンスロリン、2-フェニル-1,10-フェナンスロリン、そして 2,9-ジメチル-1,10-フェナンスロリンを配位子とした錯体(4-6)を用いて反応を実施したところ、それぞれ、16%(TON = 160,000)、45%(TON = 450,000)、そして 56%(TON = 560,000)の収率で標的化合物が得られた。立体障害が触媒活性に影響していると考えられる。
一方、同様の反応条件下で DPP-NNC Pd を触媒として用いた場合の TON は 270,000,000 回に達しており、錯体 4-6 を触媒として用いた場合と比較してその値は 3 桁大きく、ピンサー構造をとることでより高い活性を示すことが示唆された。
アリル位アリール化反応:基質一般性
本触媒システムを用いた基質一般性について検討した(図 4)。反応は酢酸アリル誘導体(1)を 10 mmol、テトラアリールホウ酸ナトリウム(2)を 20 mmol のスケールにて、1 mol ppm の DPP-NNC Pd を触媒として用い、メタノール中 50 ℃にて実施した。
電子供与性基(MeO、Me、tBu、Ph)および電子吸引性基(CF3、NO2、C(O)Me、COOMe)を有する酢酸シンナミル誘導体とテトラフェニルホウ酸ナトリウムの反応が進行し、目的のアリール化生成物(3ba-3ia)が 77-95% 単離収率で得られた。ナフチル基を有する酢酸アリル誘導体(1j)および立体的に嵩高い 2-メチル基および 2-メトキシ基置換酢酸シンナミル(1k および 1l)の反応も DPP-NNC Pd は効果的に触媒した。
酢酸シンナミル(1a)とテトラアリールホウ酸ナトリウム(2b-d)との反応も 1 mol ppm の触媒量で効率的に進行し、アリール化生成物 4ab-ad を 59-84% の収率で与えた。反応性が乏しい脂肪族置換酢酸アリル誘導体(1m-q)についても検討を加えた。直鎖脂肪族アルキル(1m)、分岐状脂肪族アルキル(1n)、環状脂肪族アルキル(1o)置換酢酸アリルとテトラフェニルホウ酸ナトリウム(2a)の反応が進行し、対応するアリール化生成物(3ma-oa)が 71-78% 収率で得られた。
酢酸ネリル(1p)および酢酸ゲラニル(1q)も同様に反応が効果的に進行することを確認した。また、DPP-NNC Pd は 2 級酢酸アリル誘導体(1r および 1s)と 2a の反応も効果的に触媒した。
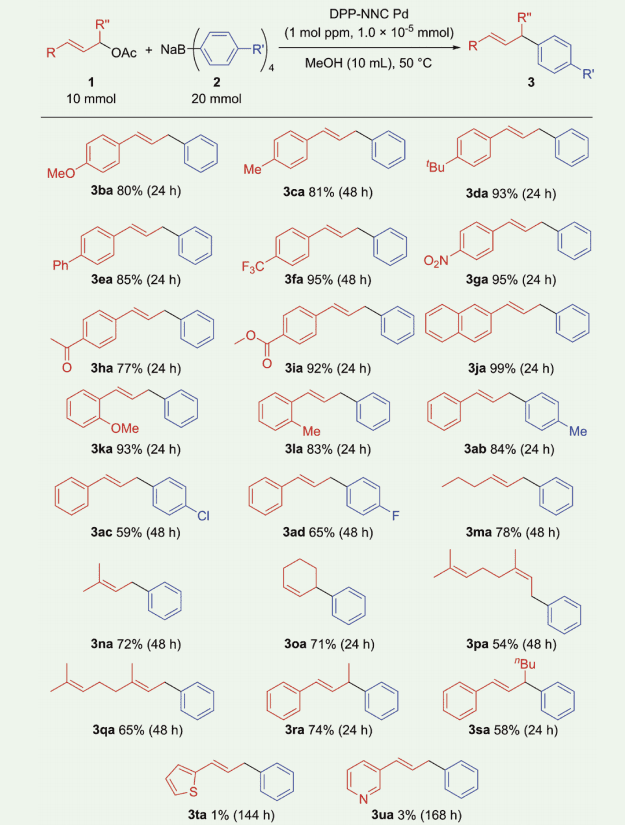
図4.種々の置換基を持つ酢酸アリル誘導体とテトラアリールホウ酸ナトリウムとの反応
以上のように、本触媒系は広い範囲の基質一般性を示した。一方、残念ながら、同様の反応条件下では、ピリジンやチオフェンを持つ酢酸アリル誘導体を基質として用いた場合では反応がほとんど進行しなかった。
予備的反応機構検討
DPP-NNC Pd を用いたアリル位アリール化反応の反応機構に関する知見を得るためにいくつかの検討を行った。初めに、分岐状酢酸アリル誘導体(7)とテトラフェニルホウ酸ナトリウム(2a)の反応を、DPP-NNC Pd (1 mol ppm)存在下、実施したところ、酢酸シンナミル(1a)を基質として用いた場合と同じ生成物が得られた(図 5a)。この結果は、反応中、πアリルパラジウム中間体が生成することを示唆している。
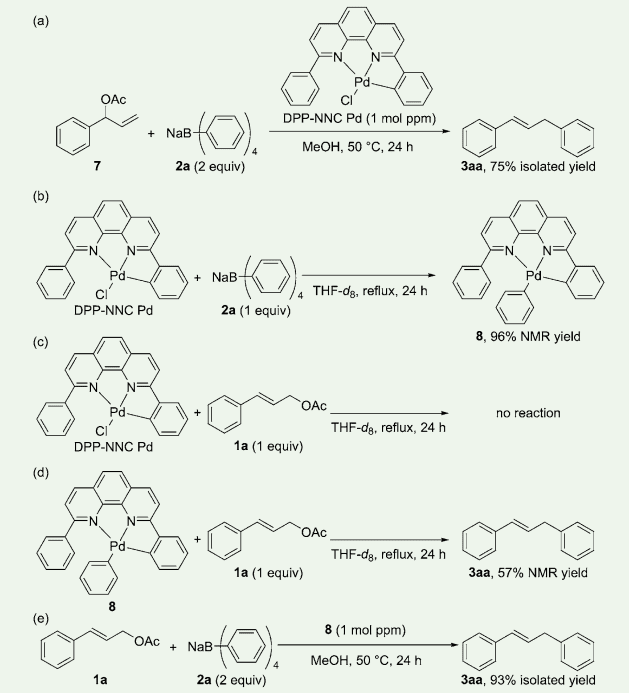
図5.反応機構検討
続いて、DPP-NNC Pd とテトラフェニルホウ酸ナトリウム(2a)の等量反応を行ったところ、フェニル化した錯体(8)がほぼ定量的に得られた(図 5b)。一方で、DPP-NNC Pd と酢酸シンナミルの等量反応を行った場合、反応は進行しなかった(図 5c)。
得られた錯体 8 と酢酸シンンアミルを反応させたところ、化合物 3aa が得られた(図 5d)。また、錯体 8 を触媒として用い、酢酸シンナミル(1a)とテトラフェニルホウ酸ナトリウム(2a)との反応を実施したところ、反応は良好に進行し、3aa が 93% 単離収率で得られた(図 5e)。
以上の結果より、錯体 8 が本アリル位アリール化反応における中間体であることが推定される。
おわりに
我々は、ppb から ppm 量の DPP-NNC Pd が、温和な反応条件下、種々の酢酸アリル誘導体とテトラフェニルホウ酸ナトリウムとのアリル位アリール化反応を極めて高い収率で触媒し、対応するアリール化生成物を高収率で与えることを見出した。TON は最大で 500,000,000 回に達する。本研究により、DPP-NNC Pd がアリル位アリール化反応を極めて高い効率で触媒することを示した。
我々は DPP-NNC Pd が他の触媒反応へも同様に高い効率を示すものと期待している。現在、本錯体を他の触媒反応へと適用し、ppm あるいは oob オーダーの触媒量で種々の反応を効率的に進行させることを目指し、研究を展開しているところである。
謝辞
本研究は自然科学研究機構分子科学研究所 錯体触媒研究部門 魚住研究室にて行われました。研究室主宰者である魚住泰広教授には、本研究全体を通してご指導いただきました。深謝いたします。また、実験を実施した、櫻井扶美恵博士に感謝いたします。
参考文献
- (a) Torborg, C. and Beller, M. : Adv. Synth. Catal ., 351, 3027-3043 (2009). DOI: 10.1002/adsc.200900587 (b) Magano, J. and Dunetz, J. R. : Chem. Rev ., 111, 2177-2250 (2011). DOI: 10.1021/cr100346g
- ICH Q3D は以下のweb ページからダウンロード可能である。:http://www.ich.org/products/guidelines/quality/article/quality-guidelines.html
- (a) Farina, V. : Adv. Synth. Catal ., 346, 1553-1582 (2004). DOI: 10.1002/adsc.200404178(b) Deraedt, C. and Astruc, D. : Acc. Chem. Res ., 47, 494-503 (2014). DOI: 10.1021/ar400168s
- 最近の総説:Selander, N. and Szabó, K. J. : Chem. Rev., 111, 2048-2076 (2011). DOI: 10.1021/cr1002112
- (a) Ohff, M., Ohff, A., van der Boom, M. E. and Milstein, D. : J. Am. Chem. Soc ., 119, 11687-11688 (1997). DOI: 10.1021/ja9729692 (b) Miyazaki, F., Yamaguchi, K. and Shibasaki, M. : Tetrahedron Lett., 40, 7379-7383 (1999). DOI: 10.1016/S0040-4039(99)01514-2 (c) Jung, I. G., Son, S. U., Park, K. H., Chung, K.-C., Lee, J. W. and Chung, Y. K. : Organometallics, 22, 4715-4720 (2003). DOI: 10.1021/om030371z (d) Huang, M.-H. and Liang, L.-C. : Organometallics , 23, 2813-2816 (2004). DOI: 10.1021/om049888g (e) Takenaka, K. and Uozumi, Y. : Adv. Synth. Catal., 346, 1693-1696 (2004). DOI: 10.1002/adsc.200404161 (f) Yoon, M. S., Ryu, D., Kim, J. and Ahn, K. H. : Organometallics, 25, 2409-2411 (2006). DOI: 10.1021/om0601246
- Hamasaka, G., Sakurai, F. and Uozumi, Y. : Chem. Commun., 51, 3886-3888 (2015). DOI: 10.1039/C4CC09726B
- Kuritani, M., Tashiro, S. and Shionoya, M. : Chem.--Asian J., 8, 1368-1371 (2013). DOI: 10.1002/asia.201300209
- Pigge, F. C. : Synthesis, 1745-1762 (2010). DOI: 10.1055/s-0029-1218756
- (a) Sarkar, S. M., Uozumi, Y. and Yamada, Y. M. A. : Angew. Chem. Int. Ed., 50, 9437-9441 (2011). DOI: 10.1002/anie.201103799 (b) Yamada, Y. M. A., Sarkar, S. M. and Uozumi, Y. : J. Am. Chem. Soc., 134, 3190-3198 (2012). DOI: 10.1021/ja210772v
キーワード
触媒回転数
触媒性能の指標の一つで、触媒回転数 = 生成物のモル数/触媒のモル数と定義される。その数が多いほど高効率な触媒であると言える。
ピンサー錯体
金属を橋頭位に有する 2 環性メタラサイクルである。配位子は、一般に、1 つのアニオン性配位部位(例えば C)と 2 つの中性配位部位(例えば N、P、S)を有する。触媒としての利用のみならず、機能性有機金属化合物としての応用も試みられている。




