【総説】リパーゼの特徴と有効性について
本記事は、和光純薬時報 Vol.84 No.3(2016年7月号)において、天野エンザイム株式会社 佐藤 幸秀 様に執筆いただいたものです。

はじめに
19 世紀に、膵臓中にリパーゼの存在が確認され、リパーゼは、アミラーゼ、プロテアーゼとともに重要視され、産業的には医薬用消化酵素、診断薬、洗剤、食品加工、キラル合成などに利用されてきている 1, 2)。またそれ以外にも近年グリーンケミストリーの観点から、酵素や微生物などの生体触媒の利用は注目されており、特に光学活性な化合物を得る手法としてリパーゼは広く利用され、多くの研究成果が報告されている 3)。
実用例では不二製油で行われたカカオ油脂の製造(1988 年)や、田辺製薬によるジルチアゼム「ヘルベッサー」の中間体の光学活性体の製造(1993 年)にリパーゼが利用されてきた 4)。1980 年以前は、合成医薬品中でキラルな化合物の殆どはラセミ体であったが、ラセミ体で上市するためには科学的根拠を要求されるようになったことから、光学活性な医薬品の割合が増えている。光学活性体の製造の中で、ラセミ体の分割に生体触媒が利用される場合、収率が最大でも 50 % であり、経済的にも環境面からも大きな問題となる。
近年では、動的光学分割(DKR=Dynamic Kinetic Resolution)と呼ばれる、酵素とともに金属触媒等を作用させて、ラセミ化させながら目的の鏡像体に収束させる(理論収率 100 %)手法がいくつか報告されている 5)。
リパーゼやプロテアーゼを代表とする加水分解酵素は、比較的多くの種類の酵素が安価に入手可能であるため現在でも最も手軽に利用されている。リパーゼはタンパク表面が比較的疎水性のアミノ酸で構成されているために、有機化学で使用される一般的な有機溶媒中で失活せず安定である。有機溶媒中で使用できる酵素は、反応系に有機溶媒を添加したり水層との 2 層系にしたりすることで基質(または生成物)の溶解度の向上、生成物阻害の回避、生成物の有機溶媒層(または水層)への除去、酵素液の再利用などができる可能性があるため反応系をデザインする上で選択肢が大きく広がる。
本稿では主に光学活性体製造用途における各種リパーゼの利用について、その特徴と有効性を紹介する。
リパーゼの特徴
リパーゼは脂質のエステル結合を加水分解する酵素の総称である(EC 3.1.1.3)。リパーゼは脂肪酸とグリセリンからなるトリグリセリドを基質として、加水分解、合成、または転移反応を行う。リパーゼは基質であるトリグリセリドの多様性から、分解特異性が異なる数多くの種類が知られている。リパーゼの基質特異性は次のように分類される 6)。
位置特異性
リパーゼがトリグリセリドに作用して脂肪酸を遊離する時に、どの位置のトリグリセリド(1 位、2 位、3 位)を加水分解するのかはリパーゼの種類により異なる。Lipase AS "Amano"や Lipase M "Amano" 10 が比較的に 1,3 位特異的に分解し、Lipase AYS"Amano"は非特異的に分解する特徴をもつ。また Lipase G "Amano" 50はトリグリセリドに作用しないがジグリセリド、モノグリセリドに作用するユニークな酵素である(表1)。
脂肪酸の鎖長特異性
トリグリセリドに結合している脂肪酸の鎖長(炭素数)は 2 ~ 24 前後と幅が広い。短鎖の脂肪酸結合、あるいは中鎖の脂肪酸結合及び長鎖の脂肪酸結合を良く加水分解するリパーゼに分類される(表1)。
反応様式
リパーゼの反応は可逆的であり反応条件により、エステル結合の合成も触媒できる。加水分解、エステル化反応、エステル交換反応がある。
アマノリパーゼの紹介
リパーゼは主に脂質の加水分解反応に関わる酵素であるが、基質特異性が広く種々のエステル化合物に作用し、高い立体選択性を示す。その為アルコールやカルボン酸の光学分割に利用されている。ただしリパーゼの由来によってその立体選択性は大きく異なるので、要求される立体構造によって最も適した性能のリパーゼを選択することになる。
リパーゼは動物以外にも、植物、微生物と広く分布しているが、その利用の多くが微生物由来のリパーゼとなっている。これは、遺伝子組換え技術等の菌株改良技術がすすみ、安定的に高発現させる製造技術が進んだ背景がある。また多種類のリパーゼが取得できるようになったことからその比較実験により、リパーゼの多様性が確認されつつある。
一般的に Burkholderia cepacia 及び、Candida antarctica 由来のリパーゼ剤の研究報告が多いことが知られている。以下にアマノリパーゼとその特徴的な酵素についてまとめる(表1)。
Lipase PS "Amano" SD
Lipase PS "Amano" SD は、Burkholderia cepacia 由来のアミノ酸数 320 のリパーゼで Candida antarctica 由来のリパーゼとともにキラル合成用途で研究報告例が多い酵素の一つである。選択性が非常に高いリパーゼであり、多数の報告例がある。スクリーニングを行う際にはまずは試してみる価値のある酵素剤である。
Lipase AK "Amano"
Lipase AK "Amano"は、Pseudomonas fluorescence 由来のアミノ酸数 320 のリパーゼで、Lipase PS "Amano" SDほどではないが、キラル合成用途のリパーゼとして有用な酵素剤である。Lipase PS "Amano" SD と類似したアミノ酸配列であるが、選択性に違いがみられるためこちらも供に試すことを推奨する。
Lipase AYS "Amano"
Lipase AYS "Amano" は Candida rugosa 由来の酵素剤でアミノ酸数は 534 である。選択性は概して良くないが大きなアルコールで良い選択性を示すことがある。油脂の 3 つの位置のエステル結合を同程度に非特異的に加水分解することが大きな特徴である。
市販酵素剤の中には、粗酵素品の場合があり、複数の酵素が混合された状態で存在しているものもある。また賦形剤が含まれてタンパク質含量も数% に過ぎない酵素剤もあり扱いの際には注意が必要である。
表1. アマノリパーゼの性質
| リパーゼ | 形態 | 油脂位置特異性 | 脂肪酸鎖長特異性 | 立体選択性報告例の数 |
|---|---|---|---|---|
| Lipase AS "Amano" | 粉末 | 1,3>>>2 | 短中鎖 | ☆☆☆ |
| Lipase AK "Amano" | 粉末 | 1,3>2 | 短中長鎖 | ☆☆☆☆ |
| Lipase AYS "Amano" | 粉末 | 無し | 短中長鎖 | ☆☆☆ |
| Lipase G "Amano" 50 | 粉末 | 無し | 中長鎖 | ☆ |
| Lipase M "Amano" 10 | 粉末 | 1,3>>>2 | 中長鎖 | ☆ |
| Lipase PS "Amano" SD | 粉末 | 1,3>2 | 短中長鎖 | ☆☆☆☆☆ |
| Lipase PS "Amano" IM | 固定化酵素 | 1,3>2 | 短中長鎖 | ☆☆☆☆☆ |
酵素のスクリーニング例
先にも述べたとおり目的となる光学活性体を選択する方法として酵素を利用する場合、基質ごとに反応性を評価する必要がある。ここでは光学活性体を得るための酵素を選択する一例として加水分解とエステル交換反応によるスクリーニング例を以下に示す。
加水分解反応
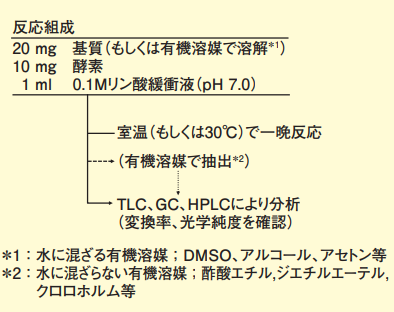
図1. 加水分解反応の操作概要
1mℓの終濃度 0.1M リン酸緩衝液(pH 7.0)に酵素粉末を 10mg 加えて溶解させる。さらに反応基質を 20mg加える。基質が不溶な場合は、そのまま懸濁させた状態で反応を行うか、数10%のアルコールやアセトンで混和させる方法をとることも可能である。
一晩撹拌させた後に、反応液を有機溶媒にて抽出して、TLC、GC、HPLC 等で生成物の有無や光学純度を確認する(図 1,2)。またトルエンなどの水と混和しない有機溶媒を用いて水との 2 相系を用いて行うこともできる。
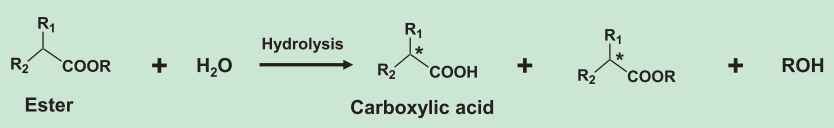
図2. 加水分解反応式例(* 不斉中心を示す)
エステル交換反応
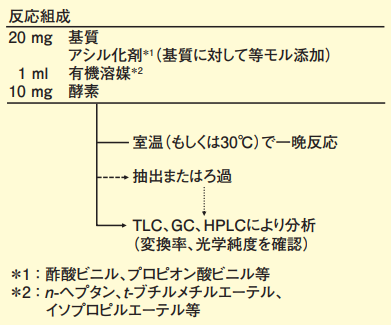
図3. エステル交換反応の操作概要
1mℓ の有機溶媒(n- ヘプタン等)に反応基質を 20 mg 加えて溶解させる。さらに酢酸ビニル等のアシル化剤を基質と等量モル以上加えて、酵素粉末もしくは固定化酵素を 10mg 加えて一晩撹拌反応させる。反応液からろ過や抽出により酵素を除いて、TLC、GC、HPLC 等で生成物の有無や光学純度を確認する(図 3,4)。

図4. エステル交換反応式例(* 不斉中心を示す)
有用な酵素が選別された場合には、さらに反応を最適化させることになるが、基質濃度、酵素濃度、溶媒、反応温度、アシル化剤(エステル交換の場合)の種類等を検討することになる。なお反応系に有機溶媒を用いる場合には、タンパクの失活や立体選択性に影響を与えることが知られており、使用溶媒には注意が必要である。また最適な酵素が見つからなくても、新たな酵素をスクリーニングするのではなく基質の構造を変えることで解決できる場合がある。化学法と異なり基質濃度がどこまで上げられるかは酵素法の大きな問題点であり最低でも 5 ~ 10% が望まれる。
固定化酵素の利用
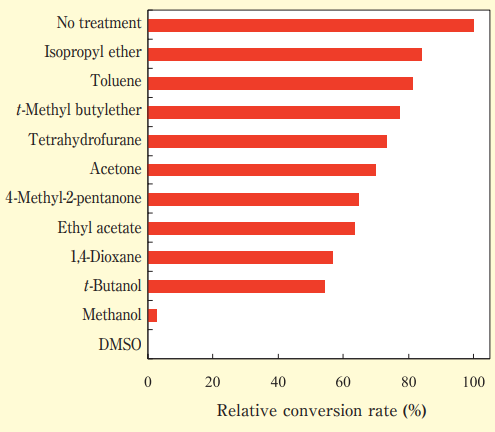
図5.各有機溶媒に対する Lipase PS "AMANO" IM の安定性
25℃、24 時間で各有機溶媒処理した後のエステル交換活性の残存率酵素の固定化は、有機溶媒中での反応性の向上、安定性の向上、繰り返し使用によるコストダウンなどが期待できることからプロセス開発における重要な項目となる。工業的には、抗生物質中間体である 6-APA の製造におけるペニシリンアシラーゼや光学活性アミノ酸製造におけるアミノアシラーゼなどが代表的な固定化酵素の実用化例である。
酵素の固定化には、一般的に担体結合法、架橋法、包括法が知られている。Lipase PS "Amano" IM は担体結合法により調製された固定化酵素であり、珪藻土に疎水的に吸着している。疎水結合による固定化酵素は立体構造の大きな変化を伴わずに結合していることが多い為、酵素本来の能力を維持できていることが多い。
Lipase PS"Amano" IM は従来の粉末品の Lipase PS "Amano" SD と比べてエステル交換活性が非常に高く、有機溶媒耐性も高い固定化酵素であり、特に有機溶媒を用いた微水系の反応に適した固定化酵素である(図 5)。
おわりに
医農薬分野において光学活性体の需要は高く、簡便で効率的な光学活性体の製造法の確率は今後とも重要になってくる。リパーゼの工業利用は、その目的にあったリパーゼを選択することが重要であるが、近年はバイオテクノロジー技術が進み、目的遺伝子の機能改変に関する報告が多くされている。今後は、有用な酵素を効率よく探索し、目的の基質にあったリパーゼに改変するなどテーラメイド酵素の開発に対応していく必要がある。
参考文献
- 井上國世 監修:「酵素応用の技術と市場 2015」(シーエムシー出版)(2015).
- 日本酵素協会「日本高所産業小史」ワーキンググループ編」:「日本酵素産業小史」(日本酵素協会)(2009).
- 吉岡龍臧 監修:「光学活性医薬品開発とキラルプロセス化学技術」(サイエンス&テクノロジー)(2011).
- 国立科学博物館産業技術史資料情報センター編:国立科学博物館技術の系統化調査報告, 14,(173)(2009).
- 赤井周司:生産と技術,66(2),57 (2014).
- 天野エンザイム株式会社ホームページ http://www.amano-enzyme.co.jp/jp/




