【総説】植物組織透明化試薬 ClearSee® の開発
本記事は、和光純薬時報 Vol.84 No.4(2016年10月号)において、名古屋大学大学院理学研究科 栗原 大輔 様に執筆いただいたものです。
はじめに
蛍光タンパク質のめざましい発展により、今日では細胞やオルガネラだけではなく、タンパク質一分子までも蛍光タンパク質で標識して可視化できるようになっている。可視化された細胞やオルガネラ、分子の挙動を観察することで、生物のからだの成り立ちや構造、機能が解析されている。しかし、植物細胞はさまざまな自家蛍光物質を持っているため、無傷のまま、植物内部に存在する細胞の蛍光タンパク質を観察することは未だ難しいのが現状である。さらに、植物組織は屈折率の異なるさまざまな成分(空気 1.00 ; 細胞壁 1.42 ; 細胞質 1.36)で構成されるため、屈折率のミスマッチにより光の散乱が引き起こされる。
そのため、これまで植物組織の内部を高解像度で観察するためには、機械的に組織を切断して作製した切片を観察するしか方法はなかった。しかし、切片から三次元構造を再構築するためには、膨大な数の連続した切片を欠かすことなく作製し観察しなければいけないため、熟練した技と根気のいる作業が必要であった。
そのため、切片を作製せずに無傷のまま観察するために、古くから種々の化合物を用いて、植物組織を透明化する手法が用いられてきた。19 世紀後半から標本の保存に用いられている抱水クロラールは、高い屈折率(1.428)をもち、種々の植物組織を透明化できるため、植物内部の細胞を観察するために用いられてきた。しかし、抱水クロラールは蛍光タンパク質を消光してしまうため、蛍光タンパク質と組み合わせて観察することはできなかった。
近年、脳研究分野において、屈折率ミスマッチを解消したり、着色成分を除くことで、組織を透明化できるさまざまな化合物混合溶液が開発されてきている。開発されている透明化試薬は水溶液であり、蛍光タンパク質の蛍光を保持しながら透明化することに成功している。
開発の口火を切ったのが、理化学研究所の宮脇博士らが開発した Scale である。尿素、界面活性剤、グリセロールからなる Scale 溶液は、蛍光タンパク質の蛍光を保持しながらマウス脳の透明化に成功した。Scale 処理したマウスの脳は、共焦点レーザー顕微鏡を用いて表面から 1.6 mm の内部まで観察可能である 1)。
高濃度のフルクトース水溶液である SeeDB は、界面活性剤や変性剤を含まずに、屈折率ミスマッチを解消し、マウス胚や脳を透明化することに成功している 2)。Scale はマウス脳の透明化に 2 週間処理時間が必要であるが、SeeDB は 3日間に短縮できる。
2015 年に発表された CUBIC は、Scale を改良した透明化試薬で、マウスの脳だけではなく全身の透明化まで成功している 3, 4)。Susaki らは透明化試薬の構成成分を化合物スクリーニングすることにより、アミノアルコールが透明化活性の高い化合物であることを発見した 3)。さらにアミノアルコールは血液のヘム色素を除去する作用も持っていたため、全身の透明化に繋がった 4)。
このように、数々の透明化試薬が登場し、今も開発が続いている現状であるが、植物組織にこれらの透明化試薬をそのままでは用いることはできなかった。動物には動物特有の、植物には植物特有の組織、細胞から構成され、それぞれ蛍光観察を妨げる自家蛍光物質も異なっているため、新たに植物用に最適化した透明化試薬を開発する必要があった。
ClearSee® の開発
そこで我々は蛍光タンパク質の蛍光を保持しながら、植物組織を透明化できる試薬を開発するために、化合物スクリーニングを行った。ターゲットにしたのが、クロロフィルによる自家蛍光である。Scale や CUBIC で用いられる透明化試薬は、多価アルコール・界面活性剤・尿素から構成される。そこで、緑色の葉からクロロフィルの自家蛍光を取り除くことができる化合物を、多価アルコール・界面活性剤・尿素を含む 24 種の化合物から探索した。
シロイヌナズナの葉を 7 日間、それぞれの化合物水溶液に浸して、葉から溶出したクロロフィル自家蛍光を測定した結果、デオキシコール酸ナトリウム、N- ドデカノイルサルコシン酸ナトリウム、Tween 20、 ノニデット P-40、ドデシル硫酸リチウム(LDS)、ドデシル硫酸ナトリウム(SDS)、N,N-ジメチルホルムアミドといった界面活性剤が高い溶出活性を示した。これらの化合物の蛍光タンパク質への影響を解析した結果、LDS は蛍光タンパク質を完全に消光し、Tween 20 と SDSは 6 〜 7 割にまで蛍光が減少してしまったが、それ以外の化合物では蛍光タンパク質の蛍光は保持されていた。
次に、界面活性剤に加えて多価アルコールの透明化効果を評価するために、界面活性剤・多価アルコールの組み合わせでスクリーニングを行ったところ、デオキシコール酸ナトリウム、N- ドデカノイルサルコシン酸ナトリウムを含む混合溶液が高い透明化活性と蛍光タンパク質保持性を示した。
最後に尿素を加えてスクリーニングを続けた結果、キシリトール、デオキシコール酸ナトリウム、尿素の組み合わせが最も高い透明化活性と蛍光タンパク質保持性を示したことより、この混合溶液を植物透明化試薬「ClearSee®」と名付けた 5)。
ClearSee® による植物組織の透明化効果を評価するために、PBS、抱水クロラール透明化液、Scale、ClearSee® で 4 日間、葉を処理した結果、Scale 処理葉は緑色が残っているが、ClearSee® 処理葉ではクロロフィルがなくなり透明になった(図1)。この透明度は、抱水クロラール透明化液処理と同等であった。
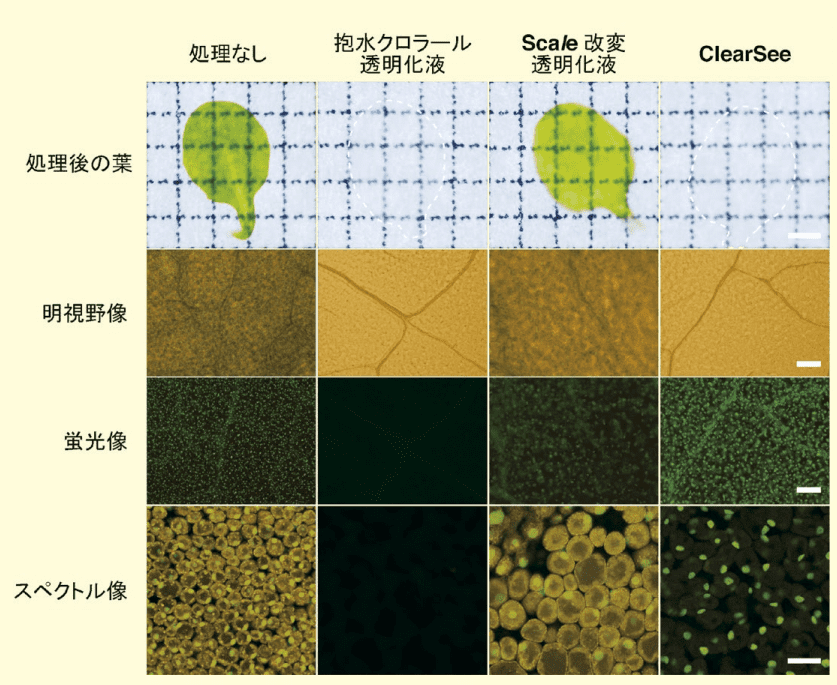
図1.各種透明化液で 4 日間処理したシロイヌナズナの葉
処理後の葉と明視野像で緑色に見えているのがクロロフィルである。蛍光像では、細胞核を蛍光タンパク質で標識しているため、粒状に観察される。スペクトル像で橙色に見えているのがクロロフィルの自家蛍光である(スケールバーは上段:1 mm、中・下段:30 µm)。文献5より改変。また、蛍光タンパク質への安定性を評価するために、核を緑色蛍光タンパク質 Clover(H2B-Clover)で標識した葉を、それぞれの透明化液で 4 日間処理したところ、Scale 処理葉においては、PBS 処理と同等にしか H2B-Cloverの蛍光は観察できなかった。これはクロロフィルがあまり除かれていないのが要因だと考えられる。また、抱水クロラール透明化液で蛍光タンパク質の蛍光は消失してしまった。一 方、ClearSee® 処理した葉を観察したところ、表面の細胞だけではなく、内部にある維管束の細胞核も全て検出できるほどの透明度を達成した。
図1下段はスペクトルイメージングにより葉の細胞を観察したものだが、PBS と Scale処理細胞では細胞の周縁部にオレンジ色のクロロフィル自家蛍光が検出されるが、ClearSee® 処理細胞では検出されず、緑色の H2B-Clover のシグナルだけが検出された。一方、抱水クロラール透明化液処理細胞では、クロロフィル自家蛍光も H2B-Clover の蛍光も消失している。このように、ClearSee® によりクロロフィルを除去し、植物を丸ごと透明化することで、植物を切断することなく内部まで蛍光観察することが可能となった。
ClearSee® による多色蛍光観察
ClearSee® は緑色以外の蛍光タンパク質の蛍光も保持したまま透明化が可能である。図2は全身の細胞核を橙色蛍光タンパク質で、植物ホルモンであるオーキシンに応答している細胞核を黄色蛍光タンパク質で標識したシロイヌナズナの根の観察像だが、ClearSee® 処理した根でも、生きたままの根と同様に、オーキシン応答などの遺伝子発現パターンは保持したまま、透明化されていることが分かる。

図2.ClearSee 処理後も遺伝子発現は保存されている
ClearSee 溶液で 4 日間処理したシロイヌナズナの根。重ね合わせ像では、オーキシン応答細胞の核を緑色、全身の細胞核を紫色で示す(スケールバーは 30 µm)。文献5より改変。また、ClearSee® 処理したサンプルの蛍光シグナルが強く検出されており、透明化することによって光の散乱が抑えられ、蛍光タンパク質を光らせる励起光も、蛍光タンパク質から発した蛍光も無駄なく利用することができると言える。そのため、発現量の少ないタンパク質を観察するのにも適しており、また励起光を弱くしても観察できるので、サンプルにダメージの少ない蛍光観察が可能となる。
このようにさまざまな色の蛍光タンパク質を利用すると、細胞核と細胞膜など違う細胞内構造を区別して観察することもできるが、同じような細胞でも区別して観察することができる。
図3はめしべの中に花粉が侵入している様子を蛍光観察したものである。花粉は花粉管という管をめしべの中に伸ばして受精を行うが、めしべの中心を通っていくため、これまでその様子を観察することは容易ではなかった。また、花粉管を観察するためには、アニリンブルーという蛍光試薬で染色する必要があったが、すべての花粉管を青く染色してしまうため、個々の花粉管を区別することはできなかった。
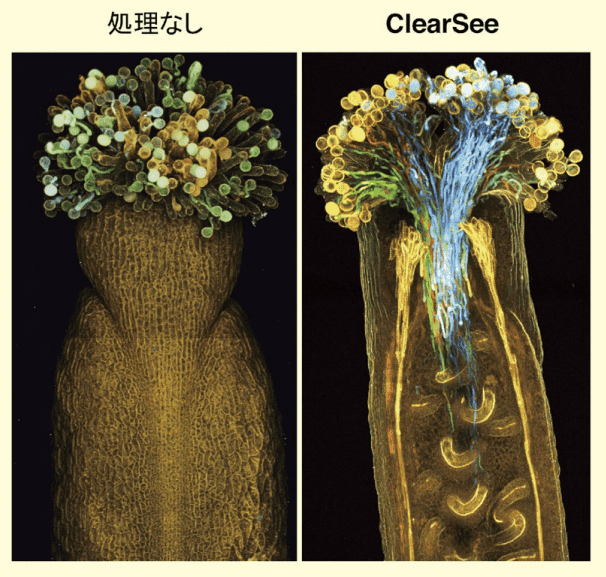
図3.ClearSee により透明化しためしべを丸ごと蛍光観察
花粉管を4色の蛍光タンパク質(青色、緑色、黄色、赤色)で目印をつけている(左:処理なし、右:ClearSee による透明化処理)。しかし、蛍光タンパク質を利用すれば、青色蛍光タンパク質を発現する植物、緑色蛍光タンパク質を発現する植物というように、それぞれ違う色の蛍光タンパク質を花粉で発現する植物を作製することで、異なる個体由来の花粉を区別して観察することが可能である。これを利用して、遺伝子型や種が異なる花粉管の色を変えて区別することで、めしべの中で互いに競争を行っているのかなどを解析することがはじめて可能となった。
ClearSee® の利用
ClearSee® による透明化の特徴として、これまで述べてきたような、各種蛍光タンパク質の蛍光を保持しながら透明化できること、低侵襲な蛍光観察ができることに加えて、ClearSee® 処理したサンプルは長期間保存できることが挙げられる。
図3のめしべは、半年間 ClearSee® 溶液内で保存したサンプルであるが、蛍光タンパク質を損なうことなく、蛍光観察ができていることが分かる。長期間保存することができるため、一度観察したサンプルも、再び ClearSee® 溶液内で保存しておけば、繰り返し蛍光観察することが可能である。
ClearSee® を用いた透明化の手順は非常に簡単であり、組織の固定化、洗浄、透明化の 3 つの工程だけである。
まず、植物を 4% パラホルムアルデヒド溶液に 30 〜 120 分浸けて組織を固定する。植物組織の固定化にはパラホルムアルデヒド溶液の他に、酢酸・エタノール混合液といった有機溶媒を用いる方法もあるが、有機溶媒は蛍光タンパク質を消光してしまうため、用いることはできない。
固定化の後、パラホルムアルデヒド溶液を除き、PBSで組織を洗浄した後、ClearSee® 溶液に室温で浸けておくだけで透明化が始まる(図4)。根だと 1 〜 2 日間、若い葉だと 3 〜 4 日間、成熟した茎やめしべなどは 2 週間〜 4 週間、透明化処理に時間を要する。
このように ClearSee® を用いることで、植物全身を透明化することが可能である(図4)。
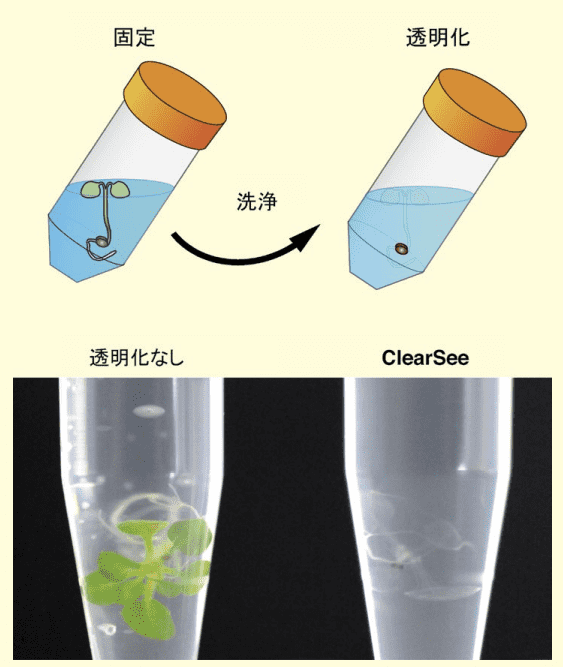
図4.ClearSee による植物透明化の手順
下段はシロイヌナズナの幼植物(左:処理なし、右:ClearSee による透明化処理)。またモデル植物であるシロイヌナズナだけではなく、作物であるタバコ、トマト、キュウリ、園芸植物であるトレニア、ペチュニアなど幅広い植物で利用することもできる(図5)。

図5.ClearSee で6日間処理した各植物の葉
ClearSee® を利用する際の注意点として、細胞構造やタンパク質局在を保ったまま透明化するためには、組織を固定するステップが重要である。パラホルムアルデヒド溶液による固定化の最適な条件は、植物種、また組織によっても異なってくる。まずは、固定化後のサンプルを観察して、細胞構造は保っているか、蛍光タンパク質は観察できているかを確認して、固定処理時間などを検討することが重要となる。
おわりに
これまで生体内部組織を直接蛍光観察するためには、深部観察に特徴を持つ二光子励起顕微鏡を利用しなければならなかった。しかし、二光子励起顕微鏡は非常に高価であり、全ての研究者が気軽に使用できるほどにはまだ普及しておらず、さらに植物においては、二光子励起顕微鏡を用いたとしても深部観察は困難であった。
今回開発した ClearSee® で透明化することで、共焦点レーザー顕微鏡を用いて、二光子励起顕微鏡と同等に内部まで蛍光観察し、また取得した画像を用いて、植物組織を立体再構築することも可能である。また、レーザーを光源としない一般的な蛍光顕微鏡であっても、ClearSee® 処理した植物組織は内部まで蛍光観察できるため、ClearSee® による蛍光観察は多くの植物研究者が利用できる技術である。
今後、ClearSee® が普及することで、植物科学研究が加速していくことを期待している。
参考文献
- Hama, H. et al. : Nat. Neurosci., 14, 1481-1488 (2011). DOI: 10.1038/nn.2928
- Ke, M. T. et al. : Nat. Neurosci., 16, 1154-1161 (2013). DOI: 10.1038/nn.3447
- Susaki, E. A. et al. : Cell, 157, 726-739 (2014). DOI: 10.1016/j.cell.2014.03.042
- Tainaka, K. et al. : Cell, 159, 911-924 (2014). DOI: 10.1016/j.cell.2014.10.034
- Kurihara, D. et al. : Development, 142, 4168-4179 (2015). DOI: 10.1242/dev.127613





