【特別講座】Advances in Cross-Coupling using Johnson Matthey's Palladium Pre-Catalysts.
本記事は、OrganicSquare Vol.57 (2016年9月号)において、Johnson Matthey PLC Jesse R. McAtee; Gabriela A. Grasa; Suguru Minami(訳)に執筆いただいたものです。

急速な広がりを見せるPd均一系触媒は、複雑な有機物質の合成に対して非常に効率的で有効な手法である。Johnson Mattheyはこれまで特許技術の構築、論文、また幅広い種類の触媒の提供や工業分野のみならず学術分野に対してもこれらの技術を通して大きく貢献してきた。フェロセン系の配位子や触媒の工業生産、L2Pd(0)触媒の生成メカニズム考察、低配位/高活性なL1Pd(0)を生成する新規触媒技術等は特に顕著である。最近工業生産化したPhosphine π-Allyl Pd触媒はその一例である。ここでは特に成長著しく、工業的にも重要なPdクロスカップリング反応に関するデータを紹介する。
クロスカップリング反応に関する歴史と最近の動向はこれまでにも度々紹介されてきた1-3)。溝呂木とHeckが同時期に行った先駆的業績の後、Pd触媒によるC-C結合形成は比較的一般的な反応になった4,5)。これらの反応の始まりはColacotによるHeck Obituaryに記されている6)。Heckによって提唱されたメカニズムは非常に重要であり、この発見により新しい合成方針を適用できるようになった。Heck反応はトランスメタレーション試薬が不要なC-H活性化反応である。
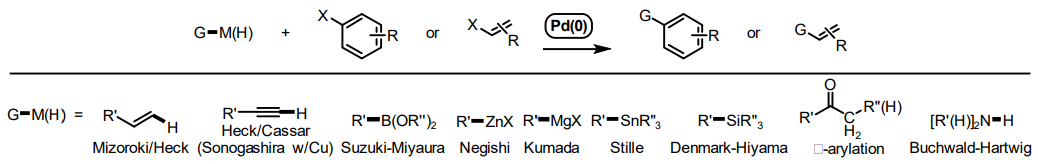
Figure 1. General scheme for palladium catalyzed cross-coupling reactions.
一方、鈴木-宮浦7)、根岸8)、熊田9)、Stille10) 及び檜山-Denm ark11,12) 反応は、有機金属試薬(求核剤)と求電子試薬(ハロゲン化アリルまたはビニル)間で起こる一般的なクロスカップリングに分類される。パラジウム触媒クロスカップリング反応の一般的な反応式をFigure 1に示す13)。
これらクロスカップリング反応の効率、適用範囲、選択性の向上は、多くのグループにより広く研究され14,15 )、配位子の立体配置や電子状態の微調整や、配位子と金属の割合をコントロールすることにより、大きな成果が報告されている16-18)。
Johnson Mattheyは幅広いPd触媒の提供のみならず、クロスカップリング技術の発展にも重要な役割を果たしてきた14)。
Johnson Mattheyは初めてPreformed 触媒の優位性を特定し、商業生産化した会社である。特にFigure 2, aのようなフェロセン系触媒において顕著である19,20)。
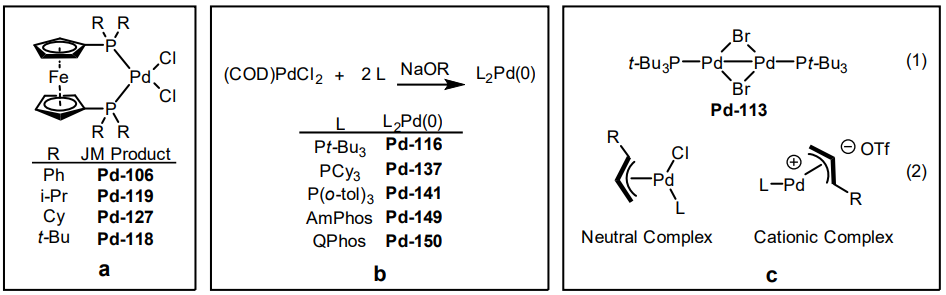
Figure 2. Examples of JOHNSON MATTHEY's contributions to crosscoupling technology.
例えばColacotのグループは、困難なアリールクロライドの鈴木-宮浦カップリング (Figure 3)21)やα-アリル化に対し、少量の触媒、且つ温和な条件下で、空気中で安定なPreformed 触媒であるPd118が有効であり、in-situ systemよりも優れたパフォーマンスを示すことを報告している22)。
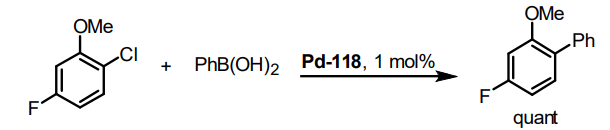
Figure 3. Challenging Suzuki-Miyaura reaction using Pd-118.
触媒活性種の形成は、一般的にPd(II)からPd(0)に還元するための条件が必要である。反応メカニズムを考察し、Colacotのグループは、容易に入手可能なPd(II) 前駆体を還元し、L2Pd(0) 触媒を生成するための一般的で経済的な方法を開発し(Figure 2, b) 23,24) 、Johnson Mattheyは多くの高活性なPd(0)触媒を商業化できるようになった。これらのPd(0)触媒は空気や光に不安定であるが、多くの特徴的で高い選択性を要する反応に有効で25)、一般的に広く使用されているtetrakis triphenylphosphine palladium (0)同様、反応窯への仕込み程度の短い時間であればその不安定性も許容できるため工業プロセスで使用されている。これらのPd(0)触媒はPd(0)触媒Kit (Figure 2, b:5種類各1g)として購入可能である。
初期のKoieとFuの研究により、嵩高く電子リッチな単座配位ホスフィン配位子26)と金属の割合が1:1であり、高活性なPd触媒に対し有効であることが示された18)。2002年にJohnson MattheyはPtBu3とPdの割合が化学両論的に1:1である高活性な12電子触媒であるPd-113を商業化した[Figure 2, c (1)] 27,28)。 この触媒は、低配位子率だけでなく、PtBu3配位子単体が持つ発火性がない点でも有用である。
低配位Pd触媒の有用性はBuchwaldによるbi-arly配位子の研究の後、一層顕著になった29)。近年、彼のグループは配位子と金属の割合が1:1の第4世代のpalladacycle触媒を開発し、最新のクロスカップリングに有用であることを示している30)。
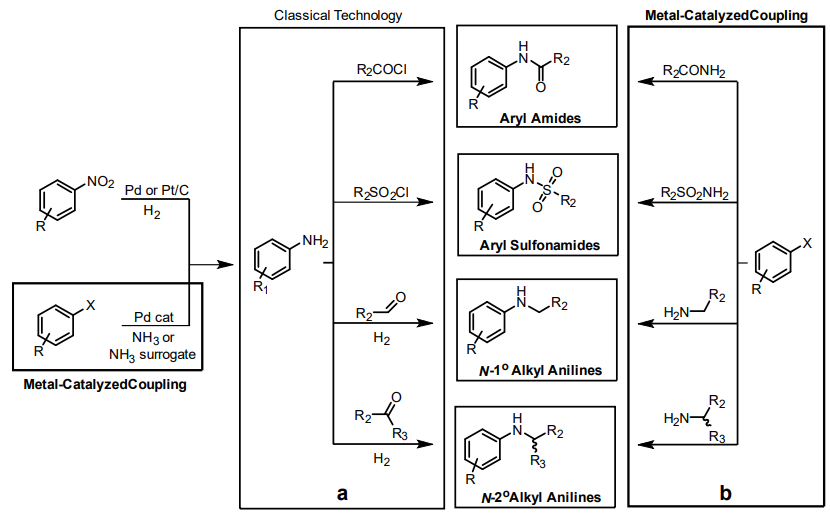
Figure 4. Using Buchwald-Hartwig technology to replace classical methods to install industrial relevant motifs.
Buchwald-Hartwigアミネーションはクロスカップリング反応の新しいトレンドの一つであり、aryl-nitrogen(C-N)結合の効率的な形成において工業的に重要である31,32)。アミン類のアリ―ル化は古典的で比較的非効率な方法と比べ、環境に配慮したプロセスである。以前は、アニリン類を生成する為にナイトレーションのようなより厳しい反応が必要であった33)。アニリン類は古典的な方法により医薬業界や農薬業界で使われる様々な官能基へ変換できる(Figure 4, a)。今日、これらの多くの重要骨格が、適切なアミン、アミド、またはスルホンアミドとハロゲン化アリールからBuchwald-Hartwig反応によって直接生成が可能である。(Figure 4, b)。
2011年Colacotらは新しい触媒骨格であるL-Pd[π-(R)allyl]Cl触媒を発表した(L = PtBu3, QPhos, AmPhos, and dtbNpP)。C-C及びC-Nクロスカップリング反応においてそれらの有用性が示され34,35)、また、最近になって、非配位のトリフレートを使うことで、より嵩高いBuchwald配位子も使用可能になった。それにより、アニオンを2番目の配位圏へ押し出すことで、求める空気中で安定なカチオン触媒が生成される[Figure 2, c (2)]36)。
いくつかの最もチャレンジングな基質でさえ、これらのPhosphine π-allyl Pd錯体より生成される触媒により、クロスカップリング反応を行うことが可能である(Figure 5)36,37)。さらに、これらの触媒は palladacycleの還元によって生じる発癌性物質のカルバゾールの生成を避けることができる。また、カルバゾールは転化率の抑制も報告されている38)。
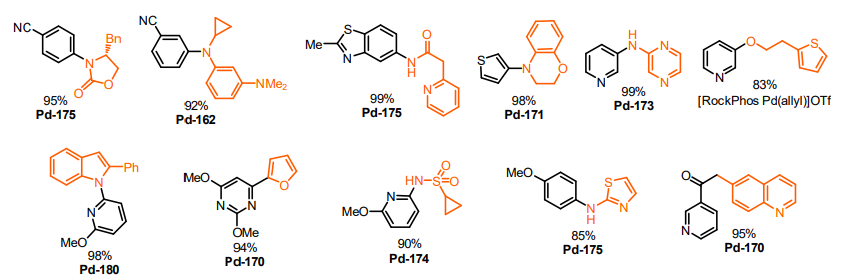
Figure 5. Select examples of challenging substrates cross-coupled using JOHNSON MATTHEY's Phosphine π-allyl Palladium Catalysts
Phosphine π-allyl Pd触媒は最先端のJohnson Matthey社の技術であり、非常に問い合わせが多く、すでに工業用途でも数㎏販売され、また、各1gの触媒Kit (Figure 6)も購入可能である。おそらく新しい技術が商業的に入手可能になったため、クロスカップリング技術は今後より一般的になってくと思われる。また、数多くの特許や論文がこの20年間に指数関数的に発表されてきた(Figure 7)39)。
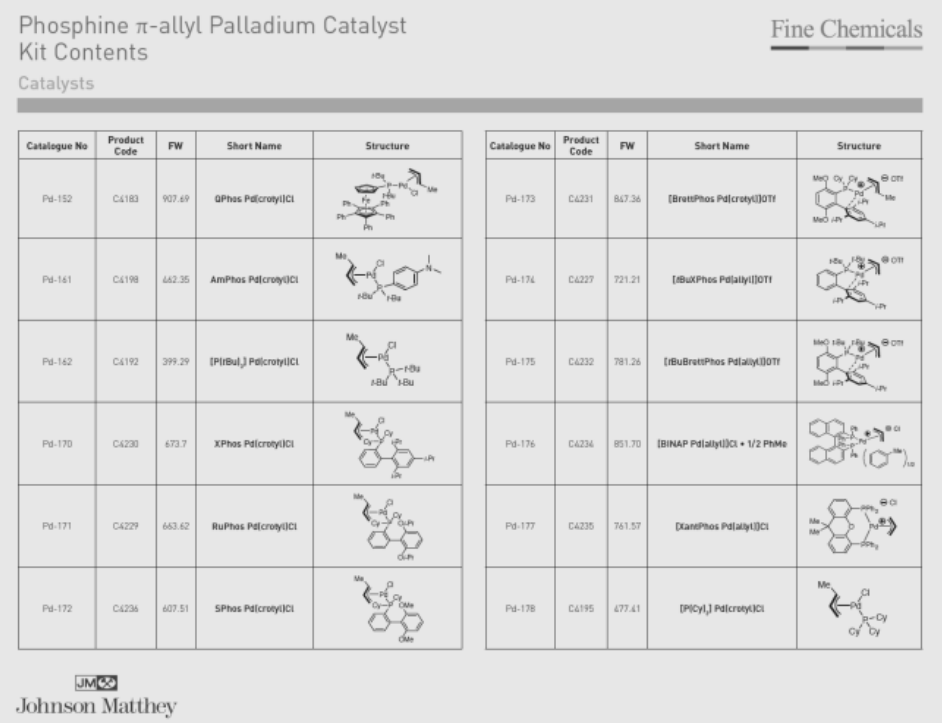
Figure 6. Details of the latest cross-coupling kit offered by Johnson Matthey
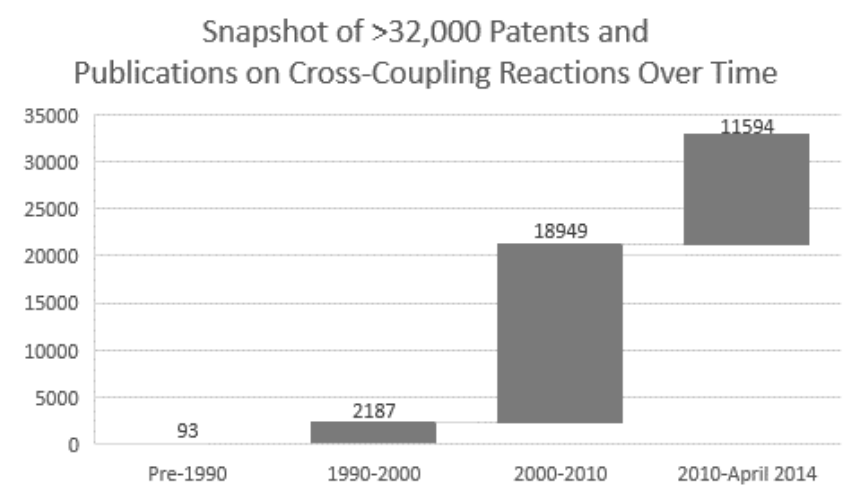
Figure 7. Exponential growth in the field of cross-coupling.
過去5年間に上市された薬品をみると、cross-coupling が医薬業界に浸透してきたのがよく分かる(Table 1)40)。例えば2015年には34の先発医薬品が上市され、これらの製造に18のcross-coupling が使用されている41)。
Table 1. Number of Drugs Launched and respective cross-coupling steps in the last 5 years.
| Launch Year | Number of Drugs Launched | Number of Transformations Using Cross Coupling |
|---|---|---|
| 2011 | 26 | 11 |
| 2012 | 18 | 8 |
| 2013 | 25 | 9 |
| 2014 | 37 | 17 |
| 2015 | 34 | 18 |
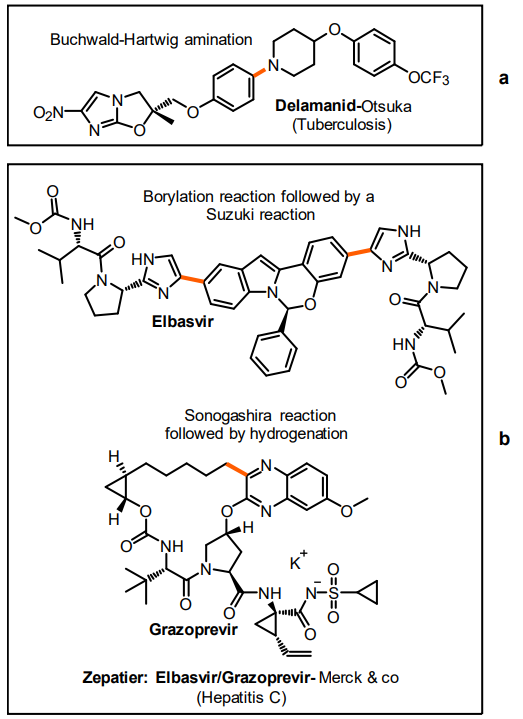
Figure 8. Examples of drugs that employ cross coupling.
cross-couplingを採用した上市薬品2例をFigure 8に示した。Delamanidは大塚製薬によって上市された結核治療薬であり、アニリン部はBuchwald-Hartwig反応 (Figure 8, a)が用いられている42)。ZepatierはElbasvirとGrazoprevirからなる混合薬で、Merck & co. によって作られたC型肝炎治療薬である(Figure 8, b)。これら2つの薬品はそれぞれ鈴木-宮浦カップリングと薗頭カップリングのボリル反応を利用している43,44)。上記のクロスカップリング反応 はFigure 8に示されている橙色の太字の結合を生成するのに使われている。Johnson Mattheyは上記のような反応に対し、商業的に使用可能な触媒や技術サービスを提供している。
Johnson Mattheyの役割は、高品質な製品の製造や高い技術サービスの提供会社として、独自技術の構築や工業及びアカデミアの双方で利用可能な新しい技術の開発によりクロスカップリングの発展を加速させることにある。クロスカップリング反応は工業的に使用され、人々の生活を向上させる多くの新薬の合成に使用されている。
Johnson Mattheyは、触媒反応ガイドthe Catalytic Reaction Guide (CRG)を開発しており、無料のアプリケーションとして入手可能である。CRGには均一、不均一およびキラル触媒 分野における150種類以上の反応に対する反応条件や推薦触媒が掲載されており45)、また触媒の最新情報は以下のサイト http://www.jmfinechemicals.com/catalysts/ にて入手可能である。
(acknowledgement to Thomas Colacot for his discussions and advice.)
参考文献
- Johansson Seechurn, C. C. C., DeAngelis, A., Colacot, T. J.:New Trends in Cross-Coupling: Theory and Applications ; The Royal Society of Chemistry, pp 1-19 (2015).
- Johansson Seechurn, C. C. C., Kitching, M. O., Colacot, T. J., Snieckus, V.:Angew. Chem. Int. Ed., 51 (21), 5062-5085 (2012). DOI: 10.1002/anie.201107017
- Gildner, P. G., Colacot, T. J.:Organometallics, 34 (23), 5497-5508 (2015). DOI: 10.1021/acs.organomet.5b00567
- Heck, R. F., Nolley, J. P.:J. Org. Chem., 37 (14), 2320-2322 (1972). DOI: 10.1021/jo00979a024
- Mizoroki, T., Mori, K., Ozaki, A.:Bull. Chem. Soc. Jpn., 44 (2), 581-581 (1971). DOI: 10.1246/bcsj.44.581
- Colacot, T.:Angew. Chem. Int. Ed., 54 (52), 15611-15612 (2015). DOI: 10.1002/anie.201510300
- Miyaura, N., Suzuki, A.:Chem. Rev., 95 (7), 2457-2483 (1995). DOI: 10.1021/cr00039a007
- King, A. O., Okukado, N., Negishi, E.:J. Chem. Soc. Chem. Commun., No. 19, 683-684 (1977). DOI: 10.1039/C39770000683
- Tamao, K., Sumitani, K., Kumada, M.:J. Am. Chem. Soc., 94 (12), 4374-4376 (1972). DOI: 10.1021/ja00767a075
- Stille, J. K.:Angew. Chem. Int. Ed. Engl., 25 (6), 508-524 (1986). DOI: 10.1002/anie.198605081
- Hatanaka, Y., Hiyama, T.:J. Org. Chem., 53 (4), 918-920 (1988). DOI: 10.1021/jo00239a056
- Denmark, S. E., Regens, C. S.:Acc. Chem. Res., 41 (11), 1486-1499 (2008). DOI: 10.1021/ar800037p
- Note: base is required in many of these reactions for activating the coupling partner for transmetalation or promoting reductive elimination and mopping up resulting acid formed in the case of b-hydride elimination.
- Colacot, T. :New Trends in Cross-Coupling ; RSC Catalysis Series; The Royal Society of Chemistry,(2015).
- Echavarren, A. M., Cárdenas, D. J.:Metal-Catalyzed Cross-Coupling Reactions ; Wiley-VCH Verlag GmbH (2004).
- Littke, A. F., Fu, G. C.:Angew. Chem. Int. Ed., 41 (22),4176-4211(2002). DOI: 10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U
- Christmann, U., Vilar, R.:Angew. Chem. Int. Ed., 44 (3), 366-374 (2005). DOI: 10.1002/anie.200461189
- Littke, A. F., Dai, C., Fu, G. C.:J. Am. Chem. Soc., 122 (17), 4020-4028 (2000). DOI: 10.1021/ja0002058
- Colacot, T. J., Qian, H., Cea-Olivares, R., Hernandez-Ortega, S.:J. Organomet. Chem., 637-639, 691-697 (2001).
- Note: Pd- contains a CH2Cl2 adduct. Pd-146 is a solvent free variant of this catalyst that was later introduced 106AD.
- Colacot, T. J., Shea, H. A.:Org. Lett., 6 (21), 3731-3734 (2004). DOI: 10.1021/ol048598t
- Grasa, G. A., Colacot, T. J.:Org. Lett., 9 (26), 5489-5492 (2007). DOI: 10.1021/ol702430a
- Li, H., Grasa, G. A., Colacot, T. J.:Org. Lett., 12 (15), 3332-3335 (2010). DOI: 10.1021/ol101106z
- Colacot, T. J., Grasa, G. A.,Li, H. (2010).
- Thomas Colacot: Platin. Met. Rev., 56 (2), 110-116 (2012). doi: 10.1595/147106712x634774
- Nishiyama, M., Yamamoto, T., Koie, Y.:Tetrahedron Lett., 39 (7), 617-620 (1998). DOI: 10.1016/S0040-4039(97)10659-1
- Colacot, T. J. :In Encyclopedia of Reagents for Organic Synthesis ; John Wiley & Sons, Ltd, (2001).
- Colacot, T. J., Hooper, M. W., Grasa, G. A. (2011).
- Surry, D. S., Buchwald, S. L.:Angew. Chem. Int. Ed., 47 (34), 6338-6361 (2008). DOI: 10.1002/anie.200800497
- Note: Johnson Matthey offers a variety of Buchwald ligand and palladacycle precatalysts. For more details, please visit our website at http://www.jmfinechemicals.com/catalysts/.
- Paul, F., Patt, J., Hartwig, J. F.:J. Am. Chem. Soc., 116 (13), 5969-5970 (1994). DOI: 10.1021/ja00092a058
- Guram, A. S., Buchwald, S. L.:J. Am. Chem. Soc., 116 (17), 7901-7902 (1994). DOI: 10.1021/ja00096a059
- Cerfontain, H.: Recl. Trav. Chim. Pays-Bas, 109 (12), 594-594 (1990). DOI: 10.1002/recl.19901091207
- Hill, L. L., Crowell, J. L., Tutwiler, S. L., Massie, N. L., Hines, C. C., Griffin, S. T., Rogers, R. D., Shaughnessy, K. H., Grasa, G. A., Johansson Seechurn, C. C. C., Li, H., Colacot, T. J., Chou, J., Woltermann, C. J.:J. Org. Chem., 75 (19), 6477-6488 (2010). DOI: 10.1021/jo101187q
- Johansson Seechurn, C. C. C., Parisel, S. L., Colacot, T. J.:J. Org. Chem., 76 (19), 7918-7932 (2011). DOI: 10.1021/jo2013324
- DeAngelis, A. J., Gildner, P. G., Chow, R., Colacot, T. J.:J. Org. Chem., 80 (13), 6794-6813 (2015). DOI: 10.1021/acs.joc.5b01005
- Surry, D. S., Buchwald, S. L.:Angew. Chem. Int. Ed., 47 (34), 6338-6361 (2008). DOI: 10.1002/anie.200800497
- Tsuda, H., Hagiwara, A., Shibata, M., Ohshima, M., Ito, N.:J. Natl. Cancer Inst., 69 (6), 1383-1389 (1982).
- Colacot, T. J. :Platin. Met. Rev., 55 (2), 84-90 (2011).
- Source: Johnson Matthey Catalysis and Chiral Technologies, Thomson Reuters (2016).
- Note: some drug synthetic routes may contain more than one cross-coupling step.
- Yamamoto, A., Shinhama, K., Fujita, N., Aki, S., Ogasawara, S., Utsumi, N. (2011).
- Li, H., Belyk, K. M., Yin, J., Chen, Q., Hyde, A., Ji, Y., Oliver, S., Tudge, M. T., Campeau, L.-C., Campos, K. R.:J. Am. Chem. Soc., 137 (43), 13728-13731 (2015).
- Xu, F., Desmond, R., Humphrey, G. R., Li, H., QI, J., Ruck, R. T., Song, Z. J., Wang, T., Zhong, Y. L., Park, J. (2015).
- The CRG can be downloaded on any mobile device or accessed via a web browser at http://jmcct.com/catalytic-reaction-guide.




