【総説】超高親和性を有する新規アフィニティータグシステム"PA タグシステム"
本記事は、和光純薬時報 Vol.82 No.4(2014年10月号)において、大阪大学 蛋白質研究所 高木 淳一先生、藤井 勇樹先生、東北大学大学院 医学系研究科 加藤 幸成先生、金子 美華先生に執筆いただいたものです。

はじめに
蛋白質の機能を解析する上で純度が高い蛋白質を得ることは非常に重要である。現在蛋白質精製において、最もポピュラーな手法としてアフィニティータグシステムがある。なかでも「エピトープタグ」と総称される、ペプチドタグとそれに対するモノクローナル抗体からなるシステムは、FLAG、HA、Myc 等の多くの種類のタグが開発され、販売されている。
しかし、どのタグシステムも一長一短であり、欠点全てが克服されたようなタグシステムはなかなか存在しない。そこで我々は、数々の欠点を克服した超高親和性を有する新規アフィニティータグシステム「PA タグシステム」を開発した 1)。
PA タグの起源
エピトープタグシステムで特に重要なことは、高い親和性と特異性を有するモノクローナル抗体とそれが認識するタグ(ペプチド)の組み合わせの存在である。PA タグシステムの場合は、rat IgG2a モノクローナル抗体 NZ-1と PA タグ(GVAMPGAEDDVV)がそれにあたる。しかし、そもそも NZ-1 はアフィニティータグシステムとして用いるために樹立されたものではない。
現在、よく用いられている HA タグシステムや Myc タグシステムも同様であり、もともとは目的蛋白質を検出するためにそれぞれの抗体が樹立されている(FLAG タグシステムのみは例外であり、アフィニティータグシステムとして用いるために抗体が開発されている)2, 3, 4, 5)。
そして、NZ-1 の元々のターゲット蛋白質がヒトのポドプラニンである。ポドプラニンは血小板凝集に関与する一回膜貫通型糖蛋白質であり、悪性癌細胞上などに高発現している。このポドプラニンに血小板上の C タイプレクチン CLEC-2 が結合すると血小板凝集が引き起こされ、癌細胞の血行性転移が誘発されてしまう 6)。
血小板凝集を抑制することは癌細胞転移の抑制につながると考えられるので、加藤らは血小板凝集を抑制するための抗ヒトポドプラニン抗体の樹立を試みた。その際得られた抗体が NZ-1 である 7)。NZ-1 は、ヒトポドプラニンの N 末端領域の 14 アミノ酸残基(EGGVAMPGAEDDVV)に対応する合成ペプチドを抗原として樹立された。
すると、NZ-1 はヒト細胞上のポドプラニンに対して非常に高い親和性を示し、かつヒトポドプラニンと CLEC-2 の結合も非常に良く阻害し、抗体医薬品としての可能性を十分に有していた 6, 8)。一方で NZ-1 は、抗原由来のリニアペプチドに対しても非常に高い親和性と特異性を有していたため、我々は NZ-1 が有するこれらの特性がアフィニティータグシステムとしても利用できるのではないかと考え、そのための研究を行った。
アフィニティータグシステムとしての確立
モノクローナル抗体とペプチドタグを用いたアフィニティータグシステムには多くのことが求められる。具体的には、多くの夾雑物の中から目的の蛋白質だけを得るための高い特異性、結合したタグ蛋白質がすぐに解離してしまわないための高い親和性、結合した蛋白質を活性を保ったままで溶出できる条件の存在、コスト削減のための複数回使用可能な長いカラム寿命、等である。これらの課題を多くクリアすることが良いタグシステムとしての条件である。
まずは、NZ-1 の抗原として用いられた 14 アミノ酸残基のペプチドのうち、必要最低限の長さの決定を試みた。タグの長さは短い方が使いやすく、タグが付加された蛋白質への影響も小さいためである。以前加藤らによって行われた ELISA によるエピトープマッピングの結果では、10 アミノ酸残基(GVAMPGAEDD)が結合のために最低限必要な長さであると示唆されていた 9)。そこで、より詳細な情報を得るために、表面プラズモン共鳴(SPR)を用いて 10, 12, 14 アミノ酸残基の3種類の長さのタグと NZ-1 との親和性を比較した (図1)。
その結果、12, 14 残基ではほとんど親和性に変化は見られなかったが、10 残基では著しく解離速度が速くなってしまっており、親和性が大きく低下してしまっていた。
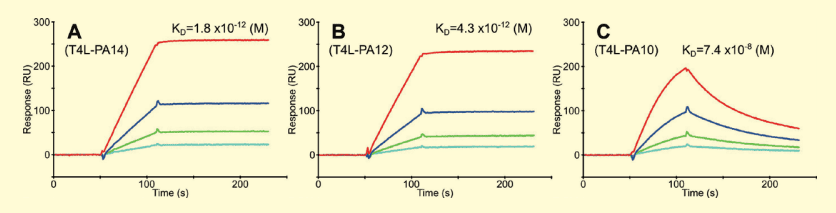
図1. SPR を用いた長さが異なる3種類の PA タグの親和性の比較
C 末端に3種類の長さの PA タグをそれぞれ付加したモデル蛋白質 T4 lysozyme(T4L) を NZ-1 を固定化したセンサーチップ上にインジェクトした。各 T4L は3.125、6.25、12.5、25 nM の4濃度でそれぞれインジェクションされ、1:1 binding model によってフィッティングを行い解離定数 (KD 値) を算出した。PA14 あるいは PA12 が付加された場合はほとんど差はなく、非常に遅い解離速度を保っているが、PA10 が付加された場合は明らかに解離速度が速くなってしまっており、KD 値も大きくなってしまっていた。このことから、超高親和性を維持するための必要最低限の長さの 12 残基のアミノ酸配列を PA タグと命名した。また、この時に得られた PA タグと NZ-1 の結合曲線の大きな特徴として、解離速度が非常に遅いという点が挙げられる。すなわち、この PA タグと NZ-1 をアフィニティータグシステムとして用いた場合、一度キャプチャーしたものはなかなか解離せず、「取りこぼし」が少ないと考えられた。事実、PA タグシステムを用いて目的蛋白質をキャプチャーした場合、目的蛋白質が 90% 以上キャプチャーできていることが確認できた (図2)。
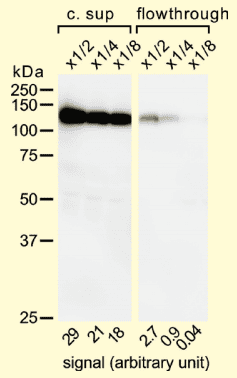
図2. 動物細胞発現系で発現させた PA タグを付加した蛋白質の結合量の評価
PA タグが付加された蛋白質を発現させた培養上清 (c.sup) と、NZ-1 セファロースにタグ蛋白質を結合させた後の flowthrough をウェスタンブロットすることによって、どれほどの量の蛋白質が NZ-1 セファロースに結合できているのか評価した。培養上清と flowthrough をトリスバッファーで 1/2、1/4、1/8 にそれぞれ希釈し、一次抗体に NZ-1 を用いてウェスタンブロットを行った。目的蛋白質の分子量である約 120 kDa のバンドの濃さをそれぞれ比較すると、培養上清のバンドに比べて flowthrough のバンドは明らかに薄く、90% 以上の蛋白質がレジンに結合できていることが確認できた。しかし、この特徴は一概に良い面ばかりではない。なぜならば、目的の蛋白質を得るためには、最終的には抗体とタグを解離させる必要があるが、あまりに結合が強いと、この解離が困難になる可能性があるからである。しかし、PA タグシステムにこの問題は存在しなかった。それは、抗体とタグの解離が低濃度の競合ペプチド(0.1 mg/ml)を用いれば十分に可能だったためである(図3)。
すなわち、ペプチドをトリスバッファーやリン酸バッファー等の生理的緩衝液に溶かして用いれば、目的蛋白質や抗体レジンにほとんどダメージを与えない非常にマイルドな条件での溶出も可能であるといえる。
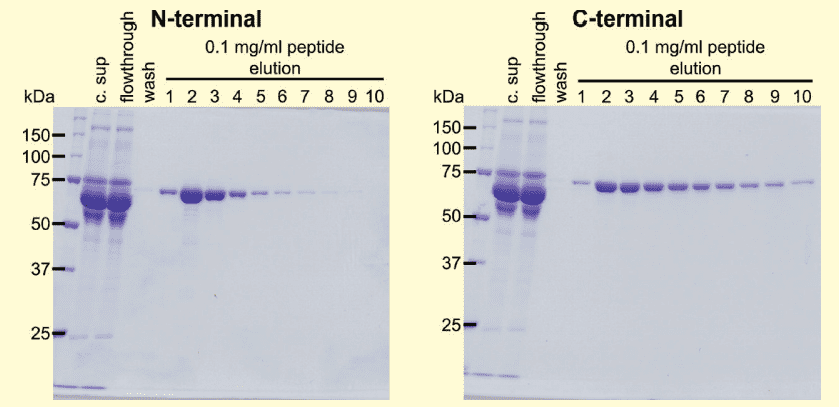
図3.PA タグを付加した血清蛋白質の HEK 細胞の発現上清からのアフィニティー精製
PA タグシステムを用いて、HEK 細胞の発現上清から血清蛋白質の精製を行った。c.sup が血清入りの発現上清、flowthrough が NZ-1 セファロース未結合フラクション、wash が 20 カラム容量洗浄後、elution がペプチドによる競合溶出フラクションを示している。その結果、PA タグは N 末端に付けた場合でも C 末端に付けた場合でも目的蛋白質のみを非常にきれいに精製することができた。また、wash の区画には目的蛋白質の位置のバンドが見られないことから、セファロースに結合した蛋白質はほとんど解離していないこともうかがえた。また、PAタグシステムのもう一つの大きな特徴として、PA タグと NZ-1 の結合が高濃度のマグネシウムイオンによっても解離可能であることが挙げられる。具体的には、NZ-1 が固定化された使用済みレジンは 10 mM MES・3 M MgCl2(pH 6.0)により再生が可能である。この特徴は、抗体やレジンへ与えるダメージを少なくレジンを再生できるというメリットを示している。このようなマイルドな条件でのレジンの再生によって、レジンを複数回使用することが可能となり、大きなコスト削減へつながる。事実、上の条件で 60 回繰り返し使用しても、得られる蛋白質量に大きな変化は見られなかった 1)。
PA タグシステムの使用例
PA タグシステムは多くの蛋白質の精製に利用可能であり、我々は PA タグシステムを利用し、既に 20 種類以上の蛋白質の精製に成功している。また、PA タグシステムは目的蛋白質の N 末端にも C 末端にも付加することが可能である。どちらに付加するのが良いかはその後の解析実験や目的蛋白質の性質にもよるので、その都度考える必要がある。
しかし、図3で示したようにどちらの場合でも非常にきれいに目的蛋白質のみを精製することが可能である。図3では分泌蛋白質の結果を示しているが、膜蛋白質や細胞内蛋白質の精製にも成功しており、精製蛋白質の分子量も約 15kDa から約 500kDa まで様々な大きさの蛋白質の精製に成功している。
ただし、PA ペプチドを用いた溶出の際には、ステップごとに5分間のインキュベーションが求められる。これを行わなかった場合は、多くのフラクションに蛋白質が分散して(すなわち"だらだら"と)溶出されてしまう。これは、NZ-1 とPA タグの解離が非常に遅いため、PA ペプチドが PA タグと競合するためにはある程度の時間を要することに起因すると考えられる。
一方、精製だけではなく検出にも使えることはタグの可能性を大きく広げ、より有用性を高める。そして、PA タグは免疫学的手法によって目的の蛋白質のみを手早くかつ低コストで検出することも可能である。事実、PA タグ/ NZ-1 のシステムはウェスタンブロッティングやフローサイトメトリーや免疫細胞化学的な検出(Immunocytochemistry : ICC) に も使用可能である 1, 10)。
PA タグ/ NZ-1のシステムは非常に高い親和性と特異性を有しているので、素早くきれいに蛋白質を検出できることが大きなメリットとして存在する。特にウェスタンブロッティングにおいてその特徴は顕著であり、FLAG タグと比較して非常にきれいに目的蛋白質のバンドのみを確認することができる。さらには、PA タグと NZ-1 の親和性は非常に高いため、一次抗体(NZ-1)のインキュベーション時間は5分程度でも十分にバンドを確認することが可能である (図4)。
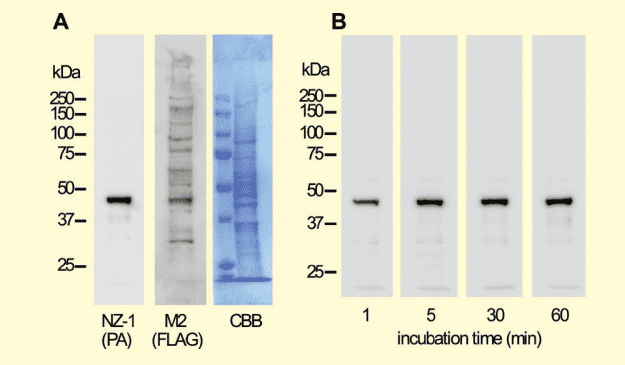
図4.PA タグ /NZ-1 のシステムを用いたウェスタンブロッティング
C 末端に FLAG タグと PA タグをタンデムに付加した IDH1(IDH1-FLAG-PA)を発現させた osteosarcoma 細胞の lysate を泳動サンプルとして用いた。(A) 一次抗体に 1μg/ml NZ-1 を、二次抗体に抗 rat 抗体を用いたものと、一次抗体に 3.5μg/ml M2 を、二次抗体に抗 mouse 抗体を用いたものと、サンプルを転写した膜をそのまま CBB 染色したもので比較を行った。その結果、二次抗体の違いによる影響もあるが、PA タグ /NZ-1 のシステムを用いた場合では非常にきれいに目的のバンドのみを確認することができた。 (B) 一次抗体に 1μg/ml NZ-1 を二次抗体に抗 rat 抗体を用いて、一次抗体のインキュベーション時間の検討を行った。その結果、1分程度のインキュベーション時間でも明確なバンドを確認することができ、5分程度のインキュベーション時間でバンドの濃さは既に飽和していることが確認できた。なお、具体的な精製やウェスタンブロッティングの手法は参考文献に記している 11)。
おわりに
PA タグシステムは非常に強力なアフィニティータグシステムである。NZ-1 抗体が元々はヒトポドプラニン抗体であるため、ヒトあるいはサル由来のポドプラニンが発現している細胞株(HEK, COS-1, COS-7 細胞等 ) では多少使いづらいという難点があるが、それさえ注意すれば問題はない。さらには、ポドプラニンは膜蛋白質であり細胞外には分泌されてこないため、分泌蛋白質であるならば、これらの細胞株を用いても内因性のポドプラニンがコンタミネーションしてくる心配はない。
また、細胞株によってはポドプラニンが発現していたとしても NZ-1 に弱くしか結合しない場合もあるので、膜蛋白質や細胞内蛋白質に対しても応用範囲は広い。もし、ポドプラニンも一緒に精製できてしまったとしても、ポドプラニンの分子量(約 37 kDa)と目的蛋白質の分子量がある程度離れていれば、その後のゲルろ過等のステップできれいに分離することが可能である。
蛋白質精製は、精製する蛋白質自身に依存して結果が異なってしまうことは多々ある。そのため、精製がうまくいかない場合はいくつかの種類の精製法を試してみる必要がある。その際、PA タグシステムは非常に強力な精製法であることから、各研究者が現在採用している精製法でうまく精製できなかった場合のセカンドチョイス、あるいは新たに動物細胞発現系で蛋白質精製を始める際のスタートアップキットとしては最適であると考えられる。
我々はすでに、NZ-1 抗体と PA ペプチドの複合体の結晶構造を決定している。その結果、NZ-1 に結合した状態の PA ペプチドが非常にユニークな立体構造を取っていることが明らかになった。この特徴的な構造から、現在は PA タグシステムの新たな利用法についての研究を進めている。
参考文献
- Fujii, Y. et al. : Protein Expr., Purif., 95, 240-7 (2014). DOI: 10.1016/j.pep.2014.01.009
- Field, J. et al. : Mol. Cell. Biol., 8, 2159-2165 (1988). DOI: 10.1128/mcb.8.5.2159-2165.1988
- Evan, G. I. et al. : Mol. Cell. Biol., 5, 3610-3616 (1985). DOI: 10.1128/mcb.5.12.3610-3616.1985
- Hopp, T. P. et al. : Nat. Biotechnol., 6, 1204-1210 (1988). DOI: 10.1038/nbt1088-1204
- Einhauer, A. et al . : J. Biochem. Biophys. Methods, 49, 455-465 (2001). DOI: 10.1016/s0165-022x(01)00213-5
- Kato, Y. et al. : Cancer Sci., 99, 54-61 (2008). DOI: 10.1111/j.1349-7006.2007.00634.x
- Kato, Y. et al . : Biochem. Biophys. Res. Commun., 349, 1301-1307 (2006). DOI: 10.1016/j.bbrc.2006.08.171
- Kaneko, M. K. et al. : Cancer Sci., 103, 1913-1919 (2012). DOI: 10.1111/j.1349-7006.2012.02385.x
- Ogasawara, S. et al. : Hybridoma (Larchmt), 27, 259-267 (2008). DOI: 10.1089/hyb.2008.0017
- Kaneko, M. K. et al . : Biochem. Biophys. Res. Commun., 432, 40-45 (2013). DOI: 10.1016/j.bbrc.2013.01.088
- 藤井勇樹ら : 蛋白質科学会アーカイブ , 7, e075 (2014).




