【特別講座】貴金属粉末触媒へのいざない
本記事は、OrganicSquare Vol.50(2014年12月号)において、エヌ・イー ケムキャット株式会社 髙木 由紀夫 様に執筆いただいたものです。

はじめに
触媒とは特定の化学反応の反応速度を速める物質1)で、自身は反応の前後で変化しないものをいうが、実際の触媒は正確な定義通りにはいかず劣化や成分の溶出などを伴う。貴金属触媒は活性成分が「貴」であるため変化しにくく、比較的定義に近い触媒といえる。
このたび、和光純薬工業(株)から、エヌ・イー ケムキャット(株)の標準的な貴金属担持活性炭粉末触媒が販売されることとなったので、以下に貴金属粉末触媒の選び方・使い方について、簡単にご紹介させていただきたい。
全般的な貴金属粉末触媒の特徴
一般的なこれら触媒の使用上の特徴として、以下の点を挙ることができる。
- 触媒使用量が少なく、反応物とはろ別で分離可能。
- 多くの場合、繰返し使用が可能。
- 一般に反応条件が温和(温度・圧力)。
- 溶媒は、酸性でも塩基性でも使用可能。
- 空気中で安定なので取扱いが容易。
- 一般に、前処理の必要がない。
- 量産品であるので、スケールアップ検討しやすい。
- 量産時の使用済触媒からの貴金属回収が可能。
各金属間(PdとPt、Ru)の比較
今回和光純薬工業(株)より販売されるエヌ・イーケムキャットの標準触媒は、Pd/Cが10種、Pt/Cが2種、Ru/Cが2種となっていて、実績を中心に選定されている。
Pt/Cについては、3%Pt/C type STDとS修飾した3%Pt/C type SN101であり、活性は前者の3%Pt/Cが全般的に高いが、ケトン基やハロゲン基への水素化活性をやや示す場合があるので、これらの官能基を守りたい場合は3%Pt/C type SN101が望ましい場合がある。
Ru/Cについては、5%Ru/Cのtype Aとtype Bが供される。余裕があれば、両方試していただくのが望ましいが、type Bは糖アルデヒドの水素化による糖アルコールの生成や複素環水素化により向いており、炭素骨格の芳香環水素化にはtype Aのほうが適している場合が多いと思われる。
Pd/Cは10種が供されている。
このうち、脱保護やクロスカップリングについては、適している触媒がはっきりしている。
脱保護用Pd/C
脱BnにはASCA-2が適している2)。相当するPd含量のPd/Cと比較して、水素化分解活性が高い。
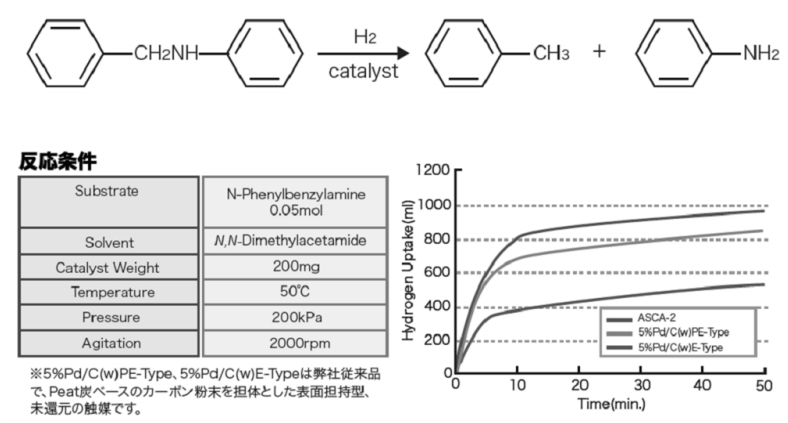
脱Fmocと脱Cbzには5%Pd/C type Kまたは10%Pd/C type NXが適しているが、基質によって活性がやや不足する場合は別にFGS-10DRという脱保護用10%Pd/C3)の製品部番がある。
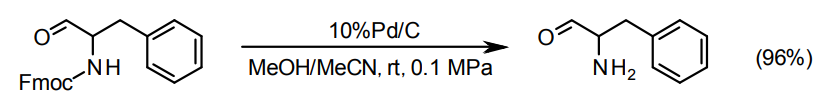
クロスカップリング
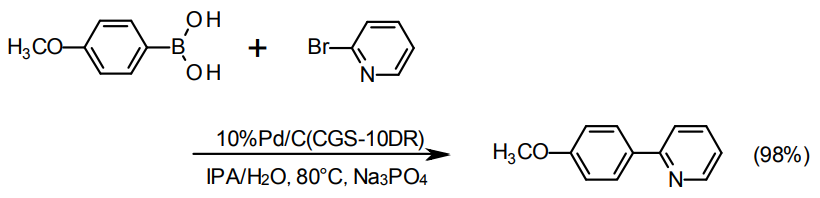
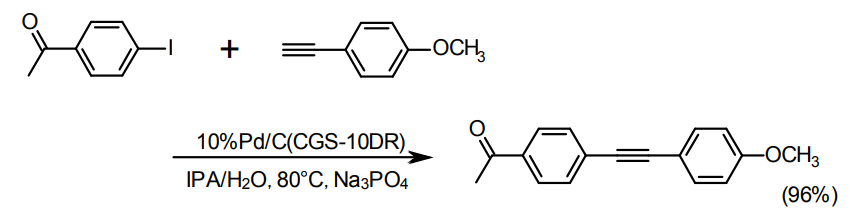
鈴木カップリング、薗頭カップリング、Buchwaldカップリングなどについて佐治木らによる一連の報告がある4-6)。今回のラインナップ中では、5%Pd/C type Kまたは10%Pd/C type NXが適しているが、活性がやや不足する場合はCGS10-DRという別の10%Pd/Cの製品部番がある。
鈴木カップリングの例4)
薗頭カップリングの例5)
Buchwaldカップリングの例6)
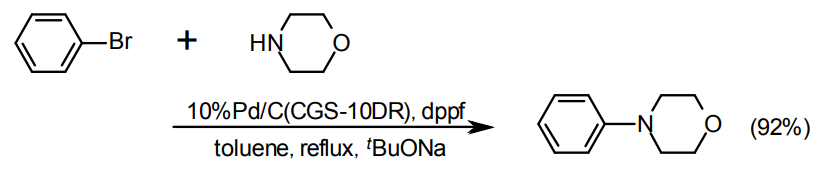
一般的な水素化反応におけるPd/Cの選択
通常はtype STDを推奨するが、ニトロ水素化のように水が生成して、非水溶媒系で二層に分かれるような場合、担体によっては水素ガスと水と溶媒の界面に集まって、溶媒相への分散が悪くなり反応が進みにくくなる場合がある。このような場合に、type STDやtype Kに代えてtype NXやtype PEを利用すると良くなる場合がある。また、選択性が向上することもある。担体の親水性や有機物に対する親和性が異なるためと推定している。
反応が進みにくい場合、触媒量を増やすのも一法であるが、ろ過工程に制限がある場合や、活性炭への目的物の吸着が無視できない場合がある。このようなときは、①Pd含有率が高い触媒を使う方法、あるいは②type PEまたはtype Eを用いる方法がある。②では、Pdが他の触媒よりもより表面リッチに担持されているため利用率が高まる傾向がある。一方で、未還元のPdが存在するため、水素化反応の誘導期が長くなる場合がある。可能であれば、基質投入前に予備水素還元する方法がある。
以下、水素化の例について紹介する。尚、必ずしも貴金属含有率が一致しない例や、今回のエントリー外の触媒の例もあるが、情報提供の一環ということでご容赦をお願いしたい。
水素化
基質を溶媒に溶解または懸濁させた反応系において、粉末触媒と水素ガスを用いて水素化を行う。他の還元方法と比較して、不純物混入の少ない還元を実施でき、反応後の後処理が容易である。即ち、以下の利点がある。
- 還元剤の残骸(酸化体)が系内に残らない(但し、ニトロ基→アミノ基の水素化のように酸素原子を外す反応では、水が生成するし、脱ハロゲン反応のようにハロゲン原子を外す反応ではハロゲン化水素が発生する)。
- 貴金属成分の系内への溶出混入がほとんど起きない。
- 触媒使用量が少なく、反応物とはろ別で分離可能。
C=C不飽和結合(アルケン)の水素化
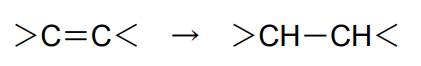
通常、Pd/CでもPt/Cでも容易に進行する。特に他の問題がなければ安価なPd/Cが適している。Pt/Cは二重結合の移動を避けたい場合や高度の立体障害がある場合に用いられる。二重結合が複数ある場合は、立体障害の少ない結合が優先して水素化される。立体障害が同程度である場合は、二重結合に無理がある歪みがあるほうが優先して水素化される7)。
他にハロゲン基が存在していてこれを残したい場合は、Pd/Cでは脱ハロゲンを起こしやすいので、Pt/Cが適している。Pt/Cでも脱ハロゲンを起こしやすいような場合は、S修飾したPt/Cを用いる。この場合、やや主活性(アルケンへの水素化活性)がやや落ちることがある。
一方、ケトン基が存在してこれを残したい場合は、Pd/Cが適している8)。

アルデヒド基が存在してこれを残したい場合は難しいが、Pd/Cで可能な場合がある9)。
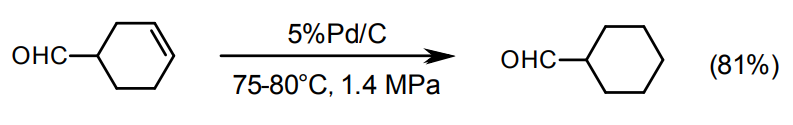
アルキンのC≡C三重結合の水素化
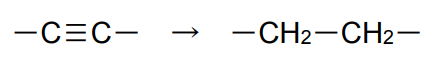
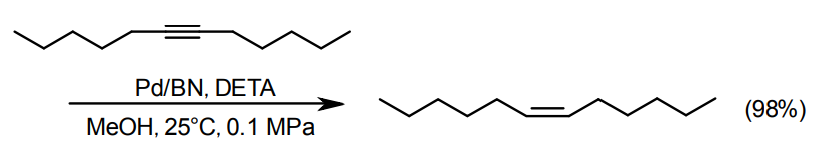
C≡C三重結合の水素化はCH=CH二重結合を得て逐次的に進行する。一般にC≡CはPdに配位/吸着しやすくアルキンが存在しているうちはアルキンが優先的に水素化されてアルケンを生成する。完全水素化してアルカンにする場合は反応を押し切ればよい。
C=C二重結合で止めたい場合、Pdを使って水素吸収量を正確にモニターして1mol相当の水素が吸収されたところで止める例がある10)が、通常はLindlar触媒(5%Pd-Pb(OAc)2 /CaCO3)が用いられる11)。最近、佐治木らにより、Pbフリーの新しいPd触媒が報告されている12)。
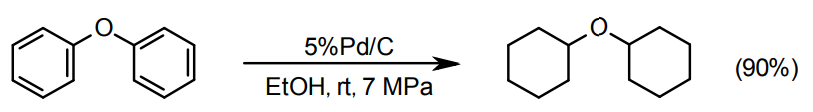
芳香環の水素化による脂環の生成
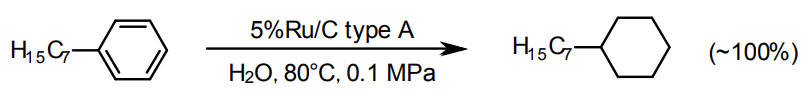
芳香環の水素化には、Pd/C、Pt/C、Ru/C(及びRh/C)が用いられる。Pd/CとRu/Cは一般にやや高圧が必要なことが多い13)。
Ru/Cは特に水系溶媒に適していて14)、水素化分解を避けたいときにも用いられる。
複素環水素化には、type Bのほうが良い場合がある。
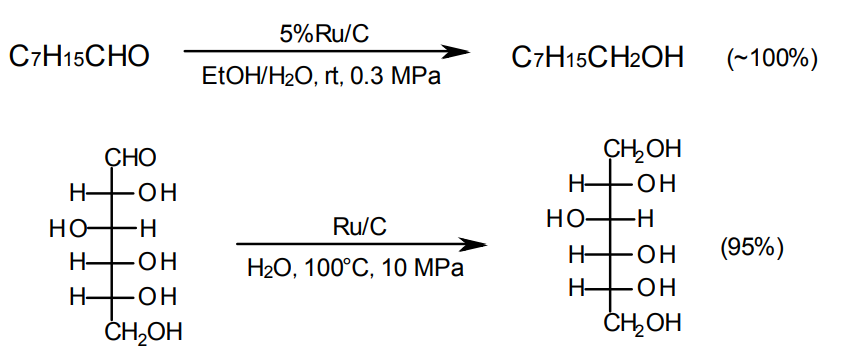
アルデヒドの水素化によるアルコールの生成
脂肪族アルデヒドの水素化には、Pt/CとRu/Cが適している。Ru/Cは特に水系溶媒に適していて15)、糖アルデヒドの水素化による糖アルコールの合成にも用いられる16)。尚、この用途には、Ru/C type Bが比較的適している。
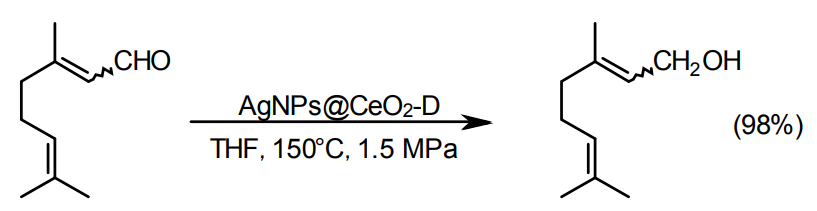
C=C結合を伴う脂肪族不飽和アルデヒドから、不飽和アルコールを生成させるのは難しい。例えば、Pt/CにFeとZnを添加した報告例17)や、最近では、金田らによるAg/CeO2コアシェル触媒の報告例がある18)。尚、この例では、二重結合のE,Z配置の異性化は起こらない。
芳香族アルデヒドの水素化によるベンジルアルコールの生成は比較的難しい。水素化分解による脱ベンジルを防ぐには工夫が必要である。例えば、担体上への反応生成物の吸着を防いですぐに離脱するようにして、水素化分解を抑制する手法が取られる。この目的には担体のないPtO2が使われる19)。
ケトンの水素化
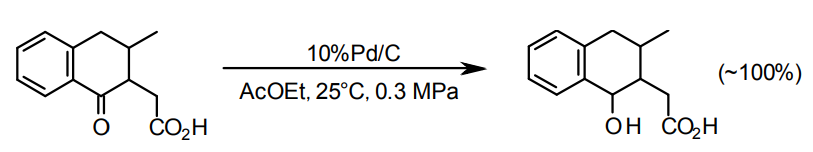
芳香族ケトンを芳香族アルコールにする場合はPd/Cが適している20)。この場合、環の水素化が起きないよう、水素圧をあまり上げないことが好ましい。
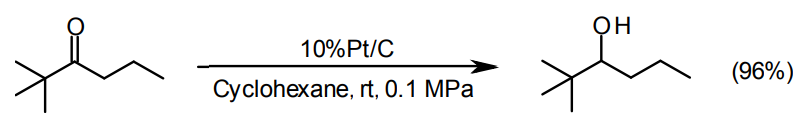
脂肪族ケトン基の水素化による脂肪族2級アルコールの合成にはPt/C、Ru/Cが適している21)。Ru/Cは塩基性または中性での水系溶媒に適しているが、一般に高圧が必要である。
ケトンの還元アミノ化・アルキル化
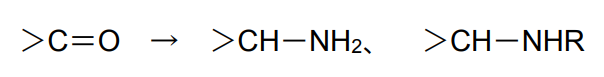
Pt/Cが適している22)。
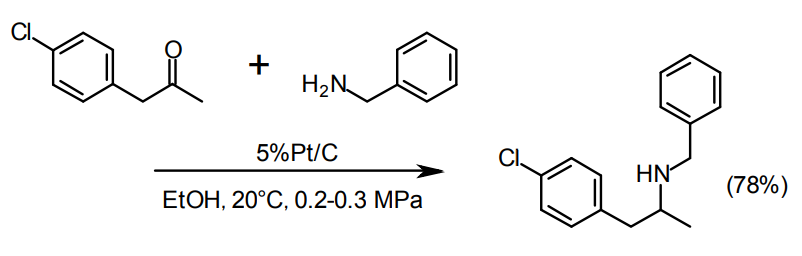
脱ハロゲンを抑えたいような場合やケトンから2級アルコールが副成するのを抑制したい場合は、S修飾したPt/Cを用いることもある23)。
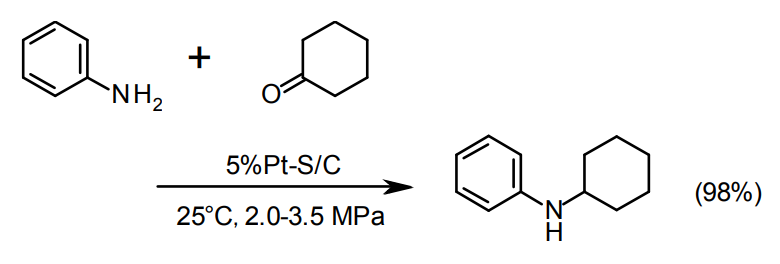
ニトロ基の水素化
芳香族ニトロ基の水素化には、通常Pd/C24)やPt/Cが使われる。問題ない場合はPd/Cのほうが安価である。
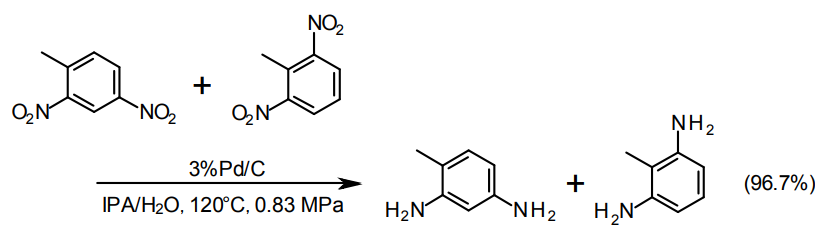
尚、水素化時の発熱量が大きい25)ので(493kJ/mol)、除熱を考慮する必要がある。また、4molの水が生成するため、溶媒系によっては、触媒が気液界面に集中分布して反応系にうまく分散しにくくなる場合があり、溶媒や触媒選定に注意が必要な場合がある。
ハロゲン基が存在していて、脱ハロゲンを抑制したい場合はPt/Cが適している。ハロゲンが特に外れやすい場合はS修飾したPt/Cが用いられる26)。
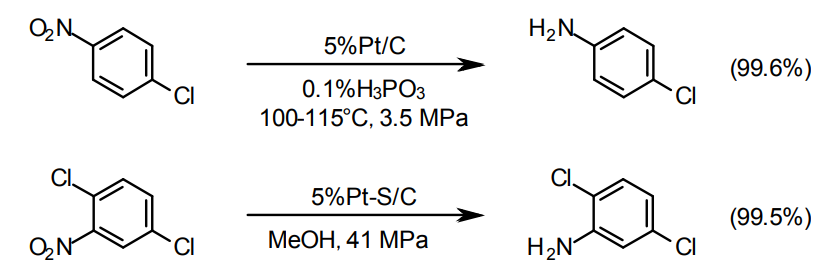
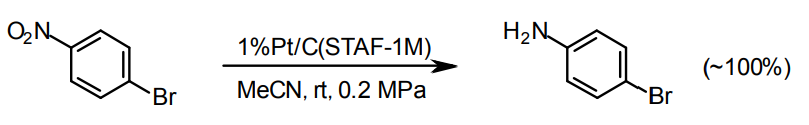
最近、脱ハロを抑制したニトロ基水素化用に適したPt触媒(STAF-1M、1%Pt/C)がエヌ・イー ケムキャット(株)にて量産化された。
おわりに
今回、和光純薬工業(株)から、量産可能なエヌ・イー ケムキャット(株)の触媒をエントリーすることができ、貴金属粉末触媒を使ったことのない方にも、敷居が高くない形で利用していただけることとなった。触媒反応は、一般にE-ファクター(副生物量/目的物生成量)が小さく温度・圧力条件も穏和であることから環境に優しい反応である。この機会に、試していただければと思う。
謝辞
本稿に記載の内容の一部は、それぞれ、岐阜薬科大学 薬品化学研究室 佐治木弘尚教授、大阪大学 太陽エネルギー化学研究センター 金田清臣特任教授との共同成果によるものである。
参考文献
- 長倉三郎ら編、「理化学事典」岩波書店、第5版 (1998)932
- 特許3,798,949
- 特許4,679,981
- Y. Kitaura et al., : Chem. Commun., 5069 (2007). DOI: 10.1039/B712207A
- S. Mori, et al., : Chem. Euro. J, 14, 6994 (2008). DOI: 10.1002/chem.200800387
- Y. Monguchi, et al., : Adv. Synth. Catal., 350, 2767 (2008). DOI: 10.1002/adsc.200800417
- H. A. Smith et al., : J. Am. Chem. Soc., 71, 3765 (1949). DOI: 10.1021/ja01179a054
- J. G. Dinwidde et al., : J. Org. Chem., 30, 766 (1965). DOI: 10.1021/jo01014a027
- H. E. Hennis et al., : J. Org. Chem., 26, 4678 (1961). DOI: 10.1021/jo01069a505
- G. F. Hennion and S. O. Barrett, : J. Am. Chem. Soc., 79, 2146 (1957). DOI: 10.1021/ja01566a032
- H. Lindlar, : Helv. Chim. Acta, 35, 446 (1952). DOI: 10.1002/hlca.19520350205
- Y. Yabe et al., : Adv. Synth. Catal., 354, 1264 (2012)、特開2012-143742
- P. N. Rylandar and M. Kilray, : Engelhard Ind. Tech. Bull., 9, 14 (1968).
- Y. Fujiwara et al., : Chem .Euro. J., 15, 6953 (2009).
- 西村重雄・高木弦、「接触水素化反応」東京化学同人、(1987)164
- Y. Takagi, Sci. Papers Inst. : Phys. Chem. Res., 57, 105 (1963).
- P. N. Rylandar and D. R. Steele, : Tetrahedronlett., 1579 (1969).
- T. Mitsudome, et al., : Chem. Lett., 42, 660 (2013).
- H. Adkins and H. I. Cramer, : J. Am. Chem. Soc., 52, 4349 (1930).
- G. N. Walker, : J. Org. Chem., 23, 133 (1958).
- Y. Fujiwara et al., : ChemCatChem., 3, 1624 (2011).
- BP 1,031,169 (1966)
- H. Greenfield et al., "Catalysts of Organic Reactions", J. R. Kosak, ed., Dekker, (1984)309
- BP 907,154(1962)
- 西村重雄・高木弦、「接触水素化反応」東京化学同人、(1987)211
- J. R. Kosak, "Catalysis in Organic Synthesis", W. H. Jones, ed., Academic Press. (1980)107




