【総説】自由自在に接着末端を設計できるPCR停止プライマーを用いたDNA連結技術の開発
本記事は、和光純薬時報 Vol.92 No.3(2024年7月号)において、名古屋大学大学院 理学研究科 野村 浩平様、阿部 洋様に執筆いただいたものです。
1.はじめに
遺伝子工学の分野では、遺伝子組み換え技術によって薬品・害虫・病気等に強い作物や、インスリンなどの薬効成分を大量合成する大腸菌の開発が行われ、農業や製薬業界といった幅広い分野での応用がなされてきました。しかし近年では、遺伝子工学の新たな段階として、人工的に遺伝子を設計・合成し、産業応用に有効な遺伝子を持つ生物を一から創り出すゲノム合成が注目されています。ゲノムサイズの長いDNAを一度に合成することは困難で、複数のDNAをつなぎ合わせることでゲノムの合成は達成されます。したがって、高効率で正確なDNAの連結技術が必要とされています。
また、DNAの連結技術はゲノム合成のみならず、DNAライブラリーの構築や遺伝子クローニングなど、様々な分野の研究において重要な役割を果たしています。DNA連結技術は遺伝子工学の基盤となっており、現代の生物科学における技術や医学の発展に欠かせない技術と言えます。そのため、DNA連結技術は今後も更なる研究や応用が期待されています。
これまでに様々なDNA連結手法が開発されており、その技術は日々進化しています。代表的なDNAの連結手法を図1にまとめました。この記事では、それらDNA連結技術に加えて、筆者らが開発した新しい手法について紹介します。開発した新しい技術では、PCR停止プライマーという革新的なツールを用いて、より簡単かつ効果的にDNAをつなぎ合わせることが可能となりました。この進歩は、科学の世界でのさらなるブレイクスルーにつながる可能性を秘めています。
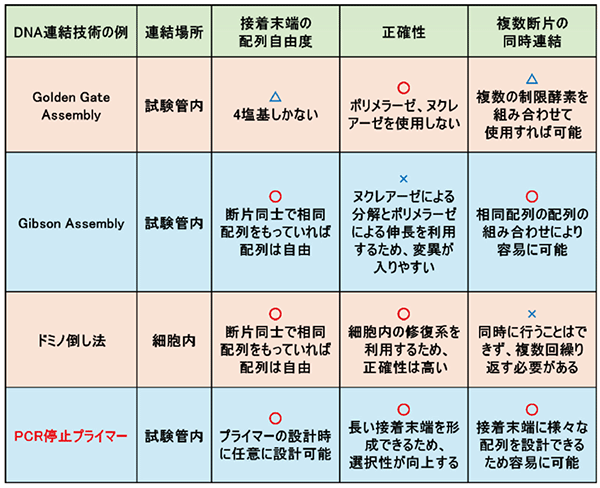
図1.DNA 連結技術の例とその特徴
2.長いDNAの合成について
現在、DNAの合成にはホスホロアミダイト法と呼ばれる化学的な手法が用いられており、機械によって自動化され高収率かつ短時間での合成が可能になっています。しかし、化学合成可能な核酸の長さは最大でも200塩基程度に留まっています。そのため、化学合成のみで上記のゲノムサイズのような長鎖DNAの合成を達成するのは不可能です。さらに長いDNAを調製するために用いられるのがポリメラーゼ連鎖反応 (PCR) です。PCRでは鋳型となるDNAの配列に基づき二本鎖のDNAを増幅します。しかし、PCRにおいても作成できる長さは1.5万塩基程度が限界と言われています。したがって、更なる長鎖DNAを得るためには、PCRで合成したDNA断片を連結させる必要があります (図2)。
DNA の連結技術には、大きく試験管の中で行う方法と、生きた細胞内で行う方法の二つがあります。試験管内で連結させる方法では、DNAの端に突出した部分を作り、それを接着剤として使用します。この末端を接着末端と呼び、突出した部分が互いに張り付くことで、2つのDNA をつなぎ合わせます。一方、生きた細胞内で連結する方法では、細胞が持っているDNAの修復機能を利用することでDNAをつなぎ合わせることができます。
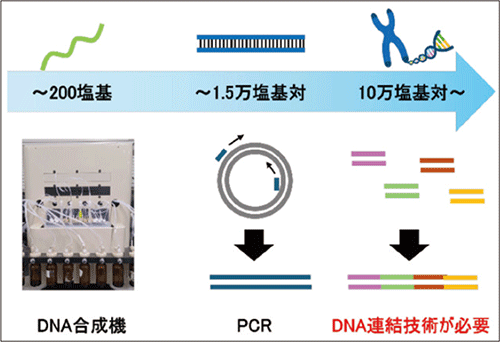
図2.鎖長によるDNA の合成方法の違い
3.試験管内でのDNAの連結
試験管内でのDNAの連結においては上記でも述べたように接着剤として接着末端をDNAの末端に形成させます。この接着末端の形成には酵素が用いられることが多く、本項ではその例について紹介します。
まず、制限酵素を用いた手法があります。制限酵素は、特定の配列を持つDNAを切断することができる酵素です。制限酵素には多くの種類が存在しますが、ある種の制限酵素を用いた場合、切断されたDNA断片には接着末端が形成されます。制限酵素を用いた手法の代表例にはGolden Gate Assembly1)という手法があります (図3a)。この手法ではType IIS型と呼ばれる制限酵素 (例:BsaI) が用いられ、この酵素は配列を認識する部位と切断する部位とが離れているため、DNAを望みの配列に組み立てやすいという利点があります。さらに、形成された接着末端はそのまま連結に用いられるため、変異が導入されにくく、正確性が高いという利点も挙げられます。その一方で、形成される接着末端は4塩基と短いため、多様性が持たせにくく複数断片の同時連結には向かない点や連結効率が低いという点が課題です。
上記の手法の課題を解決したのが、二本鎖のDNAのうち片方の鎖を端から削っていくエキソヌクレアーゼと呼ばれる酵素を用いた手法です。この酵素はDNAの配列に関係なくDNAを分解していくことができるため、どのような配列のDNAの連結にも使用できます。ただし、削られるDNAの長さは予測できないため、後から余分に削った分を穴埋めする必要があります。このエキソヌクレアーゼを用いた代表的な手法にはGibson Assembly2)が挙げられます (図3b)。この手法では、末端に同じ配列を持つ二本鎖DNAを用いて連結を行います。まず、T5エキソヌクレアーゼによりDNAを削っていくことで接着末端を形成し、その後、接着末端同士を貼りつけます。最後に余分に削ったことで生じたギャップをポリメラーゼで穴埋めし、リガーゼで結合させます。この方法はDNA断片と酵素を混ぜ合わせ、加温するだけで目的のDNA連結産物を得ることができ操作が容易です。さらに、相同配列を利用するため自由な配列を選択でき、複数断片を一度に連結させることも可能です。しかし、ヌクレアーゼによる分解やポリメラーゼによる鎖伸長を行うため、その過程で変異が入りやすいという課題が生じます。
4.細胞内のシステムを用いたDNAの連結
生きた細胞内では、細胞内の相同配列の組み換えシステムを利用することでDNAを連結します。この手法では、連結したいDNA断片を細胞内に導入するだけで連結ができ、接着末端を形成させる必要がありません。細胞内システムを利用した手法の一例として、枯草菌を用いた手法があります。枯草菌内に、DNA断片の末端が相同配列になるようなDNA断片を導入することで、細胞内の相同組み換えシステムによってDNA断片が枯草菌ゲノム内で連結されます。これを繰り返すことで長鎖のDNAの連結を達成できます。最終的に枯草菌ゲノムから連結したDNA断片を切り出すことで、目的のDNAを得ることが可能です (図3c)。この手法は「ドミノ倒し法」と呼ばれ、マウスのミトコンドリアゲノム (16 kbp) を4断片から、イネの葉緑体ゲノム (135 kbp) を31断片からの再構築に成功しています3)。細胞内の修復系を利用しているため、正確性が維持されるという点や、相同配列を利用するため、配列の自由度が高いといった利点が挙げられます。その一方で複数のDNA断片を同時に連結させることができないため、一つずつ繰り返していく必要があります。
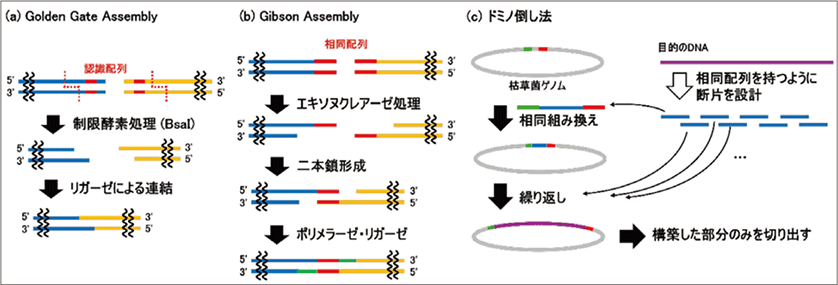
図3.既存のDNA 連結法の例
5.化学修飾を導入したPCR停止プライマーによる接着末端の形成
筆者らは新たに、制限酵素を使用せずに接着末端を形成させる手法を開発しました。ここではその技術について紹介します。PCR産物に接着末端を形成させるため、PCRのプライマーに化学修飾を導入しました (PCR停止プライマー)。PCR時の鎖伸長反応をPCR停止プライマーの化学修飾の立体障害により停止させることで、接着末端を形成することができます (図4)4)。この方法では鎖伸長停止によって接着末端を形成させるため、PCR停止プライマーの設計時に接着末端の長さや配列を自由に決めることができます。したがって、長い接着末端を形成することで選択性が向上し、多断片同時連結による新たな機能を持つゲノムDNAの合成も可能になります (図5)。
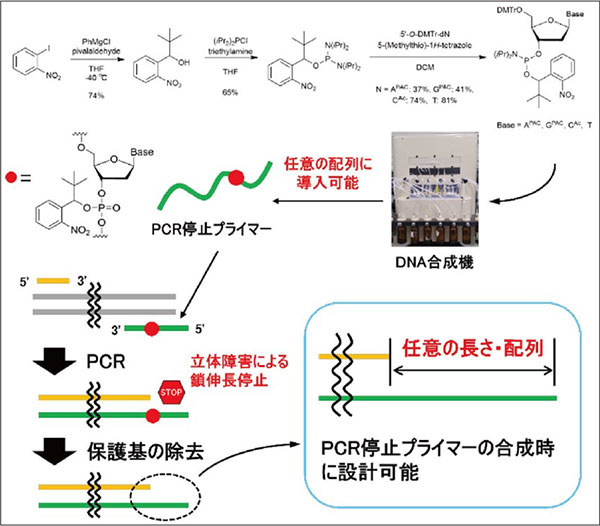
図4.PCR 停止プライマーの合成と接着末端の形成
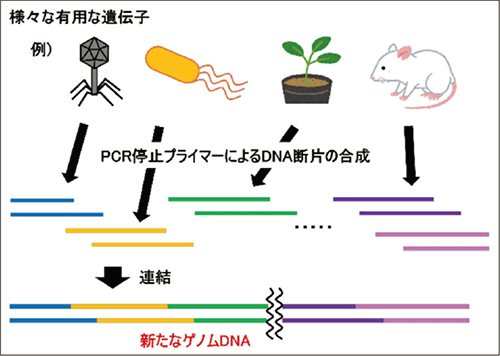
図5.PCR 停止プライマーを用いたゲノムDNA の合成
筆者らは、PCR停止プライマーとして、DNAのリン酸部に光によって切断可能なo-ニトロベンジル保護基を持つプライマーを設計しました。保護基をリン酸部に導入することで、任意の塩基に対して使用可能となり、配列設計に制約がなくなります。さらに、アミダイト試薬が共通の中間体として機能するため、すべての塩基に対してアミダイト合成が容易であり、製造上の利便性も高いです。
プライマー合成のためのホスホロアミダイトは、図4上部に示すスキームに従って合成しました。ベンジル位にtert-ブチル基を有するo-ニトロベンジルアルコールを合成し、それとBis(diisopropylamino)chlorophosphineを反応させることで、共通中間体であるアミダイト試薬を合成しました。このアミダイト試薬と5'位OH基をDMTr で保護したヌクレオシドを反応させることで、目的のヌクレオシドホスホロアミダイトを得ることができます。
開発したPCR停止プライマーを用いて、2 kbpと3 kbpからなるDNA断片を合成しました。この断片はPCRで増幅した後、光照射を行うことでo-ニトロベンジル基を除去し、接着末端を持つDNA断片として得ることができます。得られたDNA断片を用いて連結を行い、連結効率をゲル電気泳動により評価した結果、連結効率は77%でした (図6a)。比較のために、制限酵素であるBsaIを用いて同様の連結実験を行った結果、連結効率は42%でした。PCR停止プライマーを用いたDNA連結では、従来の制限酵素法に比べて連結効率が著しく向上しました。これは、制限酵素処理で形成される4塩基の接着末端のTm値 (10 ℃) に比べ、PCR停止プライマーで形成される50塩基の接着末端のTm値が高く (76 ℃)、熱力学的安定性が高いためだと考えられます。筆者らはさらに、本連結技術を用いて48.5 kbpからなるλファージゲノムの4断片同時連結を試みました。PCR停止プライマーにより合成した4つのDNA断片を混合し、連結させました。その結果、連結効率は低いものの、室温で7日間または50 ℃で3日間反応させることで目的の長さのDNA産物を確認することができました (図6b)。今後、連結条件の最適化により、さらなる収率の向上やより長いDNAの連結が目指されます。
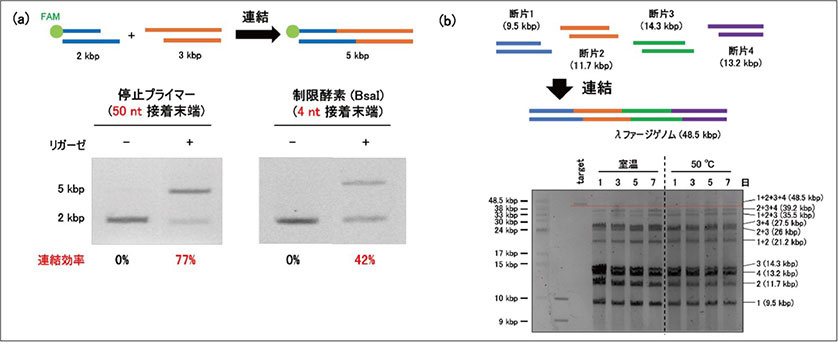
図6.PCR 停止プライマーを用いたDNA の連結結果
6.おわりに
上記で紹介したように、従来の制限酵素を用いた手法では実現が困難であった、接着末端の長さや配列を自由に設計できる点や、長鎖DNAの多断片同時連結を可能にした点は、筆者らが開発した停止プライマーの特徴であり強みです。今回比較に用いた制限酵素法以外の、Gibson Assemblyをはじめとしたエキソヌクレアーゼを用いた手法や細胞内システムを用いた手法では環状DNAの合成に限られます。これに対し、停止プライマーを用いたDNA連結は、直鎖DNAの連結にも適用でき、応用範囲が広いと言えます。PCR停止プライマーを用いた手法は、既存のDNA連結技術に代わる新たなDNA連結技術として期待できます。今後の展望として、目的のゲノム配列を入力することで、連結効率が高くなる最適な接着末端を持つDNA断片に分割し、さらにその断片を合成するためのPCR停止プライマーの配列設計まで自動で出力されるようなシステムの開発を目指しています (図7)。
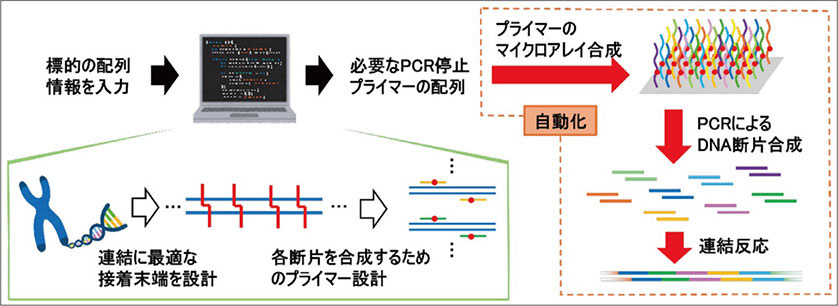
図7.今後の展望
また、理論上PCR停止プライマーの合成から、PCRによるDNA断片の調製、その後の連結までの過程を自動で行えると考えており、長鎖DNA合成の自動化への展開も期待できます。
これまでのDNA連結技術への取り組みは、各種酵素や細胞内システムを用いた分子生物学的な手法が主でした。しかし、これらの手法における欠点を補うため、近年では筆者らの発明を含む化学的な手法を用いたDNAの連結技術が開発されています。このようなDNA連結技術は、ゲノムの機能やその原理の解明、医薬品開発など、幅広い応用の可能性を秘めており、今後より発展していくことが期待されます。
参考文献
- Engler, C. et al. : PLoS One, 3, e3647( 2008).
- Gibson, D. G. : Meth. Enzymol., 498, 349 (2011).
- Itaya, M. et al. : Nat. Methods, 5, 41 (2008).
- Nomura, K. et al. : RSC Chem. Biol., 5, 360 (2024).




