エンドトキシン除去ゲル「セルファイン® ETクリーン」開発秘話
本記事は、JNC株式会社 ライフケミカル事業部 営業部 戸所 正美 様にご執筆いただいたものです。
はじめに
セルファイン® ETクリーンはタンパク質に混入しているエンドトキシン(ET)の除去を目的に開発されました。既に20年以上の販売実績のある製品で、国内外の多くのユーザーに使用して頂いております。ETには人体や細胞に好ましくない発熱や炎症などを引き起こす作用があります。そのため、人体に入る医薬品(特に注射用医薬品)や細胞培養に使用する薬品からETを除去する事が必要となっております。
エンドトキシンとは?
ETはグラム陰性菌の細胞構成成分で、外膜に存在しています。外膜にあるリポポリサッカライド(リポ多糖、LPS)がETの本体です。グラム陰性菌の仲間では大腸菌が有名です。ETはグラム陰性菌が生きている間はほとんど放出されませんが、細胞が死ぬと放出されます。グラム陰性菌類は環境中に普通に存在しており、ETもいろいろなところに存在していると思われます。
ETが大量に体内に存在すると、病的な炎症応答、血管拡張、低血圧、血液凝固による多臓器不全など敗血症を引き起こします。また、そこまで重症にならない量であっても、ETが混入した注射用の薬品を注射した場合、人体は発熱します。そのために医薬品はETの規格が定められており、日本薬局法で定める注射用蒸留水の場合は0.25 EU/ml以下です。
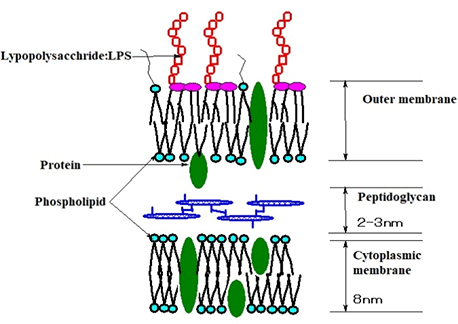
グラム陰性菌の膜構造の模式図
リポ多糖の構造
リポ多糖は多糖とリピッドAから構成されています。多糖は菌によって構造が違ってきます。例えば、大腸菌ではO157が有名ですが、大腸菌はO1からO181(7個の欠番があります)まで分類されています。このOとはO抗原の意味ですが、血液型のO型とは違います。Oはドイツ語のohne Hauchbildung(英訳without haze formation)からきており、コロニーの外観に曇りの発生が見られない特徴から来ています。一方、HauchbildungはH抗原の由来になっていますが、これは鞭毛による運動でコロニーに曇りが見られる特徴から来ています。大腸菌のO抗原はそれに対応する抗血清と混ぜると凝集しますので、その反応を観察することにより、Oの何番であるか検査できます。リポ多糖の多糖はETの発熱反応には直接関係しておりません。ETの問題となる生理活性はリピッドAが担っていると言われています。
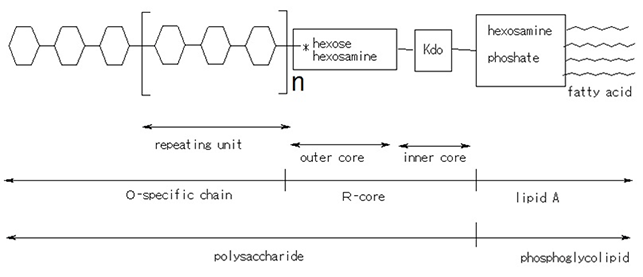
リポ多糖 (LPS) の構造の模式図
リピッドA
リピッドAはリン酸化されたヘキソースに脂肪酸誘導体が結合した界面活性剤の構造をしております。リピッドAは多糖部分より構造のばらつきは少ないようですが、菌の種類によって少しずつ構造が違っているようです。
以上のように、ETは多糖とリピッドAから構成されており、多糖部分は大腸菌だけでも100を超える抗原型があり、大腸菌以外のグラム陰性菌のETもそれぞれ違う構造をしています。そのために試験液中に含まれる未知のETの分子量を確定する事は難しく、ET活性(エンドトキシンユニット)からETの含有量を導くのは難しくなっています。ETの含有量は測定に使用する検量線用ETのEU/gの数値から換算した推定量になります。
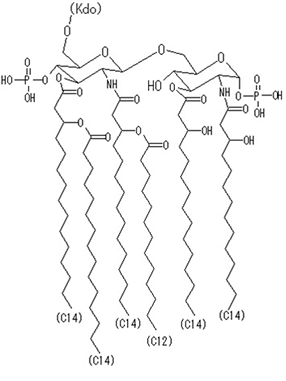
大腸菌のリピッドAの構造
エンドトキシンの不活化方法と除去方法
ETの不活化には幾つかの方法が知られています。ETは一般的な生化学的な分子に比べて非常に熱安定性が高いため、ガラス器具、金属器具は乾熱滅菌(例えば250℃で2時間)による物理的な方法で不活化されます。しかし、この方法は熱に不安定なタンパク質溶液には応用できません。その他の物理的な方法としては、ガンマ線処理や超音波処理が知られています。
化学的な方法としては、アルカリによる処理が最も汎用されています。アルカリのほかにも、過酸化水素、希酸による処理も知られています。このような化学的方法は、精製に使用する分離材や分離装置(カラム)、付随するラインの洗浄、不活化に用いられます。
これらの不活化方法は、ETのみならず目的物質も同時に不活化(タンパク質等が分解、変性)してしまいます。
不安定なサンプルからETを除去するには、乾熱滅菌やアルカリ処理などの不活化処理は使用できません。そのため、不活化処理の他にETを温和な条件で除去する方法が必要となります。
- ろ過法:限外ろ過膜や逆浸透膜は注射用水の製造に使用できますが、ETと同じくらいの分子量を有する物質のET除去には使用できません。
- 吸着法1:活性炭やポリスチレン系合成吸着材はETを吸着する事ができますが、その他の物質も吸着する可能性があり、選択除去には不向きです。ポリスチレン系粒子にプラスチャージを導入したイオン交換樹脂もETを吸着しますが選択性やET除去能は低くなります。
- 吸着法2:より優れたETの選択吸着性を目指した吸着材としては、ポリミキシンBをリガンドにしたものがあげられます。例えばポリミキシンBをCNBr活性化セファロースに固定化したものは、クロマトグラフィー用担体として知られており、現在も入手できます。フォロファイバーにポリミキシンBを固定化したものは敗血症患者の血液浄化治療に現在も使用されています。その他には、ヒスチジン固定化アガロースやキトサン粒子が有りましたが、現在は販売されていません。
セルファイン® ETクリーン
セルファイン® ETクリーンは、従来の吸着材に不足している選択性やET除去能の向上を目指して開発されました。セルロース粒子にポリリジンが導入されたもので、ユニークな点はポリリジンがε-ポリリジン(EPL)であることです。
EPLは微生物Streptomyces albulusが生産する天然のポリカチオンで、弊社より販売しております。特徴として、微生物の生育を抑える働きがあり、食品の日持ち向上に使用され、フードロスの問題解決に微力ならが役立っております。
通常のペプチド結合はアルファ(α)位のアミノ基が使用されますがEPLはイプシロン(ε)位のアミノ基が結合に使用されている点が特徴で、非リボゾームペプチドの一種です。EPLの大きな利点は微生物発酵によって製造しているため、化学合成で製造するαポリリジンよりも安価に製造できる点こと。
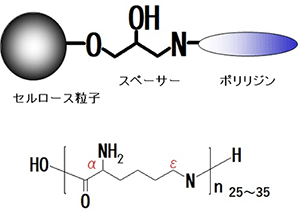
セルファイン® ETクリーンの構造
なぜセルファイン® ETクリーンのリガンドがEPLなのでしょうか?
弊社はセルロース粒子(セルファイン®)とEPLの両方を持っているので両者を利用する事は簡単だと思われることでしょう。ただ、セルファイン® ETクリーンの開発にはそれなりの時間がかかりました。
エンドトキシン吸着材の開発
1997年頃の話になります。EPLの利用に気付く前のことです。当時すでにエンドトキシン吸着材としてはポリミキシンB固定化アガロースが販売されておりました。この先行例を参考にポリミキシンとは別の抗生物質を利用してエンドトキシン吸着材の開発が始まりました。この開発では先行品と同程度の性能の吸着材をつくることが出来ましたが、抗生物質をリガンドとする事には万が一脱離した場合の懸念がありました。
1998年になると熊本大学でEPLを架橋により不溶化した塊状物に優れたエンドトキシン吸着能があることが見出されました。余談となりますが、熊本大学の本里先生は球状セルロース粒子の発明者であり、セルファイン®の重要技術を築いて頂いた1人です。もう1人は東京大学の空閑先生ですがこの話はまた別の機会に。
熊本大学工学部の平山研究室は本里先生の流れを汲む研究室で、そこにいらっしゃった坂田眞砂代先生が架橋EPL塊状物のエンドトキシン吸着能を見出して弊社へ紹介してくれました。
坂田先生は大学に入られる前に製薬会社に勤めた経験があり、その際エンドトキシンでご苦労された経験からエンドトキシン除去材料の研究をしておられました。当時既にポリミキシンB固定化アガロースなど吸着材が販売されていましたが、吸着容量が低いことや、塩濃度に敏感で使用できる塩濃度が制限されるなどの問題があり、新しい材料の開発をされておりました。
EPLを見出す以前に、アミノ化PLMG(球状化ポリ(γ-メチルLクルタメート))にアミノ基を導入したもの、PEI固定化セルロース繊維、重合させて粒子化する方法としてN,N-ジメチルアミノプロピルアミドと架橋性モノマーからの粒子などのご研究されておりました。これらは当時販売されていたエンドトキシン除去材に比べても優れた性能を有しておりましたが、実用化まで至りませんでした。アミノ化PLMGはメタノールの脱離、PEI固定化セルロース繊維はPEIの脱離、重合による粒子化はスケールアップが困難でありました。
1999年には平山研究室との共同研究が始まり、ご指導を頂きながらエンドトキシン吸着材の研究開発を進めました。
まず、架橋EPL塊状物をクロマトグラフィーに適した球状粒子にすることを試みました。EPLの球状粒子は作ることができ、エンドトキシンの吸着能も確認できました。ただ、EPLがαポリリジンに比べて安価であってもセルロースよりは高価でありますので、EPLを有効に利用するには、吸着に必要最小限の量をセルロース担体に固定する方法が有利だと考えました。
セルファイン®のベースのセルロース粒子には細孔径が異なる数種のグレードがあります。これらにEPLを固定化してエンドトキシンの除去性能を調べた結果、特徴のある2種類の製品化を考えました。吸着容量の高い排除限界分子量がおよそ200万付近のETクリーンLと、タンパク質の回収率に優れた排除限界がおよそ2000付近のETクリーンSです。蛇足になりますが、合成ポリカチオンであるポリアリルアミン(PAA)を固定化した粒子も合成してETクリーンと比較しました。PAAもエンドトキシンを吸着しましたが、タンパク質の吸着が非常に強く、使い難い事を確認しております。
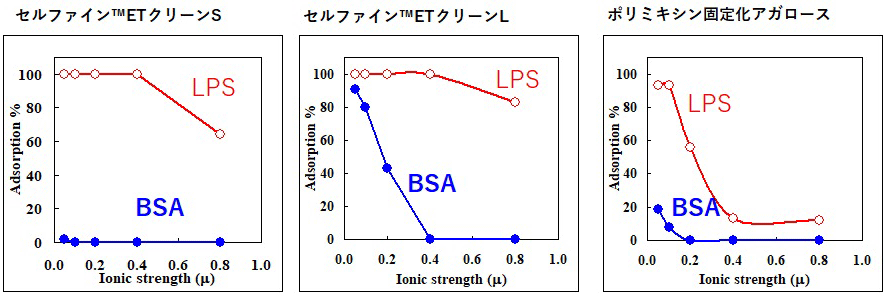
BSAとLPSのETクリーンへの吸着とイオン強度の関係
試験液 BSA500 µg/mL、LPS (E.coliO111:B4) 100ng/mL, リン酸バッファーpH7
この場合イオン強度≒mMです。
2002年には大学発事業創出実用化研究開発事業(略してマッチングファンド)に採択されました。この事業を通して、国際学会での発表や、海外の大手製薬会社への製品紹介など行いました。この活動の中でETクリーンをより手軽に評価するためにプレパックカラム(ミニカラム、現在販売しているミニカラムとは形状が異なります)の開発もできました。
ETクリーンのエンドトキシン吸着機構
ETはグラム陰性菌の細胞壁に存在するリポ多糖(LPS)が本体です。それに含まれるリピッドAはリン酸化された糖に脂質が結合した構造をしております。ETクリーンがかなり高濃度の塩と共存していてもLPSを吸着することを考えると、吸着は単純なイオン交換だけないと思われます。ETクリーンのリガンドであるEPLはプラスチャージできるアミノ基と(CH2)が4個連なる疎水領域が交互にある構造です。高塩濃度でもエンドトキシンが吸着できる理由として、疎水相互作用が考えられます。あくまでも仮説ですが、ETクリーンのエンドトキシン吸着機構は下に示した図のようであると考えております。
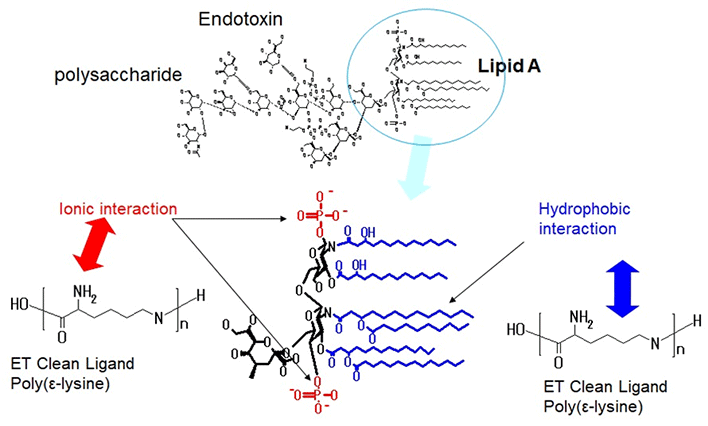
ETクリーンのエンドトキシン吸着機構
ETクリーンLとETクリーンS
両者の一番の違いはポアサイズです。これによってタンパク質の吸着しやすさが違ってきます。またエンドトキシンの吸着能が変わってきます。
| タンパク質の吸着性 | ETクリーンL > ETクリーン S |
| タンパク質の回収性 | ETクリーンS > ETクリーン L |
| エンドトキシン吸着能 | ETクリーンL > ETクリーン S |
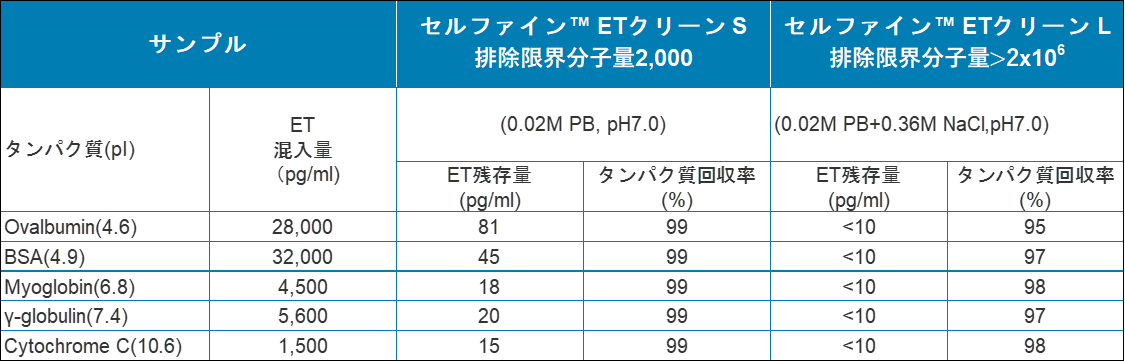
表 等電点の異なるタンパク質からのエンドトキシン除去とタンパク質回収率比較
最後に
セルファイン® ETクリーンは販売から20年以上安定供給されおります。販売先は国内外の研究機関、製薬会社です。多くは小規模なサンプル調製の用途が多いように思えますが、海外の製薬会社では10L以上の大型カラムによる商用生産での使用例も出てきております。
今後はラボ用途向けにプレパックカラムのサイズの充実を考えております。また、大型カラムでの使用に向けた技術サポートの充実と安定供給に努めて参ります。
参考文献
<ETクリーン関連の論文>
J.LIQ. CHROM. & REL. TECHNOL.,25(4), 601-614(2002)
Masami Todokoro, Masayo Sakata 他
Pore-size controlled and poly(ε-lysine)-immobilized cellulose spherical particles for removal of lipopolysaccharides
高分子論文集 Vol.64, No.12pp.821-829 (Dec., 2007)
坂田眞砂代、戸所正美、國武雅司
エンドトキシン選択吸着材としての細孔制御ポリカチオン固定化高分子微粒子の開発
<ポリミキシンB関連の論文>
A.C.Issekutz, J.Immunol. Methods, 61, 275 (1983)
関連製品
- セルファイン®
架橋した真球状のセルロースを基材としたクロマトグラフィー充填剤です。初期検討や小規模なクロマトグラフィーにご利用いただけるプレパックカラム(1mL、5mL)もございます。
- ポリリジン(ε-Poly-L-Lysine)
必須アミノ酸の一種であるL-リジンのε位のアミノ基がカルボキシル基とペプチド結合し、直鎖状につながったポリアミノ酸で、JNCのバイオ技術により製造されている天然物系の素材です。ポリリジンはポリカチオンであるため、優れた抗菌作用を発揮します。また、慢性毒性試験をはじめとする各種毒性試験により、その安全性が確保されており、さらに食品の保存以外にもバイオプラスチックなどへの応用も期待されています。




