【総説】Nor-AZADO触媒的酸化反応の展開と応用
本記事は、和光純薬時報 Vol.91 No.3(2023年7月号)において、東北大学大学院薬学研究科 笹野 裕介様、岩渕 好治様に執筆いただいたものです。
はじめに
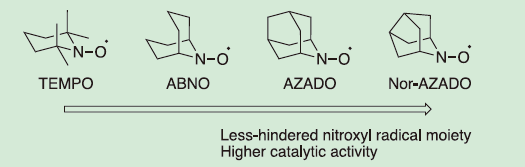
アルコールの酸化反応は、医薬品や生物活性天然物の合成に有用なカルボニル化合物を与える重要反応である。これまで著者らは、2-アザアダマンタンN-オキシル (AZADO) や9-アザビシクロ[3.3.1]ノナンN-オキシル (ABNO) 等の嵩高さの軽減されたニトロキシルラジカルが、既存のニトロキシルラジカルである2,2,6,6-テトラメチルピペリジンN-オキシル (TEMPO) と比較して、アルコールの酸化触媒として大きな触媒回転数と幅広い基質適用性を示すことを報告してきた1)。その中で、9-アザノルアダマンタンN-オキシル (Nor-AZADO) は、AZADOのメチレン基を一つ減らした構造をもち、AZADOやABNOよりさらにコンパクトなニトロキシルラジカル部位をもつ。このような特性から、Nor-AZADOはAZADOやABNOよりさらに高いアルコール酸化触媒活性を示した(図1)2)。
ところで、ニトロキシルラジカル触媒的酸化反応には、オキソアンモニウムイオンを活性種とする機構と銅/ニトロキシルラジカルが協奏する触媒機構の二つが提唱されている。特に、近年では後者の機構において、ニトロキシルラジカルと銅塩を巧みに組み合わせることによって、化学選択性に優れた酸化的分子変換が続々と開発されている。例えば、StahlらによってTEMPO/CuOTf触媒による第一級アルコールからアルデヒドへの空気酸化や3)、ABNO/CuOTf触媒による第二級アルコールからケトンへの空気酸化が開発され4)、生長、金井らによってketo-ABNO/CuBr触媒によるアミンからイミンへの空気酸化が開発された5)。
Nor-AZADOは、富士フイルム和光純薬株式会社から市販され、Organic Square誌で紹介させていただいたお陰で6)、多くの研究者に使っていただけるようになった。本総説では、Nor-AZADO触媒的酸化的分子変換手法の最近の開発事例と、天然物や医薬品候補化合物の合成におけるNor-AZADO触媒的アルコール酸化反応の実施例を紹介する。
Nor-AZADO触媒的酸化的分子変換手法の開発
ニトロキシルラジカル触媒を用いる酸化反応の開発研究は、現在もなお活発に行われており、ABNOやAZADO等の嵩高さが軽減されたニトロキシルラジカルでしか実現できない反応が数多く報告されている。ニトロキシルラジカルの検討の過程で、ABNOやAZADOとNor-AZADOの比較が丁寧に行われている例は決して多くないが、比較された多くの場合においてNor-AZADOが最も高い活性を示すことが確認されている。以下にNor-AZADOの適用が有効であった反応の例を紹介する。
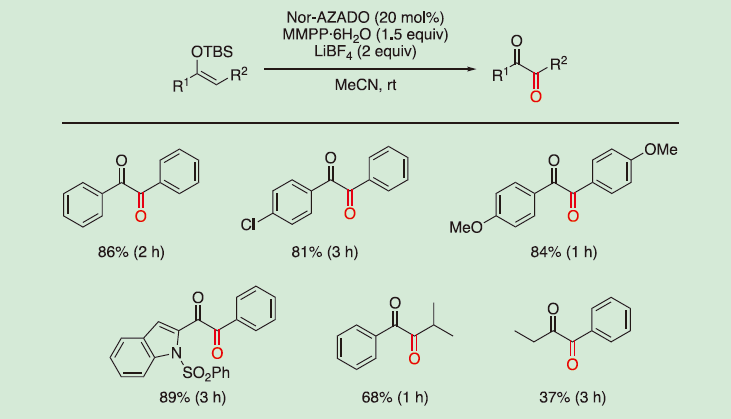
(1) シリルエノールエーテルの酸化による1,2-ジケトン合成7)
1,2-ジケトンは、天然物や生物活性化合物にしばしば含まれる構造であるだけでなく、種々のヘテロ環化合物構築のための足場となる重要な官能基である。2012年に岩渕らは、シリルエノールエーテルからのNor-AZADO触媒的酸化的1,2-ジケトン合成を報告した。シリルエノールエーテルに対して、アセトニトリル溶液中、Nor-AZADO触媒存在下、室温でモノペルオキシフタル酸マグネシウム六水和物 (MMPP・6H2O) を作用させることで、様々なベンジル誘導体が良好な収率で得られた(図2)。
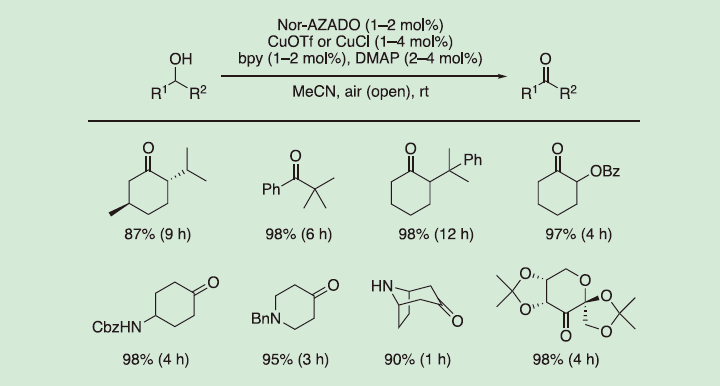
(2) Nor-AZADO/銅協奏触媒による化学選択的アルコール空気酸化8)
アルコールの酸化反応には数多くの反応条件が報告されているにもかかわらず、無保護のアミン等の酸化反応条件に不安定な官能基を許容する高度な化学選択性を有する条件はほとんど報告されていない。2014年に岩渕らは、ニトロキシルラジカルと銅の協奏触媒が、室温下、常圧空気に含まれる酸素を酸化剤として用いて、種々の無保護アミノアルコールを高収率でアミノカルボニル化合物へ変換することを報告した9)。さらに、反応条件の詳細な最適化の結果、第二級アルコールの酸化において、Nor-AZADOが最も高い活性を示すことが明らかになった(図3)。
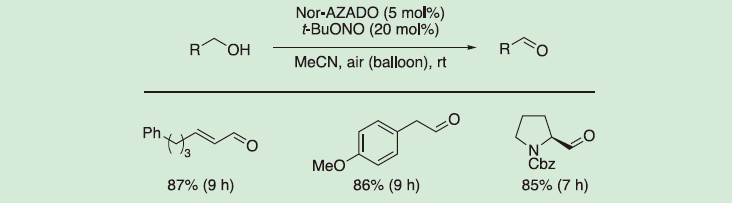
(3) ニトロキシルラジカル/NOx触媒による第一級アルコールからアルデヒドへの選択的空気酸化10)
ニトロキシルラジカル/NaNO2/酢酸条件によるアルコールの空気酸化反応は、様々な官能基を許容して第二級アルコールを対応するケトンへと高収率で酸化するが、カルボン酸への過剰酸化が競合するために、脂肪族第一級アルコールからアルデヒドへの酸化反応を高収率で実現することは困難であった。2017年に澁谷らは、アセトニトリル中ニトロキシルラジカルと亜硝酸tert-ブチルを触媒として用いることで、第一級アルコールからアルデヒドへの酸化反応を高収率で達成した。ニトロキシルラジカル触媒の検討の結果、TEMPOと比較してAZADOがより高い活性を示し、図4に示す3つの生成物については、AZADOでは反応が遅かったためにNor-AZADOを用いて高収率でアルデヒドが得られた。
(4) アルコールとアミドからの空気酸化的イミド合成11)
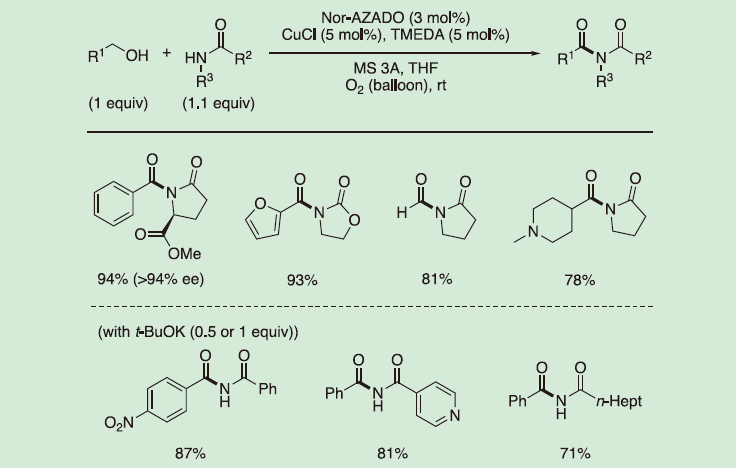
イミドは、様々な医薬品、天然物、および工業原料に含まれる重要な構造単位である。2018年に山口らは、アルコールとアミドからの空気酸化的アシル化反応によるイミド合成を報告した。Nor-AZADO/CuCl/テトラメチルエチレンジアミン (TMEDA) 触媒を、MS3Aの存在下、THF溶液中、酸素 (balloon) 気流下室温で作用させると、様々なアルコールと環状アミド、環状カルバメート類の酸化的アシル化反応が進行した(図5)。メタノールを含む脂肪族アルコールを用いた場合も高収率で反応が進行した。また、化学量論量のカリウムtert-ブトキシドの添加によって、第一級アミドの酸化的アシル化反応が良好から高い収率で進行した。
(5) α-ヒドロキシトリフルオロホウ酸カリウムの酸化反応12)
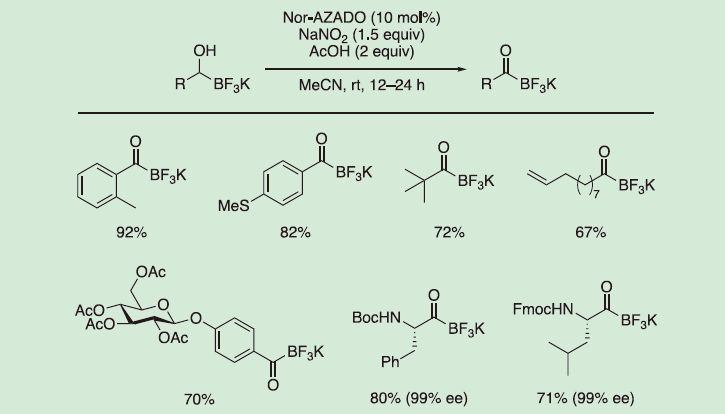
アシルトリフルオロホウ酸カリウム (KAT) は、空気と湿気に安定なホウ素化合物であり、ヒドロキシルアミンとの反応によりアミド結合を形成することから (KATライゲーション)、ペプチド合成に有用である。2019年に伊藤らは、アルデヒドから銅触媒的なボリル化を介して容易に得られるα-ヒドロキシトリフルオロホウ酸カリウムの酸化によってKATを合成する手法を報告した。種々の酸化反応条件の検討の結果、DMSO/Ac2O条件とNor-AZADO (触媒量)/NaNO2条件が高収率を与えた(図6)。Nor-AZADO/NaNO2酸化反応条件は、高度な官能基許容性を示し、ハロゲン、アセタール、スルフィド、エステル等を許容した。また、種々のα-アミノ酸誘導体にも適用可能であり、ラセミ化を起こすことなく目的物を高収率で与えた。
(6) 1,2-ジオールからα-ケト酸への酸化を鍵とするα-アミノ酸のワンポット合成13)
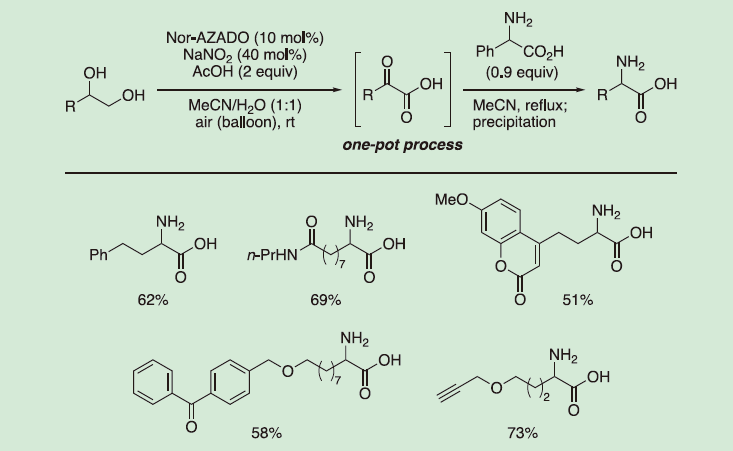
官能基化されたα-アミノ酸は、ペプチドへの導入によりペプチドのプローブ化や生物活性の制御が可能となるため有用である。2019年に澁谷らは、1,2-ジオールからα-ケト酸への酸化反応とDL-2-フェニルグリシンを用いたトランスアミノ化を組み合わせて、ワンポットでα-アミノ酸を合成する手法を報告した。本プロセスの成功の鍵となるのは、1,2-ジオールからα-ケト酸への3段階酸化反応が十分な効率性で進行し、かつ不安定なα-ケト酸の減炭反応が酸化反応条件で進行しないことである。検討の結果、Nor-AZADO/NOx触媒を用いる空気酸化反応がこの要求を満たし、高収率で1,2-ジオールからα-ケト酸への変換を実現することが明らかとなった(図7)。本反応プロセスは、親水性または疎水性側鎖をもつどちらの1,2-ジオールにおいても、良好な収率で対応するα-アミノ酸を与えた。また、蛍光性アミノ酸、光感受性アミノ酸等の様々な官能基化アミノ酸が合成できた。
Nor-AZADO触媒的アルコール酸化反応の全合成への適用
2013年に富士フイルム和光純薬株式会社からNor-AZADOが市販されたことが後押しして、Nor-AZADO触媒的アルコール酸化反応は、天然物や医薬品候補化合物の合成に適用されるようになった。以下にその例を示す。
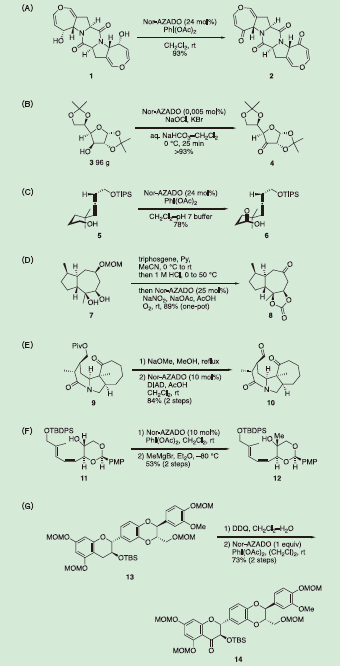
2012年に徳山らは、(-)-acetylaranotinの全合成の終盤における多官能基性ジオール1からビニロガスラクトン2への酸化反応で、種々のアルコール酸化反応条件の中でNor-AZADO触媒的酸化反応が高い効率性を示すことを報告した(図8-A)14)。また、同反応は、(+)- MPC1001Bや15)、(-)-emestrin H、(-)- asteroxepinの全合成16)にも適用された。
2015年に桑原、大類らは、ジアセトン-D-グルコース (3) の酸化反応を検討した結果、次亜塩素酸ナトリウムをバルク酸化剤とするNor-AZADO触媒的アルコール酸化条件が最も良好な結果を与えることを報告した17)。本条件は、わずか0.005 mol%のNor-AZADOを用いて、96 gのアルコール3を対応するケトン4へ30分以内でほぼ定量的に変換した(図8-B)。また、2022年に道田らによって、同様の反応が医薬品のプロセス化学を指向した合成研究に適用された18)。
2017年に塚野らは、avenaolの全合成において、アルコール5からカルボン酸6への2段階酸化反応を、CH2Cl2-pH 7緩衝液の混合溶媒中、Nor-AZADO触媒存在下にPhI(OAc)2を作用させることで、良好な収率で達成した(図8-C)19)。本反応がアレン官能基を許容したことは特筆に値する。
2017年に岩渕らは、(-)-englerin Aの全合成において、Nor-AZADO触媒的アルコール酸化反応が多段階ワンポット反応に有効であることを報告した20)。すなわち、ジオール7からジオール部のカルボナートとしての保護、MOM基の脱保護、続くNor-AZADO/NOx共触媒条件におけるアルコールの空気酸化反応によって、ケトン8を89%の収率で得た(図8-D)。このワンポット合成にDess-Martin酸化を適用すると、アルコールの酸化反応が全く進行しなかった。
2018年に岩渕らは、calyciphylline A型アルカロイドの合成研究において、ピバル酸エステル9のピバロイル基の脱保護によって得られるアルコールからアルデヒド10への酸化反応が、Nor-AZADOを触媒として、DIADをバルク酸化剤として用いる酸化反応条件において高収率で進行することを示した(図8-E)21)。同酸化反応にIBXを適用すると、アルデヒド10ではなく対応するカルボン酸が専ら得られた。
2022年に坂井、森らは、梯子状ポリエーテルの合成研究において、1,3-ジエン官能基をもつアルコール11の酸化反応にNor-AZADO触媒的酸化反応条件を適用した(図8-F)22)。本反応の条件検討は原著論文に記載されていないが、本反応の生成物が非共役 (deconjugated) ケトンであることから、Nor-AZADO触媒的アルコール酸化反応が不安定生成物を与える反応にも適用可能であることが伺える。
2022年に稲井、菅らは、(-)-isosilybin Bの全合成の終盤において、ベンゾジヒドロピラン13のベンジル位酸化によって得られるベンジルアルコール中間体にNor-AZADO触媒的(合成の最終盤であるために化学量論量のNor-AZADOを用いているが)アルコール酸化反応を適用して、ケトン14を良好な収率で得た(図8-G)23)。
おわりに
以上述べてきたように、Nor-AZADOはAZADOやABNOよりもさらに高い活性を示すことが様々な反応の開発を介して実証されてきた。また、Nor-AZADO触媒的酸化反応の多官能基性アルコールへの適用例が徐々に蓄積され、その有用性は確実に立証されつつある。今後、Nor-AZADOが様々な酸化的分子変換に適用され、有機合成化学の発展に寄与することを期待する。
参考文献
- Iwabuchi, Y. : Chem. Pharm. Bull., 61, 1197 (2013).
- Hayashi, M. et al. : Chem. Pharm. Bull., 59, 1570 (2011).
- Hoover, J. M. and Stahl, S. S. : J. Am. Chem. Soc., 133, 16901 (2011).
- Steves, J. E. and Stahl, S. S. : J. Am. Chem. Soc., 135, 15742 (2013).
- Sonobe, T. et al. : Chem. Sci., 3, 3249 (2012).
- Iwabuchi, Y. : Organic Square, 45, 2 (2013).
- Hayashi, M. et al. : Synlett., 23, 1025 (2012).
- Sasano, Y. et al. : Chem. Asian J., 10, 1004 (2015).
- Sasano, Y. et al. : Angew. Chem. Int. Ed., 53, 3236 (2014).
- Shibuya, M. et al. : Synlett., 28, 1554 (2017).
- Kataoka, K. et al. : Chem. Sci., 9, 4756 (2018).
- Taguchi, J. et al. : Angew. Chem. Int. Ed., 58, 7299 (2019).
- Inada, H. et al. : Chem. Commun., 55, 15105 (2019).
- Fujiwara, H. et al. : Angew. Chem. Int. Ed., 51, 13062 (2012).
- Kurogi, T. et al. : Angew. Chem. Int. Ed., 55, 283 (2016).
- Umeki, K. et al. : Tetrahedron, 76, 131630 (2020).
- Fukuyama, K. et al. : Org. Lett., 17, 828 (2015).
- Abe, Y. et al. : Org. Process Res. Dev., 26, 1289 (2022).
- Yasui, M. et al. : Nat. Commun., 8, 674 (2017).
- Morisaki, K. et al. : Org. Lett., 19, 5142 (2017).
- Sasano, Y. et al. : Org. Lett., 20, 3053 (2018).
- Sakai, T. et al. : J. Org. Chem., 87, 579 (2022).
- Inai, M. et al. : Eur. J. Org. Chem., e202200653 (2022).




