【連載】有機分子触媒の軌跡 -基礎から応用まで-「第2回 有機触媒の発展」
本記事は、和光純薬時報 Vol.90 No.4(2022年10月号)において、サイエンスライター 佐藤 健太郎に執筆いただいたものです。
前回、有機触媒の定義とその特徴、発見にいたるまでの歴史について述べた。今回は、さまざまなタイプの有機触媒が報告され、爆発的に進展した過程について述べてゆきたい。
不斉相間移動触媒
相間移動触媒は、水相と有機相の間を行き来しながら反応を進行させるタイプの触媒であり、長鎖アルキル基を持つ四級アンモニウム塩などが用いられる。この相間移動触媒に不斉要素を組み込んで不斉合成に用いる研究は、有機触媒の登場前から盛んに行われていた。メルク社のグループが、シンコナアルカロイドの誘導体を用いて不斉アルキル化に成功したのが1984年であり、有機触媒の先駆的な例に数えられる。
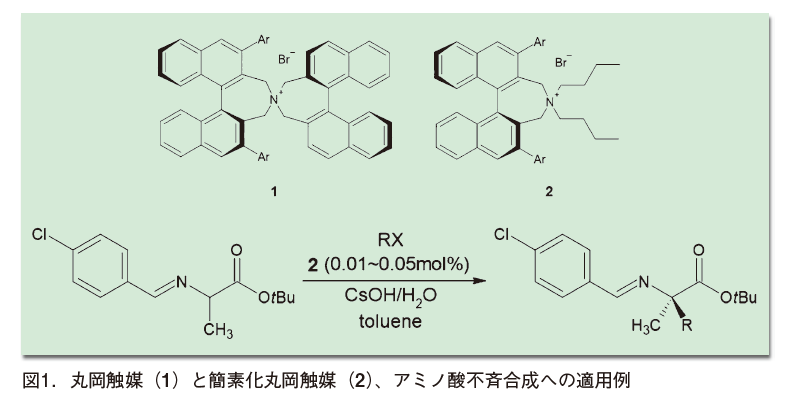
1999年には丸岡らがビナフチル骨格を2つ持つスピロ型四級アンモニウム塩をデザインし、これがα-アミノ酸の不斉合成などに適用可能な触媒として働くことを見出した(図1)1)。汎用性の高い不斉相間移動触媒の報告はこれが初めてであり、注目を集めた。その後、ビナフチル骨格を一つだけにした「簡素化丸岡触媒」も報告されている。有機触媒はかなり多量の添加を必要とするものが多いが、この簡素化丸岡触媒はわずか0.01mol%という添加量で、96%ee前後の高い選択性をもって反応が進行する。これは工業的規模のアミノ酸不斉合成にも展開され、有機触媒研究におけるランドマークの一つとなった。
ケトン触媒を用いた不斉エポキシ化
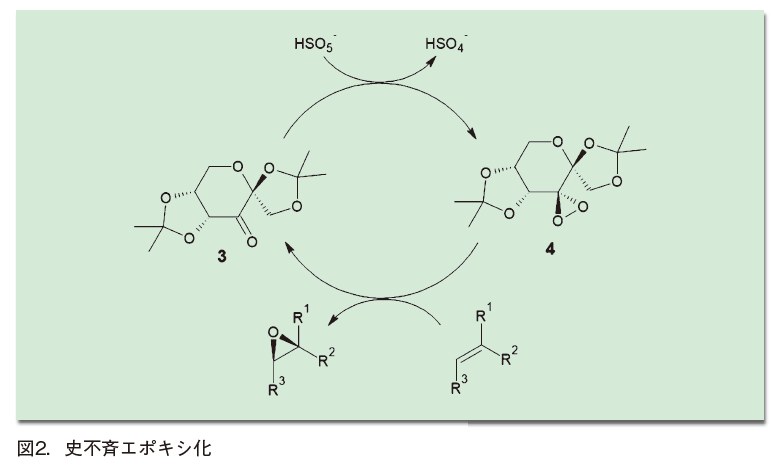
1996年、史一安らはフルクトースから誘導される不斉なケトン(3)を触媒とし、酸化剤としてペルオキシ一硫酸カリウムを用いることで、各種の三置換オレフィンを高いエナンチオ選択性のもとエポキシ化できることを示した(図2)2)。ケトン触媒と過硫酸イオンが反応してできる、ジオキソラン(4)が活性種であると考えられている。
Listら、MacMillanらの論文(2000年)以前に現れたため、一般に有機触媒の文脈で語られることは少ないが、その定義は間違いなく満たしている。時代が違っていればもっと注目を浴びていたかもしれず、「早すぎた有機触媒」といえるかもしれない。
チオ尿素
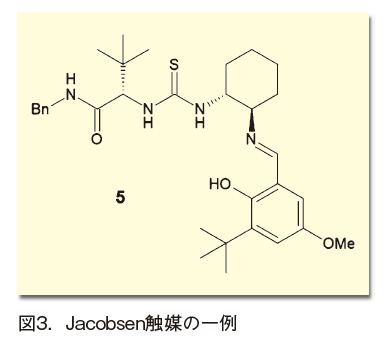
これも有機触媒の概念が提唱される以前の、1998年にE. N. Jacobsenによって報告されている。当時流行していたコンビナトリアル合成の考え方を、不斉合成反応開発に適用する研究の中から発見された(図3)。当初は金属元素への最適な不斉配位子を探索する意図であったが、実は金属は不要であり、配位子だけでもエナンチオ選択的な反応が起きることが見つかったという流れだ3)。
この化合物の持つ触媒作用の鍵となったのは、チオ尿素部分の2つの水素原子だ。これらが基質化合物のカルボニル酸素あるいはイミン窒素原子を挟み込むように水素結合し、ルイス酸のように働いて活性化させる。チオ尿素が通常の尿素より有効なのは、水素の酸性度が高まっていること、また二量化しにくいことが要因と考えられる。
この触媒は、Strecker反応、Mannich反応、Pictet-Spengler反応、シアノシリル化など、多くの反応を高選択的に進行させる能力を持つ。また、この触媒をもとに構造を簡略化したもの、チオ尿素以外の水素結合供与体を用いるものなどが提案され、多くのバリエーションが生まれている。
プロリン誘導体
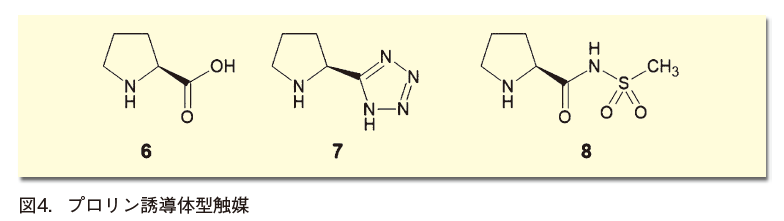
前回も述べた通り、有機触媒ブームの大きなきっかけになったのは、Listらによるプロリン触媒(6)を用いた不斉アルドール反応の報告であった4)。極めてシンプルな構造であるプロリンに手を加えれば、新たな反応性が引き出せると考えるのは自然なことであり、ここから多くのバリエーションが生まれた(図4)。
プロリン触媒による不斉アルドール反応は、プロリンの二級アミン部分がカルボニル化合物とエナミンを形成し、カルボキシ基がもう一つのカルボニル化合物と水素結合を作ることで反応を制御すると考えられる。そこで、このカルボキシ基を他の官能基に置き換えるアプローチが行われた。
プロリンのカルボキシ基の代わりに、同様に酸性を示す官能基であるテトラゾリル基や、N -メタンスルホニルアミド基(-CONHMs)を導入したもの(7, 8)などが報告されている。これらの官能基は、医薬化学の世界でもカルボキシ基の代替として導入されることがあり、生物学的等価体(bioisostere)と呼ばれるが、触媒の世界においても等価体として振る舞うのは興味深い。このうち、たとえばプロリンのカルボキシ基をテトラゾールに置き換えた7は、アセトンとアルデヒドの不斉アルドール反応を、プロリンよりも速く進行させることが報告されている5)。
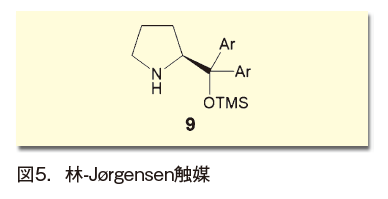
やはりプロリンから誘導される、ジアリールプロリノールシリルエーテル9は、林雄二郎ら及びKarl A. Jørgensenらによって2005年ごろから独立に報告されたため、林-Jørgensen触媒と呼ばれる(図5)6)。アルデヒドα位の不斉ハロ化、アミノ化、Michael付加や、α,β-不飽和アルデヒドの不斉エポキシ化、不斉Diels-Alder反応など、幅広く展開されて成果を上げた。
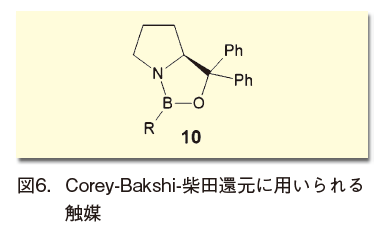
1987年に報告されたCorey-Bakshi-柴田還元も、これに類似した触媒を用いる反応だ(図6)。ジアリールプロリノールから誘導される、オキサザボロリジン骨格を持った10を触媒に、ケトンの不斉還元を行うというものだ7)。プロリン骨格の有用性を示した、先駆的な結果といえる。
プロリンの5員環部分を変換するアプローチももちろん行われている。興味深いのは、単に環を6員環や7員環にしただけのものは、多くの場合反応性・選択性が低下している点だ。触媒能の発現には、コンホメーションが変化しにくい5員環構造が重要なのだろう。
不斉ブレンステッド酸
各種のプロトン酸(ブレンステッド酸)が触媒として働く反応は、古くから数多く知られてきた。ただしそれらはエステルの加水分解など結合切断反応が多く、炭素-炭素結合生成反応にはあまり用いられてこなかった。まして不斉反応に適用した例は、極めて稀であったといえる。
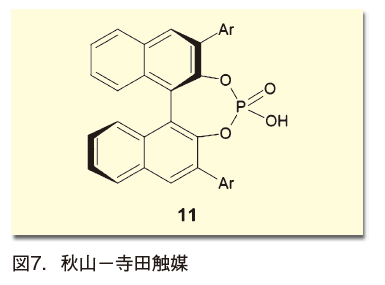
ところが、シンプルなリン酸と、不斉配位子として多くの使用例が積み重ねられてきたビナフトール骨格を組み合わせた化合物が、極めて有効な不斉触媒として働くことが示された。この触媒は、秋山隆彦と寺田眞浩によってそれぞれ独立に開発されたため、秋山-寺田触媒の名で呼ばれる(図7)8)。
この触媒は不斉Mannich反応、アルデヒドへのアリルボランの不斉付加反応、対称ケトンへの不斉Baeyer-Villiger反応など、非常に幅広い分野の反応に適用されており、いずれも優れた選択性を示す。また、ビナフチル骨格とブレンステッド酸というシンプルな組み合わせであることから、さまざまにアレンジされた触媒が開発されており、有機触媒の中でも大きな一分野を築いている。
N -ヘテロサイクリックカルベン触媒
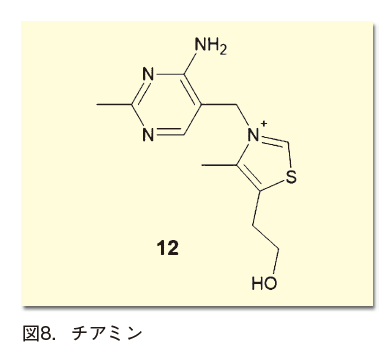
この分野の始まりは、古く1943年にさかのぼる。チアミン(ビタミンB1)がベンゾイン縮合の触媒として働くことを、鵜飼貞二らが報告したのだ。この反応機構は1957年にBreslowらによって解明され、チアミンのチアゾリウム環からプロトンが脱離して生ずるカルベンが鍵中間体であることが判明した(図8)。
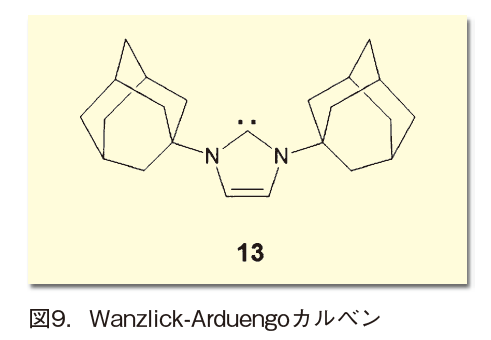
そして1991年、Arduengoらがかさ高い置換基と窒素原子で挟むことでカルベンを安定化し、結晶として取り出すブレイクスルーを成し遂げる(図9)。これによってN -ヘテロサイクリックカルベン(NHC)の化学が開花し、多くの応用研究が展開された。その中で、NHCに不斉要素を組み込み、エナンチオ選択的反応を行う取り組みも盛んに行われている。
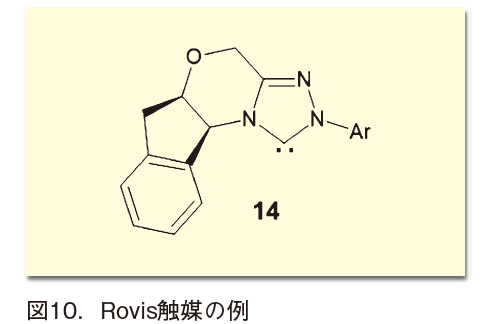
たとえばRovisやBodeは、図10のような4環性化合物を設計し、不斉Stetter反応などに適用して高い選択性を実現している。これらNHC触媒の化学については以前も取り上げたので、詳細は当該記事(Organic Square , 48, 8(2014).)及びそちらに挙げた参考文献を参照していただきたい。
この他にも、4-ジメチルアミノピリジン(DMAP)やグアニジンをベースとしたものなど、多くのタイプの触媒が報告されている。一口に有機触媒といっても、その構造や反応機構は実に多様であることが改めて感じられる。有機触媒を金属触媒などと組み合わせて、さらなる反応性を引き出す研究も多数なされ、発展を遂げている。こちらについては、次回以降に触れてゆきたい。
参考文献
- Hashimoto, T. and Maruoka, K. : Chem. Rev .,107, 5656 (2007) ; Ooi, T. and Maruoka, K. :Angew. Chem. Int. Ed ., 46, 4222( 2007).
- Tu, Y. et al . : J. Am. Chem. Soc ., 118, 9806(1996).
- Doyle, A. G. and Jacobsen, E. N. : Chem.Rev ., 107, 5713( 2007).
- L ist, B. : J. Am. Chem. Soc ., 122, 9336( 2000).
- Hartikka, A. and Arvidsson, P. I. : Eur. J.Org. Chem., 20, 4287( 2005).
- Jensen, K. L. et al . : Acc. Chem. Res ., 45, 248(2012).
- Corey, E. J. et al . : J. Am. Chem. Soc ., 109,5551( 1987).
- A kiyama, T. : Chem. Rev ., 107, 5744( 2007)




