【連載】よくわかるBDNF―基礎から臨床まで―「第5回 BDNF 研究のこれから」
本記事は、和光純薬時報 Vol.90 No.3(2022年7月号)において、藤田医科大学 研究推進本部 小清水 久嗣様に執筆いただいたものです。
はじめに
本シリーズではこれまでの4回の連載を通じ、脳由来神経栄養因子(BDNF)が中枢神経系の正常な発達や機能発現において重要な役割を果たすほか、統合失調症や自閉症をはじめとした精神疾患の病態形成に関与する可能性があることなどをみてきた。ちょうど40年前にBardeとThonenがBDNFの単離の成功を報告して以降1)、BDNFに関する論文は今日までに実に28,800報以上が出版されている(2022年4月PubMed調べ)。まさにBDNFの重要性を反映するものであろう。
しかし、いわゆるトップジャーナルから出版される関連論文の報数は、年々減少の傾向がみられる。これは、BDNFの基本的な機能やその機序についてはすでに一通り解明され、BDNFをめぐる大きな謎はもう残されていないということを意味するのであろうか? BDNFの研究は今後どこへ向かうのであろう? シリーズ最終回となる本稿では、ホットなトピックや課題について代表的なものをいくつか取り上げ、BDNF研究の今後の展望について解説する。
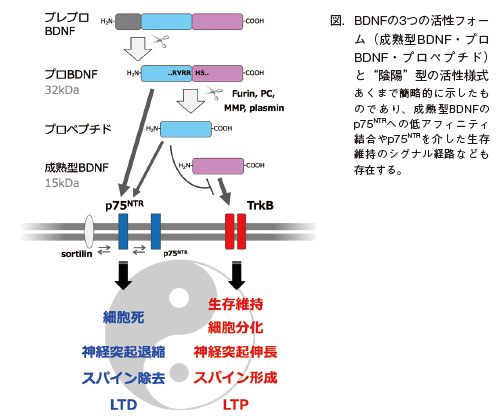
プロ体とプロペプチド
第1回で触れた通り、いわゆるBDNFとは成熟型BDNF(matureBDNF)を指す。BDNF蛋白質はmRNAからの翻訳直後はプレプロBDNF(pre-proBDNF)と呼ばれる前駆体で、N末端のシグナル配列を有する。粗面小胞体の内腔に挿入されたプレプロBDNFはシグナル配列が切除されてプロBDNF(proBDNF)が生成される2)。プロBDNFを含む神経栄養因子のプロ体は、生理活性をフルに示すことができる成熟型蛋白質の単なる作りかけであろうとばかりに永らく傍に置かれ、その詳細な機能の理解は今世紀に入ってから進んだ。米国コーネル大学のHempsteadらは、プロ体が成熟型とは異なるユニークな特性と生理活性を持っていることを、神経成長因子 NGFにおいて初めて見出した3)。
神経栄養因子はその名の通り、神経細胞の生存促進や神経突起の伸長を促すが、プロNGFは神経栄養因子の受容体p75NTRに対し成熟型NGFの約5倍のアフィニティで結合し、p75NTR依存的にプログラム細胞死(アポトーシス)を誘導するほか、上頚神経節ニューロンの神経突起の伸長を抑制することを示したのである3)。また成熟型BDNF は、海馬におけるある種のシナプス伝達の長期増強(LTP)の形成に必須であることが知られているが4)、米国衛生研究所(NIH) のLuら( 当時) は、プロBDNFがp75NTR依存的に海馬においてシナプス伝達の長期抑圧(LTD)を誘導することを見出した5)。
また、成熟型BDNFは海馬ニューロンのスパイン密度を上昇させるが、著者らはプロBDNFが同密度を低下させることなどを示している6)。このように神経栄養因子のプロ体と成熟型が、同一遺伝子の産物であるにもかかわらず真逆の生理活性を示す性質は、二重人格「ジ キルとハイド」7)、東洋思想の「陰陽(Ying-Yang)」8)に例えられている。成熟型BDNFとそのプロ体の産生のバランスが狂った場合、脳機能に大きな影響が現れることは想像に難くない。HempsteadらのグループとKojimaらのグループは、それぞれ独自にプロテアーゼ抵抗性をもつプロ体BDNFを発現するノックインマウスを作製している9, 10)。これらのマウスでは、プロ体BDNFは発現するが成熟型BDNFは産生されない。
第2回でも紹介したようにBDNFノックアウトマウスのホモ個体では心臓形成の不全や心筋内出血などにより生後数日で多くが死んでしまうが11)、一方でプロ体BDNFノックインマウスではこうした心臓の異常はみられず、ホモ個体も成体まで生存する10)。しかし、同マウスのヘテロ個体の海馬ニューロンでは、樹状突起の形態異常やスパイン密度の低下のほか、電気生理学的性質の異常(LTPの抑制とLTDの亢進)がみられ9)、さらにヘテロ個体は巣作り行動の異常を示したほか、社会的隔離を受けた個体でうつ様行動の亢進がみられるなど、行動表現型においては精神疾患に関連した異常が観察された10)。
こうした知見は成熟型BDNFとそのプロ体の産生のバランスの異常が、精神疾患の病態形成に関与している可能性を示している。さて、プロ体は細胞内(分泌小胞またはトランスゴルジ網)においてはプロテアーゼのfurinまたはprohormone convertase(PC)によって2, 12)、あるいは細胞外においてはmatrix metalloproteinase(MMP)または神経活動依存的にtPA/plasminによって切断を受け13-15)、成熟型が生成されると考えられている。この際、切り出されたN末側の半分がBDNFプロペプチド(pro-peptide)である。プロペプチドは、プロ体以上にほとんど関心を払われてこなかった。第1回でも紹介したように成熟型はβシート(βヘアピン)構造を有した安定的な二次構造を取るのに対し、プロペプチド領域はランダムコイル構造が大半を占め、安定的な構造をもたないと推測される6)。Kojimaらは、BDNFプロペプチド単体で、海馬においてp75NTR依存的にLTDを誘導する活性を持つことを見出した16)。
成熟型BDNFは海馬での低頻度刺激によるLTD誘導に対して抑制的効果を示すが、BDNFプロペプチドの存在下では、成熟型BDNFによる効果はキャンセルされ、さらにLTD誘導が増強される16)。これはBDNFプロペプチドが成熟型BDNFに特異的に高いアフィニティで結合する17)ことによるものと考えられる。すなわち、プロペプチドは単体で活性を持つのみならず、成熟型BDNFとの相互作用を通じその機能発現を調整している可能性がある。さらにプロペプチドとプロ体は機能的に競合する可能性が考えられるが、その制御機構の存在や生物学的意義などは全く謎である。
BDNF と精神遺伝学~メガGWASが明らかにしたこと~
第3回で取り上げたヒトBDNF 遺伝子の一塩基多型(SNP)のひとつrs6265 (Val66Met) は、その頻度の高さと、エピソード記憶のパフォーマンスの低下という脳高次機能における表現型から、極めて高い関心を集めてきた18)。統合失調症や双極性気分障害は遺伝率がいずれも80%と極めて高いことが知られているが、こうした精神疾患とBDNFや関連分子の遺伝的バリアントとの相関(発症率や薬剤反応性など)は積極的に研究が行われてきた。
第3回で紹介したように有意な相関を示唆する報告は少なからずあるが、しかしその多くは単一や少数の民族・人種で構成される集団で行われているほか、そのサンプルサイズは必ずしも大きくないというlimitationがある。果たしてさらに大きな規模ではどうか? 国際コンソーシアムPsychiatric Genomics Consortium(PGC)は、統合失調症や双極性気分障害などの精神疾患を対象とし、全ゲノム関連解析(Genome Wide Association Study;GWAS)のメタ解析を世界規模で行っている19)。そのサンプルサイズは巨大で、SNPのメタ解析では実に二桁万人台にも達している。
SNPのGWASにおいては、p 値5.0×10−8未満をゲノムワイド有意水準とみなすが、BDNFやその受容体の遺伝子領域にこの有意水準を満たした遺伝子座は含まれていなかった。一例として、BDNF のrs6265(Val66Met) と統合失調症との相関のp 値は7.95×10−5とゲノムワイド有意水準を満たさず、またオッズ比は1.052で、すなわちたった5%程度の差しかないことが報告されている20, 21)。
もっとも、ゲノムワイド有意水準を満たす100以上のリスク遺伝子座についても、それらの効果量は総じて小さく、診断に用いられるようなSNPはそもそも存在しない可能性が極めて高いことが明らかとなってきている22)。こうした精神疾患では、一部の例外を除き、多数の因子の効果が合わさって病態が形成されると考えられる。その中でBDNFシグナルが生化学的、生理学的レベルで機能的に関与する可能性はもちろん否定されない。また、BDNFや関連分子の遺伝的バリアントを導入したマウスについても、そこでみられる表現型がヒトでの病態の一部分と共通性を有する可能性は否定されないであろう。
BDNFと関連分子と創薬
これまでに解説したようにBDNFは様々な細胞・組織において多岐にわたるクリティカルな機能をもつ分子であり、精神疾患をはじめとした様々な疾患において病態形成への関与を示す知見も多い。それ故、BDNFとその関連分子は治療のターゲット分子や診断のバイオマーカーの候補分子として注目されてきた。
第4回で解説したようにBDNF/TrkBシグナルは細胞のがん化や、がん細胞の浸潤・転移の促進の原因となる場合がある。神経栄養因子の受容体であるTrkの遺伝子(NTRK)が染色体転座により全く別の遺伝子(ETV6 、LMNA 、TPM3 など)に融合した異常な遺伝子「NTRK融合遺伝子」が、様々ながんにおいて見つかっている23)。同遺伝子から生合成されるNTRK融合蛋白質は、がん細胞の増殖を促進していると考えられており、この融合蛋白質を発現するがんをターゲットとし、同分子のチロシンキナーゼ活性を阻害する薬剤の開発が進んでいる23)。これらは、NTRK融合蛋白質のリン酸化を阻害し、下流のシグナル伝達を阻害することにより、腫瘍の増殖を抑制する。すでにロシュ社のエヌトレクチニブ(製品名:ロズリートレク)やバイエル薬品社のラロトレクチニブ(製品名:ヴァイトラックビ)が上市され、治療に用いられている24, 25)。
精神・神経疾患でも、BDNFに注目した臨床研究が欧米や中国など世界各国で行われている。第4回に紹介したAMPA型グルタミン酸受容体を直接のターゲットとするAMPAkineのように、別分子を刺激することで間接的にBDNFの産生量を増加させ、BDNFの生理活性により疾患の治療を狙おうとする薬剤の開発が試みられてきた( なおAMPAkineのOrg 24448は有害事象のため治験中止となっている(NCT00113022))。また抗うつ薬などの薬剤や、運動や栄養などの刺激の効果を測るリードアウトとして血清BDNF濃度を評価するものや、Val66Met(rs6265) SNPをはじめとしたBDNF遺伝子の遺伝的バリアントについて各種の治療効果に対する感受性を評価するという試みが多くある。
直接的にBDNFそのものを操作する試みも始められている。米国カリフォルニア大学サンディエゴ校の研究グループは、初期のアルツハイマー病(eAD)および軽度認知障害(MCI)に対する遺伝子治療のP1臨床試験(NCT05040217)を実施中である。これは、術中MRIによる画像支援の下、患者脳の嗅内野および海馬領域にアデノ随伴ウイルス(AAV)ベクターを用いてBDNF 遺伝子を導入し、発現したBDNF蛋白質をもって神経細胞死を抑制、シナプスの再形成を促進させ、eADおよびMCIの進行を食い止めようという野心的な試みである。現在まさに進行中のプロジェクトであり、その成否が注目される。
おわりに
冒頭に記したように、いわゆるトップジャーナルに掲載されるBDNFに関する論文の数には減少傾向がみられる。しかしながら、一年に出版されるBDNF関連論文の総数は一貫して増加を続けている(2001年:391報→2011年:1,365報→2021年:2,512報)。これは、一定の理解が進んだBDNFの機能やその機序について、様々な系での評価や応用が進められている状況を反映 したものであろう。
BDNFの基本的な性質については、前述のプロペプチドの機能をはじめ、本稿では取り上げられなかったが、末梢組織におけるBDNFの機能や、BDNFの制御的/構成的分泌にかかわる分子マシーナリーの実体など根本的な部分において、依然としてさまざまな謎が残されている。
精神・神経疾患の臨床研究では、間接的にBDNFの発現上昇を期待するアプローチが目下のところメジャーであり、BDNFそのものを直接制御しようという試みはまさに始まったばかりである。その大きな理由のひとつは、BDNFが様々な細胞や時間において多様な活性を有するため、標的部位やタイミングに限局した効果を与えるような制御が難しいという点にあろう。
時間・空間の精密な制御を可能とする、光遺伝学やゲノム編集、各種送達媒体などの強力な新技術が応用されることで、BDNFやその関連分子を直接のターゲットとした精神・神経疾患の治療方法や予防方法の開発が進展することが期待される。BDNFは古くも新しい分子である。基礎研究はまだ謎を残しつつも、その長年の成果は着実に臨床研究に繋がってきている。基礎と臨床、それぞれの研究において、これからも我々を驚かせ、福音となるような成果が登場するであろう。
謝辞
本邦における神経栄養因子研究のパイオニアである元・大阪大学蛋白質研究所 畠中寛教授26, 27)に敬意と感謝の意を表します。
参考文献
- Barde, Y. A. et al . : EMBO J ., 1, 5(1982).
- Lessmann, V. et al . : Prog. Neurobiol ., 69, 5(2003).
- Lee, R. et al . : Science , 294, 5548(2001).
- Patterson, S. L. et al . : Neuron , 32, 1(2001).
- Woo, N. H. et al . : Nat. Neurosci ., 8, 8(2005).
- Koshimizu, H. et al . : Mol. Brain ., 2, 1(2009).
- Ibáñez, C. F. : Trends Neurosci ., 25, 6(2002).
- Lu, B. et al . : Nat. Rev. Neurosci ., 6, 8(2005).
- Yang, J. et al . : Cell Rep ., 7, 3(2014).
- Kojima, M. et al . : Int. J. Mol. Sci ., 21, 11(2020).
- Donovan, M. J. et al . : Dev. Camb. Engl ., 127,21(2000).
- Mowla, S. J. et al . : J. Biol. Chem ., 276, 16(2001).
- Bruno, M. A. and Cuello, A. C. : Proc. Natl.Acad. Sci., U. S. A., 103, 17(2006).
- Mizoguchi, H. et al . : J. Neurosci. Off . J. Soc.Neurosci ., 31, 36(2011).
- Pang, P. T. et al . : Science , 306, 5695(2004).
- Mizui, T. et al . : Proc. Natl. Acad. Sci ., 112,23(2015).
- Uegaki, K. et al . : Int. J. Mol. Sci ., 18, 5(2017).
- Egan, M. F. et al . : Cell , 112, 2(2003).
- Sullivan, P. F. et al . : Am. J. Psychiatry , 175,1(2018).
- Schizophrenia Working Group of the Psychiatric Genomics Consortium : Nature ,511(7510), 421(2014).
- Di Carlo, P. et al . : Psychiatr. Genet ., 29, 5(2019).
- 池田匡志著:精神経誌, 120, 2(2018).
- Jiang, T. et al . : Acta Pharm. Sin. B , 11, 2(2021).
- Drilon, A. et al . : Lancet Oncol ., 21, 2(2020).
- Hong, D. S. et al . : Lancet Oncol ., 21, 4(2020).
- 畠中寛著:「神経成長因子ものがたり」(羊土社)(1992).
- 畠中寛著:「モノとしての「脳」」(講談社)(1994).




