【総説】連続フロー選択的水素化反応のためのポリシラン修飾担持パラジウム/ 白金触媒
本記事は、和光純薬時報 Vol.90 No.3(2022年7月号)において、東京大学大学院理学系研究科化学専攻 齋藤 由樹様、GSC社会連携講座 石谷 暖郎様、小林 修様に執筆いただいたものです。
はじめに
連続フロー法による有機合成が、従来のバッチ法と比較し、環境調和性・効率・安全性に優れた次世代の合成手法として注目を集めている1-11)。例えば、米国食品医薬品局(FDA)では「連続合成は次世代の医薬品製造法となる」と宣言している12)。フロー法による有機合成はその反応形式により大きく4種に分類されるが、筆者らの研究グループでは、特に不均一系触媒を用いる反応形式に注目し研究開発を行ってきた13)。
この反応形式は、不均一系触媒を充填したカラムを反応器として用い、原料の溶液を送液することで目的物を連続的に得る合成法であり、触媒の分離・再使用が連続的に達成されるという利点を有している。また、得られる生成物の溶液を、単離操作を行うことなく次の反応に用いれば、多段階合成も効率よく行うことができ、複雑な構造を有する化合物の合成も可能となる14)。多段階フロー変換で化合物を合成する方策を設定するにあたり、後段に副生成物を与えない付加反応を取り入れることは極めて重要である15)。
この観点から、水素付加を利用した還元的な骨格形成・官能基変換は重要なツールとなる。筆者らはこの点に着目し、水素ガスを還元剤として用いる種々の官能基選択的なフロー還元手法の開発を行っている。従来金属試薬を用いて行われていた還元反応を水素化反応に置き換えることができれば、無機塩の副生成物を生じない環境調和型の反応が実現される16, 17)。
フロー水素化触媒
不均一系触媒を用いる連続フロー水素化では、反応器内で水素・基質溶液が触媒(固体)に直接接触するため、バッチ法では実現できない高効率が期待される18)。ここで、フロー反応における不均一系触媒開発では、基質や気体が触媒表面に接触しやすい環境が重要となる。
筆者らは、ポリシラン・担体の分散液中で金属塩を還元処理することにより調製される、ポリシラン修飾担持ナノ粒子触媒を用いて研究を進めている19-28)。ポリジメチルシラン・アルミナ担持パラジウム触媒がその代表である。この触媒は、担体上に数nmの金属ナノ粒子が担持され、その表面をポリシラン高分子が覆い、ポリシランのSi-Si結合が金属ナノ粒子に多点的に配位した構造を有している。また本触媒は、担体・調製法の選択によって、触媒の活性・基質との相互作用・選択性のチューニングが可能である。
最近の研究成果として、2020年の和光純薬時報では核水添触媒開発に関して寄稿しているが29)、本稿では官能基の選択的水素化とファインケミカルズ合成への応用についての成果を概説したい。
さて、フロー条件での触媒評価は、触媒の活性(TOF)や選択性と同時に、耐久性(TON)も重要な評価指標となる。フロー条件では、固定床中の触媒(活性点)量に対し、単位時間に供する基質量(濃度×流速)を条件、すなわち時間空間速度として設定する。これを基準に触媒回転頻度(TOF)が決まり、この条件で目的物への転化が維持される時間を求めることにより触媒回転数(TON)が決まる。この点はバッチ条件でのTOF、TONとはやや異なる。異なる反応条件で触媒活性や耐久性、生産性を議論する際には、TOFやTONに基づき比較することが重要である。
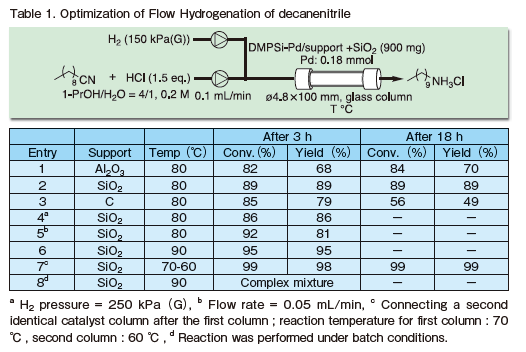
DMPSi-Pd/SiO2 触媒によるニトリルの第一級アンモニウム塩への選択的フロー水素化22)
ニトリルの還元反応は第一級アミンを選択的に合成する有力な手法であるが、従来法では水素化アルミニウムリチウムなどの反応性の高い金属ヒドリド還元剤を用いる必要があった。近年、遷移金属触媒を用いた環境調和型の水素化も報告されているが、高温・高圧条件が必要となるだけでなく、過剰反応を抑えた第一級アミンへの選択的変換は特に困難とされていた30-32)。
そこで、筆者らが開発したポリシラン修飾担持パラジウム触媒を用いて、温和な反応条件下での選択的な水素化を試みることとした。まず、デカンニトリルをモデル基質として1.5等量の塩酸存在下、連続フロー条件において、種々触媒の検討 を行った(Table 1)。
まず、DMPSi-Pd/Al2O3を用いたところ、82%の転化率で反応が進行した一方、選択性は80%程度に留まり副生成物としてデカンアルコールが得られた (Entry 1)。これは、反応中間体であるイミンが加水分解されアルデヒドとなり、更に水素化され生成したと考えられた。選択性向上のため担体の検討を行ったところ、SiO2を用いることで転化率を損なうことなくほぼ100%の選択性で目的の第一級アンモニウム塩が得られた(Entry 2)。
一方、市販のPd/Cを触媒として用いたところ、反応初期では良好な転化率かつ90%以上の選択性が得られたが、18時間後に転化率が56%まで低下し、触媒が不活性化していることが確認された (Entry 3)。市販のPd/Cをフロー反応に用いた際、初期の活性は高くても失活が早かったり圧力損失が問題になったりするケースが、他でもしばし見られる。
以上の結果から、DMPSi-Pd/SiO2を最適触媒と定め、更なる条件検討を行った。水素圧、基質溶液流速の調整では収率の向上に至らなかったが(Entries 4, 5)、反応温度を90℃まで上昇させることで95%以上の収率で目的物が得られた (Entry 6)。また、カラム内に充填する触媒量を2倍とすることで、60-70℃の反応温度においてもほぼ定量的に目的物が得られることも明らかとなった(Entry 7)。本反応をバッチ条件にて行ったところ、複雑な混合物を与えた。フロー反応特有の反応性・選択性が発現した非常に興味深い事象である(Entry 8)。
次に、最適条件下、基質一般性の検討を行った(Figure 1)。芳香族ニトリルを基質として用いた場合は、水素圧1.5気圧、反応温度60℃の条件にて反応が進行し、無置換の基質(2b)やm -, p -位にMe基が置換した基質(2c, d)では定量的に目的物が得られた。
一方で、立体障害を有する基質(2e)や電子豊富な芳香環を有する基質(2f, g)では反応性の低下が確認されたが、水素圧を2.5気圧とすることで98%以上の収率で目的物が得られることが判明した。また、電子不足な芳香環を有する基質(2h, j)では副生成物としてアルコールが確認されたが、中間体の加水分解を抑制するメタノール/1,4-ジオキサン混合溶媒を用いることで97%以上の収率で目的物が得られた。また、本反応条件はピリジン環を有する基質(2k, l)にも適用可能であった。また、脂肪族ニトリルに対しては、第 一級・第二級・第三級いずれのニトリルについても最適条件下目的物が得られた(2a, n-p)。また、アセトニトリルの水素化も可能であった(2q)。
エステルを分子内に有する基質についてはニトリルのみが選択的に水素化され、アミノ酸誘導体が高収率で得られた(2r)。また、ナイロン6,6の原料として用いられるヘキサメチレンジアミンも、対応するジニトリルの水素化により合成することが可能であった(2s)。最後にベンジルニトリルについても同様の反応条件下、水素化が可能であり、生理活性化合物として知られるフェネチルアミン類の連続合成が達成された(2t-w)。
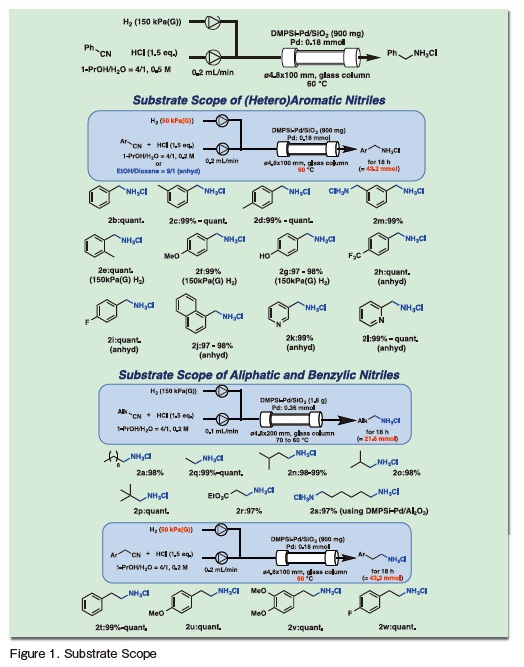
興味深いことに、基質一般性の検討において、還元を受けるシアノ基の電子的環境や立体的環境は反応活性に大きな影響を与えず、直鎖脂肪族置換基を有する第一級ニトリルが最も低い反応性を示すことが明らかとなった。反応条件の検討において水素圧の上昇が添加率の向上を示さなかったことを合わせて考えると、本触媒反応の律速段階は生成するアミンのパラジウムナノ粒子からの脱着であることが示唆される。
一般に長鎖脂肪族アミンが金属ナノ粒子の安定化剤として知られることも、本仮説を支持するものである。本反応において塩酸の添加が効果的である理由は、生成するアミンをプロトン化することで副反応を抑制するだけでなく、プロトン化によりアミンの触媒種からの脱着を促進し、吸着を阻害するためであると考えている。
本反応では塩酸を添加しているため生成物は第一級アミンの塩酸塩として得ることができ、この点は、生成物を簡便かつ安定に取り出す上で有効である。Figure 2の系における触媒性能は下記のように定量的に評価できる。まず、カラム中のPdとニトリル基質の単位時間あたりの接触比、すなわち物質量基準の時間空間速度は33.6 h−1であるから、表記条件でのTOFも33.6 h−1である。
この条件で、長時間のフロー反応を行ったところ、300時間のフロー反応においても触媒の活性・選択性の低下は確認されなかった。従って、PdのTONは10,000以上と見積もることができる。また、単位時間・単位体積あたりの生産量、すなわち空間時間収率(STY)は0.12 g/mL hである。なお、反応前後でPdナノ粒子の凝集が起こらないこと、反応溶液中へのPdの溶出も検出限界以下であることを確認している。
最後に、本反応を実際の医薬品原体(API)合成に応用した。ベンジルニトリルは比較的酸性度の高いプロトンをα位に有しているため、筆者らのグループで開発した強塩基性樹脂触媒によるフローアルドール反応の基質として適用が可能であった33)。シクロヘキサノンを求電子剤として−60℃の条件下でフロー反応を行ったところ、90%以上の収率で目的の第三級アルコールが得られた。本反応で得られる生成物の溶液の溶媒を留去し、エタノール/ 1,4-ジオキサン溶液とすることで、精製操作を行うことなく水素化反応の原料溶液として使用することが可能であった。4.5気圧の水素圧とすることで、アルコールの脱離を抑制し、目的のアミノアルコール塩酸塩が90%以上の収率で得られた。
また、得られた溶液を1段階目のアルドール反応で用いた塩基性樹脂が充填されたカラムに送液することで、フロー条件での中和反応も可能であり、アミノアルコールが定量的に得られた。得られる粗製生成物に対して、バッチ反応にてN ,N -ジメチル化反応を行うことで抗うつ剤であるVenlafaxineの合成を達成した(Scheme 1)。
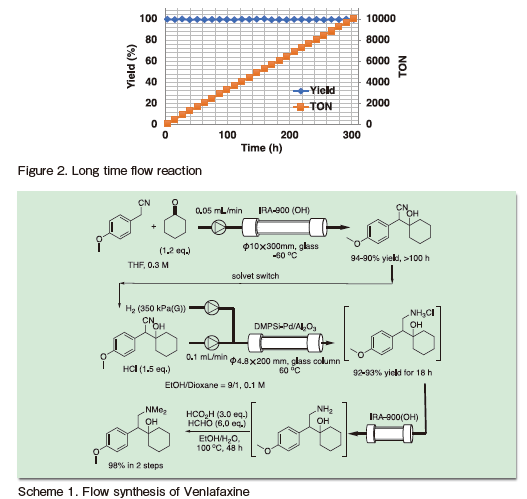
DMPSi-Pt/AC-CP 触媒による脂肪族ニトロ基の第一級アミンへの選択的フロー水素化34)
第三章ではニトリルの水素化による第一級アミンの合成手法について述べたが、ニトロ基の水素化反応も第一級アミンの有力な合成手法である。芳香族ニトロ化合物の水素化反応によるアニリン合成はフロー反応においても数多くの報告例がある一方、脂肪族ニトロ化合物の水素化による第一級アミン合成の報告例は非常に限られていた。筆者らは以前にDMPSi-Pd/BC (BC =Bone Charcoal : 骨炭)触媒による水素化反応が本反応に有効であることを見出し、ロリプラムの連続合成にも適用した13)。
一方で、本触媒は根本的な問題を抱えていた。担体である骨炭がバイオマス由来の素材であり、その組成や供給が不安定な点である。筆者らは、骨炭類似の化合物組成により、安定供給可能な触媒を創出できると考え、新たにAC-CP触媒を開発した。 AC-CP担体は、骨炭の主成分である活性炭(AC)とリン酸カルシウム(CP)の複合担体であるが、その組成を変更することで活性を任意に制御できる可能性がある。
まず、ACとCPを種々の割合にて担体としたポリシラン修飾パラジウム触媒を調製し、その活性評価をバッチ条件下にて行った(Figure 2)。その結果予想通り、組成比は触媒活性に大きな影響を与え、AC : CP = 3 : 1の際に最も高い活性を与えることが明らかとなった。最適触媒を用いて、フロー条件下にて検討を行ったところ、DMPSi-Pd/BC触媒を凌ぐ活性が発現したが、ハロゲンやBnOなど水素化分解しやすい他の官能基との選択水素化が困難であることがわかった。そこで、金属種をPdから白金へと変更したところ、上記のような基質においても活性を損なうことなく、ニトロ基のみを選択的に水素化できることが明らかとなった(Scheme 2)。
本反応を活用することにより、医薬品原体中間体の連続・連結合成も実現した。フロー条件下、ニトロオレフィンの合成と続く固定化カルシウム触媒によるエナンチオ選択的1,4-付加反応により得られるp -Cl置換芳香環を有する脂肪族ニトロ化合物に対して、選択的水素化反応を行うことで、光学活性ラクタムが高収率で得られ、バッチ条件下での開環反応により医薬品原体(API)であるBaclofenの合成を達成した(Scheme 3)。
また、ここで開発したDMPSi-Pt/AC-CP触媒は、ジエンの部分水素化反応に対しても高活性・選択性が発現することが明らかとなった。Carvoneを基質とするオレフィンの水素化反応では分子内に二つのオレフィンを有するため、その選択的水素化は挑戦的であった。本反応は、高活性なDMPSi-Pt/AC-CP触媒を用いることで穏和な反応条件が実現され、フロー条件による適切な水素ガスの等量制御によって高選択性が達成された(Scheme 4)。
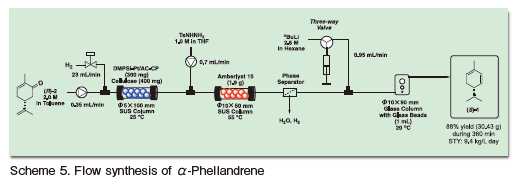
得られた溶液を固体酸触媒によるヒドラジンとの縮合反応と続くフロー条件下でのShapiro反応を組み合わせることで、3段階での光学活性α-フェランドレンの連続合成を達成した。本合成は高い生産性を有し、6時間で30g 以上の最終生成物を収率88%で合成することができた(Scheme 5)26)。
終わりに
以上、筆者らは連続フロー条件下、種々の官能基選択的水素化反応に有効なポリシラン修飾金属ナノ粒子触媒の開発を行った。DMPSi-Pd/SiO2は穏和な反応条件下、ニトリルの第一級アンモニウム塩への選択的水素化反応に高活性・高選択性を示すことを明らかにした。また、DMPSi-Pt/AC-CPは官能基選択的なニトロ基の第一級アミンへの水素化反応、オレフィンの選択的水素化反応に有効な触媒であることを明らかにした。これら触媒を用いる水素化反応を活用することで、Venlafaxine、Baclofen、α-Phellandreneの3種のファインケミカルズのフロー合成が達成された。
本稿でも述べたように、不均一系触媒を用いるフロー水素化反応は有機合成の強力なツールになる。ここではフロー反応に用いる不均一系触媒のチョイスが鍵となるが、筆者らはまず、 ポリジメチルシラン・アルミナ担持パラジウム触媒を推奨する。本文でも述べたが、バッチ系で汎用されているPd/Cは初期活性が高くても失活が早く、圧力損出を生じやすい場合も多い。それに対して、ポリジメチルシラン・アルミナ担持パラジウム触媒は様々なフロー水素化に適した触媒と言える。さらに、個々の水素化反応では、本稿に記したDMPSi-Pd/SiO2、DMPSi-Pt/AC-CPが有効であり、また核水添ではRh-Pt (DMPSi-Al2O3)が有効である。
また、ごく最近、DMPSi-Pd/AC-CPがフロー還元的アミノ化反応、ポリメチルフェニルシラン・シリカ担持パラジウム触媒がN -ベンジル基の選択的な脱保護(フロー条件下)に有効であることも見出している27)。医薬品に代表されるファインケミカルズの連続合成は今後その重要性を増していくと同時に、開発競争も激化すると予想される。より高難易度のフロー合成の実現のためには、高性能不均一系触媒の開発が必要不可欠である。新規不均一系触媒の開発に基づくフロー合成の発展に期待したい。
参考文献
- K obayashi, S. : Chem. Asian J ., 11, 425(2016).
- Webb, D. and Jamison, T. F. : Chem. Sci ., 1, 675(2010).
- Akwi, F. M. and Watts, P. : Chem. Commun .,54, 13894(2018).
- Wegner, J., Ceylan, S. and Kirschning, A. :Chem. Commun ., 47, 4583(2011).
- Wegner, J., Ceylan, S. and Kirschning, A. :Adv. Synth. Catal ., 354, 17(2012).
- Baxendale, I. R. : J. Chem. Technol. Biotechnol .,88, 519(2013).
- Pastre, J. C., Browne, D. L. and Ley, S. V. :Chem. Soc. Rev ., 42, 8849(2013).
- Elvira, K. S., Solvas, X. C. I., Wootton, R. C. R.and deMello, A. J. : Nat. Chem ., 5, 905(2013).
- Gutmann, B., Cantillo, D. and Kappe, C. O. :Angew. Chem. Int. Ed .,54, 6688(2015).
- Porta, R., Benaglia, M. and Puglisi, A. : Org.Process Res. Dev ., 20, 2(2016).
- Plutschack, M. B., Pieber, B., Gilmore, K. andSeeberger, P. H. : Chem. Rev ., 117, 11796(2017).
- " Modernizing the Way Drugs Are Made :A Transition to Continuous Manufacturing ¦FDA,"
https://www.fda.gov/drugs/news-eventshuman-drugs/modernizing-way-drugs-aremade-transition-continuous-manufacturing - Tsubogo, T., Oyamada, H. and Kobayashi, S. :Nature , 520, 329(2015).
- Yasukawa, T., Masuda, R. and Kobayashi, S. :Nat. Catal ., 2, 1088(2019).
- Yoo, W.-J., Ishitani, H., Saito, Y., Laroche, B.and Kobayashi, S. : J. Org. Chem ., 85, 5132(2020).
- Irfan, M., Glasnov, T. N. and Kappe, C. O. :ChemSusChem, 4, 300(2011).
- Cossar, P. J., Hizartzidis, L., Simone, M. I.,McCluskey, A. and Gordon, C. P. : Org.Biomol. Chem., 13, 7119(2015).
- Mallia, C. J. and Baxendale, I. R. : Org.Process Res. Dev ., 20, 327(2016).
- Ueno, M., Morii, Y., Uramoto, K., Oyamada,H., Mori, Y. and Kobayashi, S. : J. FlowChem., 4, 160(2014).
- Kobayashi, S., Okumura, M., Akatsuka, Y.,Miyamura, H., Ueno, M. and Oyamada, H. :ChemCatChem, 7, 4025(2015).
- Saito, Y., Ishitani, H. and Kobayashi, S. :Asian J. Org. Chem., 5, 1124(2016).
- Saito, Y., Ishitani, H., Ueno, M. andKobayashi, S. : ChemistryOpen , 6, 211(2017).
- Miyamura, H., Suzuki, A., Yasukawa, T. andKobayashi, S. : J. Am. Chem. Soc ., 140, 11325(2018).
- Miyamura, H., Tobita, F., Suzuki, A. andKobayashi, S. : Angew. Chem. Int. Ed ., 58,9220(2019).
- Yasukawa, T., Zhu, Z., Yamashita, Y. andKobayashi, S. : Synlett , 32, 502(2021).
- Miller, S. J., Ishitani, H., Furiya, Y. andKobayashi, S. : Org. Process Res. Dev ., 25,192(2021).
- Saito, Y., Nishizawa, K., Laroche, B. Ishitani, H.and Kobayashi, S. : Angew. Chem. Int. Ed .,61, e202115643(2022).
- Miyamura, H. and Kobayashi, S. : Angew.Chem. Int. Ed(2022).
DOI : 10.1002/anie.202201203. - 宮村浩之、小林修:和光純薬時報,88 (4),2(2020).
- de Bellefon, C. and Fouilloux, P. : Catal. Rev .,36, 459(1994).
- Nieto-Márquez, A., Toledano, D., Sánchez, P.,Romero, A. and Valverde, J. L. : J. Catal .,269, 242(2010).
- Chen, F., Topf, C., Radnik, J., Kreyenschulte, C.,Lund, H., Schneider, M., Surkus, A.-E., He, L.,Junge, K. and Beller, M. : J. Am. Chem. Soc .,138, 8781(2016).
- Laroche, B., Saito, Y., Ishitani, H., andKobayashi, S., : Org. Process Res. Dev ., 23,961(2019).
- Ishitani, H., Furiya, Y. and Kobayashi, S. :Chem. Asian J ., 15, 1688(2020).




