リコンビナントペプチドピースを用いた細胞凝集様技術"CellSaic(セルザイク)"のMSC細胞移植応用
本記事は、Current Stem Cell Research & Therapy, 2019, 14, 52-56に掲載された原文を、出版社許諾のもと、原著者自らが日本語訳したものです。
原著者:富士フイルム株式会社バイオサイエンス&テクノロジー開発センター 中村健太郎
幹細胞治療の領域では、その多様な機能ゆえに間葉系幹細胞(MSC)に関する研究が盛んにおこなわれている。一方、細胞移植の形態は単純な細胞懸濁液の投与から、細胞シート工学、3次元化へと研究が進展してきている。その中で我々は、細胞凝集体形態にゼノフリー・リコンビナントスキャホールドを組み合わせたCellSaic(セルザイク)と呼ばれる細胞治療プラットフォームを報告してきた。CellSaicとは、細胞とペタロイドピースをモザイク状に配置することで、細胞凝集体が有する欠点であるセントラルネクローシスを回避出来る細胞移植形態である。セントラルネクローシスを回避できるという点が、他の3次元培養システムに比べての利点となる。本レビューではその基本性能、安全性試験結果、及びCellSaicのアプリケーション研究結果をまとめている。主にMSC移植での活用では、MSC CellSaicは、IBD、脳梗塞、骨・軟骨領域、膵島移植への応用などで、MSC細胞単独の投与よりも有効性が高くなる、と報告されている。"One Health"の理念の下、本技術がコンパニオンアニマルセラピー及びヒト治療に活用されることを期待している。
1. イントロダクション
1993年、LangerとVacantiにより組織工学という概念が提唱されて以来、蛋白質スキャホールドを細胞移植や再生医療に用いることが長く研究されてきた。1) 古くは動物ゼラチンや動物由来コラーゲンといった天然物由来スキャホールドが研究に用いられ、スキャホールドの存在が細胞の機能を高めることが報告されてきた。2)- 5)
しかしながら、2000年代初頭に発生したBSE(Bovine Spongiform Encephalopathy)問題をきっかけに、医薬品や医療機器の原材料に、動物由来成分を含まないゼノフリーという概念が重要視されるようになり、スキャホールド素材もゼノフリーであることが求められるようになった。6)- 8)
一方、細胞治療研究は細胞懸濁液の投与研究を中心に発展してきた。中でもMSC(mesenchymal stem cell)は多様な機能を有することから、臨床応用が盛んに行われてきた。9)- 10) その適応対象はIBD(炎症性腸疾患)11)、整形領域12)- 13)、GVHD(移植片対宿主病)14)- 16)、自己免疫疾患9)、脳梗塞17)- 18)、心筋梗塞19), 20)など、多岐にわたっている。近年の"One Health"の概念と相まって、その治療対象もヒト治療のみならずコンパニオンアニマルセラピーにまで拡大している。22), 23)
細胞移植の形態としては、単純な細胞懸濁液の投与から、細胞シート工学、3次元化へと研究が進展していった。24)- 26) 特に近年では、3次元形態のスフェロイドという細胞凝集体が多く報告されており、26)- 28) 我々は、細胞凝集体様の形態にゼノフリー・リコンビナントスキャホールドを組み合わせたCellSaic(セルザイク)と呼ばれる細胞移植プラットフォームを報告してきた。29), 30) スキャホールドとして、リコンビナントペプチド(RCP)のペタロイド(花弁)形状 μ-pieceを用い、細胞としては主にMCSを用いて、得られるモザイク状の細胞凝集体をCellSaic(cell- and scaffold-forming mosaic)と呼称している。29)- 31)
本レビューでは、CellSaicの特長とMSC移植における将来のアプリケーションについて紹介する。
2. CELLSAICの基本的な特徴
2.1. スキャホールドの形状:RCP petaloid μ-piece
我々は細胞が凝集体となる際に発揮される機能に着目し、同時に凝集体となるが故に生じるセントラルネクローシスという課題に対して、最小限のスキャホールドを組みこむことで解決することを考えた。(Fig.1)29), 30)
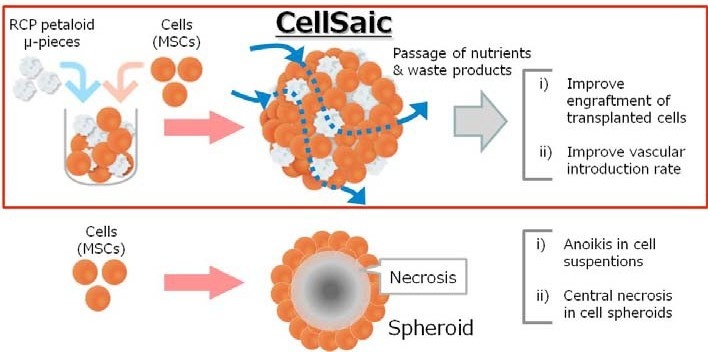
まず、最小限のスキャフォールド形状として球形・単純形状が試された。しかし、このスキャフォールド形状は、細胞にとっての接着表面を提供する効果はあるものの、栄養不足により細胞凝集体中でのセントラルネクローシスを防ぐことはできなかった。そこで細胞が接着するのに必要十分なサイズかつ形状を有しながら、凝集体となった際にも、栄養や老廃物の通過が可能となるような隙間を作り出せるスキャホールド形状を設計し直した。結果として、以前の報告の通り、サイズは50-100µm程度、かつペタロイド状に造形されたRCP petaloid μ-pieceというスキャホールド構造が最適であることを見出した。29), 32)
このpetaloid形状にすることで細胞の接着表面積が増えるとともに、形状の複雑性に起因して細胞凝集体(CellSaic)中に隙間が供与されることにより、in vitro試験およびin vivo試験のいずれにおいても移植細胞の生存率が向上することが分かっている。スキャホールドの形状は、複雑性を表現するパラメーター(タップ密度、及び製剤断面の√(表面積)÷(周囲長)Tapped density and The boundary length to square root of the area ratio)として数値で規定することも可能である。29), 32)
2.2. 移植細胞の生着向上、血管導入率の向上、及びサイトカイン放出の変化
CellSaicの基本的な特徴として、i).移植細胞の生着向上、ii). 血管導入率の向上、iii). サイトカイン放出の変化、が報告されている。29), 32)- 34)
i). 移植細胞の生着向上が起きるメカニズムについては、スキャホールドが存在することによる細胞のアノイキス阻害、及び細胞凝集体中でのセントラルネクローシスの回避が主要因として挙げられる。特に後者は、スキャホールドの形状及び有無により、顕著な差が生じることが報告されている。29)
ii). 血管導入率の向上が起きるメカニズムについては、graft中に隙間が存在する構造体であること、及び細胞とμ-pieceは再配置が可能である為に、宿主由来の血管系細胞が遊走してきやすいこと、の二点が要因であると考えられる。実際、NOD SCIDマウスの実験ではMSCスフェロイドに比べてMSC CellSaicでは顕著に多くの血管が導入された。29)
iii). サイトカイン放出の変化、については、未だ十分な検証はなされていないが、細胞のみの場合と異なり、サイトカイン放出量に違いが生じるケースが認められている。その一例がMSCによるTSG-6の放出量増大である。この報告ではMSCがCellSaic形態となることで、抗炎症サイトカインの一つであるTSG-6が多く放出されるように変化することが確認された。33), 34)
2.3. MSC CellSaicの安全性試験
CellSaicの安全性を確認する目的で、イヌ脂肪由来幹細胞(c ADSC)を用いたcADSC CellSaicについて、NOGマウスを用いた造腫瘍性試験および一般毒性試験の結果が報告されている。33)
"One Health"の理念に則ってコンパニオンアニマルセラピーでの臨床研究がヒト治療製品開発に繋がることを想定しイヌADSC CellSaicの安全性が評価されている。結果、造腫瘍性は認められず、一般毒性試験の結果についても顕著な毒性は認められないことが分かっている。33)
具体的には、一般毒性および造腫瘍性試験としてcADSC CellSaic 群(マウス一匹あたり、107 cellsのcADSCと1.04mgのμ-piece)と対照群(生理食塩水)、対照群(培地)を比較試験した。実施に当たってはWHOガイドラインを参考にし、1群当たりオス・メス各12匹のNOGマウスを用いた。35) 造腫瘍性試験の11日目で皮下結節は認められず、病理組織学的評価においても、4週、8週いずれのエンドポイントでも細胞の分裂画像は認められなかった。一般毒性試験においては、血液生化学試験、血液学的試験、臓器重量、摂餌量、体重において、群間で有意な差は認められなかった。臓器の病理組織学的評価においても、cADSC CellSaic 群において、4週、8週ともに異常は認められなかった。33)
3. CELLSAICのアプリケーション
3.1. MSC CellSaicによる細胞治療研究
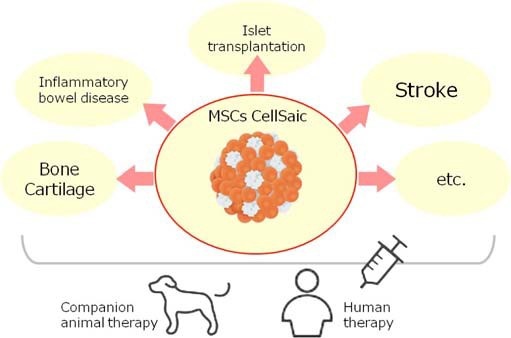
MSC CellSaicによる疾患治療研究として、IBD(inflammatory bowel disease)、脳梗塞、関節の骨軟骨再生、膵島移植への応用が報告されている。これらのApplication研究では、MSC単独での利用と比較して、MSC CellSaicを用いることで各種症状改善の効果が向上する、と報告されている。
DSSモデルマウスによる炎症性腸疾患への適用検討では、MSC単独で十分な症状改善効果が得られないモデルにおいて、MSC CellSaicを投与することで症状改善が認められている。33) 具体的には、腸炎DSSモデルマウスにおいて、MSC単独との比較試験として、MSC CellSaicにより顕著な体重回復と結腸の長さ改善が示された。
病理組織学的評価として潰瘍・浮腫・炎症細胞浸潤を評価した結果、histrogical scoreが改善し、潰瘍・浮腫が抑制されていた。33)
その理由として、MSCの体内残存性が向上すること、及び抗炎症サイトカインの放出が向上することに言及されている。脳梗塞モデルマウスでも、MSC単独での局所投与に比べて、MSC CellSaicの局所投与が運動機能改善に寄与することが報告されている。36), 37)
また、Naritomiらは、MSC単独に比べてMSC CellSaicとして軟骨へ分化させることで顕著に軟骨分化が向上すること、及び軟骨基質産生量が増えることを報告している。38) ウサギの骨軟骨欠損モデルを用いた試験結果においても、細胞単独と比べて、MSC CellSaicとすることで骨軟骨再生が昂進している。39)
膵島移植へのMSC共移植の報告においても、CellSaicを活用することで、膵島の生着向上および糖尿病モデルマウスの血糖値制御効果が高まることが確認されている。29)
以上は、いずれもMSCが有効であると報告されている疾患において、MSC単独とMSC CellSaicを比較検証した報告である。
これらの報告から、CellSaicにはMSCの治療効果を増強する可能性がある、ということが示唆される。
3.2. 膵癌モデルでの使用
創薬研究でのCellSaicの利用法として、動物の評価モデルを作製する際にMSC CellSaicを用いる方法が報告されている。この報告では、膵臓癌の担癌モデル動物を作製する際に、MSC CellSaicを癌細胞移植に併用することが開示されており、結果として膵癌細胞周辺に豊富な間質組織を形成されている。40) 一方で癌細胞のみを移植した場合では、このような豊富な間質組織は認められていない。豊富な間質組織を有する膵臓癌モデル動物は、ヒトの膵臓癌病理所見に似た形態を示すことから、薬剤抵抗性の膵癌モデルとして有用な可能性があると報告されている。
3.3. CellSaicを部品として用いた3次元構築
CellSaicを部品として用いることで、種々の造形物を作ることが可能である。WO/2017/057547においてはCellSaic技術を活用することで、1mm以上の厚みを有したシート状の細胞構造体を作製する手法が報告されている。41)
特にMSCにおいて、細胞のみではシート化することが難しい場合であっても、CellSaicを利用することで厚みを有したシート状の細胞構造体を得ることが出来る可能性がある。
さらに複雑な構造物を造形する手法としては、CellSaicを描画の1ドットのように3次元的に配置していく方法や、鋳型にCellSaicを詰めて造形する方法が報告されている。42), 43) これらの手法は細胞とScaffoldから成るCellSaic(数百µmサイズ)を1ドットとして3Dプリンティングしていく手法概念の利用と考えられる。CellSaicには細胞が含まれるが故に、隣り合うCellSaic同士は時間を置くことで融合し、大きな構造体を形成していく。その為、接着剤を必要としない。CellSaicを用いてチューブ構造を作る例も開示されており、人工血管などのApplicationに活用する可能性について言及されている。
結論
CellSaicはリコンビナントスキャホールドを使った、新たな細胞移植プラットフォームとして開発された。
主な機能はi).移植細胞の生着向上、ii).血管導入率の向上、iii).サイトカイン放出の変化、であり、特に移植細胞の生着向上に大きく寄与する。
その機能を元にMSC細胞治療研究にCellSaicを用いることで、IBD、脳梗塞、骨・軟骨再生、膵島移植などに有用であることが報告されてきた。その適用対象についても、当然ながらヒト治療および動物治療の両方が考えられる。(Fig2) "One Health"の概念に則り、コンパニオンアニマル、特に犬におけるMSC CellSaicの利用が一番初めの臨床応用として想定し、canine MSC CellSaicの安全性試験も実施された。
その結果、患犬における臨床研究が開始されている。今後、このテクノロジーがコンパニオンアニマル治療、およびヒト治療に貢献していくことが期待される。
CONSENT FOR PUBLICATION
Not applicable.
CONFLICT OF INTEREST
The authors declare no conflict of interest, financial or otherwise.
ACKNOWLEDGEMENTS
The author would like to thank members of the technical staff of Bioscience & Technology Development Center, FUJIFILM Corporation, whose opinions and knowledge were very helpful throughout the completion of this work.
REFERENCES
- Langer R and Vacanti JP. Tissue engineering. Science 1993; 260(5110): 920-6.
- Nerem RM, Sambanis A. Tissue engineering: from biology to biological substitutes. Tissue Eng. 1995; 1(1): 3-13.
- Peter SJ, Miller MJ, Yasko AW, Yaszemski MJ, Mikos AG. Polymer concepts in tissue engineering. J Biomed Mater Res 1998; 43(4): 422-7.
- Shoichet MS, Hubbell JA. Polymers for tissue engineering. J Biomater Sci 1998; 9(5): 405-6.
- Chen G, Ushida T, Tateishi T. Scaffold design for tissue engineering. Macromol Biosci 2002; 2(2): 67-77.
- Halme DG, Kessler DA. FDA regulation of stem-cell-based therapies. N Engl J Med 2006; 355(16): 1730-5.
- Cimino M, Goncalves RM, Barrias CC, Martins MCL. Xeno-free strategies for safe human mesenchymal stem/stromal cell expansion: supplements and coatings. Stem Cells Int 2017; 6597815: 1- 13.
- Richards M, Fong CY, Tan S, Chan WK, Bongso A. An efficient and safe xeno-free cryopreservation method for the storage of human embryonic stem cells. Nature 1953; 171(4356): 737-8.
- Trounson A, Thakar RG, Lomax G, Gibbons D. Clinical trials for stem cell therapies. BMC Med 2011; 9(52): 1-7.
- Galipeau J, SensebeL. Mesenchymal stromal cells: Clinical challenges and taherapeutic opportunities. Cell Stem Cell 2018; 22(6): 824-33.
- Ko IK, Kim BG, Awadallah A, et al. Targeting improves MSC treatment of inflammatory bowel disease. Mol Ther 2010; 18(7): 1365-72.
- Caplan AI. Review: Mesenchymal stem cells: Cell based reconstructive therapy in orthopedics. Tissue Eng 2005; 11(7-8): 1198- 211.
- Nitkin CR, Bonfield TL. Concise review: Mesenchymal stem cell therapy for pediatric disease: Perspectives on success and potential improvements. Stem Cells Transl Med 2017; 6(2): 539-65.
- Jurado M, Gil AC, Mata C, et al. A multicenter randomized clinical trial evaluating the safety and feasibility of the treatment of GvHD with allogenic mesenchymal stem cells (MSC) from adipose tissue. Cytotherapy 2017; 19(5): S11.
- Ringdén O, Uzunel M, Rasmusson I, et al. Mesenchymal Stem Cells for Treatment of Therapy-Resistant Graft-versus-Host Disease. Transplantation 2006; 81(10): 1390-97.
- Bahr L, Sundberg B, Lönnies L, et al. Long-term complications, immunologic effects, and role of passage for outcome in mesen- chymal stromal cell therapy. Biol Blood Marrow Transplant 2012; 18(4): 557-64.
- Bhasin A, Srivastava MV, Mohanty S, et al. Stem cell therapy: A clinical trial of stroke. Clin Neurol Neurosurg 2013; 115(7): 1003- 8.
- Wechsler LR, Bates D, Stroemer P, Andrews-Zwilling YS, Aizman
I. Cell therapy for chronic stroke. Stroke 2018; 49(5): 1066-74. - Amado LC, Saliaris AP, Schuleri KH, et al. Cardiac repair with intramyocardial injection of allogeneic mesenchymal stem cells after myocardial infarction. Proc Natl Acad Sci USA 2005; 102(32): 11474-9.
- Martin-Rendon E, Gyongyosi M. Mesenchymal stromal cell therapy as treatment for ischemic heart failure: the MSC-HF study. Cardiovasc Diagn Ther 2017; 7(Suppl. 2): S69-S72.
- Volk SW, Theoret C. Translating stem cell therapies: the role of companion animals in regenerative medicine. Wound Repair Regen 2013; 21(3): 382-94.
- Kahn LH, Kaplan B, Monath TP, Steele JH. Teaching "one medicine, one health". Am J Med 2008; 121(3): 169-70.
- One Health Initiative. [Internet] 2012; cited Dec 12. Available from www.onehealthinitiative.com
- Yamato M, Okano T. Cell sheet engineering. Materialstoday 2004; 7(5): 42-7.
- Baksh N, Gallant ND, Toomey RG. Cell sheet engineering for integrating functional tissue in vivo: Successes and challenges. MRS Bulletin 2017; 42(5): 350-5.
- Baraniak PR, McDevitt TC. Scaffold-free culture of mesenchymal stem cell spheroids in suspension preserves multilineage potential. Cell Tissue Res 2012; 347(3): 701-11.
- Ylostalo JH, Bazhanov Mohammadipoor N, Bartosh TJ. Production and administration of therapeutic mesenchymal stem/stromal cell (msc) spheroids primed in 3-D cultures under Xeno-free conditions. J Vis Exp 2017; 18(121): doi: 10.3791/55126.
- Yanagihara K, Uchida S, Ohba S, Kataoka K, Itaka K. Treatment of Bone Defects by Transplantation of Genetically Modified Mesenchymal Stem Cell Spheroids. Mol Ther Methods Clin Dev 2018; 9(15): 358-66.
- Nakamura K, Iwazawa R, Yoshioka Y. Introduction to a new cell transplantation platform via recombinant peptide petaloid pieces and its application to islet transplantation with mesenchymal stem cells. Transpl Int 2016; 29(9): 1039-50.
- Nakamura K. Cell construct comprising polymer blocks having biocompatibility and cells. US Patent 2010; US9,597,432.
- Nakamura K, Tabata Y. A new fluorescent imaging of renal inflammation with RCP. J Control Release 2010; 148(3): 351-58.
- Nakamura K, Iwazawa R, Miyoshi H, et al. Cell structure for cell transplantation, biocompatible polymer block, and methods for producing same. International patent publication No. 2013; WO/2014/133081.
- Iwazawa R, Kozakai S, Kitahashi T, Nakamura K, Hata K. The therapeutic effects of adipose-derived stem cells and recombinant peptide pieces on mouse model of DSS colitis. Cell Transplant 2018; [Epub ahead of print].
- Kozakai S, Nakamura K. Trophic factor release agent and inflammatory disease treatment agent. International patent publication No. 2016; WO2017/221879.
- Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks. WHO technical report series, No 978 Annex 3. 2013.
- Nakamura K. Cell structure for use in treatment of brain injury, method for producing same, and therapeutic agent for brain injury.
International patent publication No. 2014; WO2015/194494 - Miyamoto M, Nakamura K, Shichinohe H, et al. Human Recombinant Peptide Sponge Enables Novel, Less Invasive Cell Therapy for Ischemic Stroke. Stem Cells Int 2018; 4829534: 1-8.
- Naritomi M, Mizuno M, Katano H, et al. Petaloid recombinant peptide enhances in vitro cartilage formation by synovial mesenchymal stem cells. J Orthop Res 2018; In press.
- Nakamura K, Miyoshi H, Hada S, Watanabe M. Cartilage- regenerating material. International patent publication No. 2015; WO2016/148245.
- Nakamura K, Mima S, Kitahashi T, Kakimuma C. Cell structure, non-human mode animal, method for producing non-human model animal, and method for evaluating test substance. International patent publication No. 2015; WO/2017/022613.
- Nakamura K. Method for manufacturing sheet-shaped cell structure, and sheet-shaped cell structure. International patent publication No. 2015; WO/2017/057547.
- Nakamura K. Tublar structure, device for producing tubular structure, and method for producing tubular structure. International patent publication No. 2014; WO/2016/068292.
- Nakamura K, Kuchiishi K, Kizawa H, Aburaya A. Tubular structure, method for producing cell structure, and method for producing tubular structure. Japan patent publication NO. 2015; P2016- 174538A.
DISCLAIMER: The above article has been published in Epub (ahead of print) on the basis of the materials provided by the author. The Editorial Department reserves the right to make minor modifications for further improvement of the manuscript.
ご注意:本レビューの原文は英語であり、日本語訳は、著者及び出版元の許諾の下、参考のために作成しております。




