【特別講座】ヒドロキシ基含有ホスフィン配位子を用いる位置選択的クロスカップリング
本記事は、OrganicSquare Vol.51 (2015年3月号)において、静岡県立大学薬学部 眞鍋 敬先生、山口 深雪先生に執筆いただいたものです。
はじめに
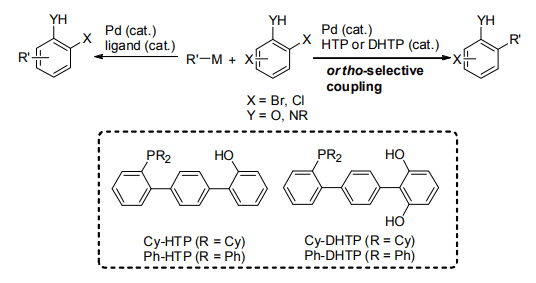
クロスカップリングは有機合成化学において重要な反応の一つであり、これまでに医薬品や機能性材料を始めとする様々な化合物の合成に広く利用されている。その有用性は十分に確立しており、とりわけ分子内に複数個のハロゲンをもつ化合物を原料とし、目的とする位置のみで反応を進行させる「位置選択的クロスカップリング」は複雑な構造を有する化合物合成の重要な手段であることから多くの研究がなされてきた1-3)。
位置選択性を発現させる手法として広く用いられているのは、基質に異なるハロゲンを導入する方法である。より反応性の高いハロゲン(I > Br > Cl)において、選択的クロスカップリングが可能であるが、予めそれぞれのハロゲンを位置選択的に導入した原料を用意する必要があり、その合成が困難な場合がある。
一方、同一のハロゲンを複数個有する化合物を用いる位置選択的反応は、目的の位置以外でのカップリングが進行する可能性があり容易ではないが、実現すればより直接的かつ効率的である。これまでに多く報告されているのは、基質の電子的性質や立体障害により位置選択性を制御する方法であるが、最近、触媒による位置選択性の制御が報告されてきている4)。
当研究室では、ヒドロキシ基含有ターフェニルホスフィン配位子(HTP)を開発し、本配位子とパラジウムから成る触媒を用いるオルト位選択的熊田―玉尾―Corriu カップリング5-7)および薗頭カップリング8)を報告した。さらにヒドロキシ基を 2 個有するジヒドロキシターフェニルホスフィン(DHTP)がそれらの反応において、より高い反応性およびオルト位選択性を示すことを明らかとした(Scheme 1)9, 10)。
Scheme 1. Hydroxylated terphenylphosphines.
これらの反応における高い位置選択性の発現は、HTP あるいは DHTP がそのヒドロキシ基により基質であるハロフェノールやハロアニリンを捕捉することによるものと推定している。
例えば、パラジウム (Pd)―Cy-DHTP 触媒を用いるジハロフェノールと Grignard 試薬との熊田―玉尾―Corriu カップリングにおいては、Cy-DHTP とジハロフェノールがマグネシウムアルコキシドを介する複合体を形成することにより、パラジウムに近接するオルト位で位置選択的に酸化的付加が起こる(Scheme 2)。
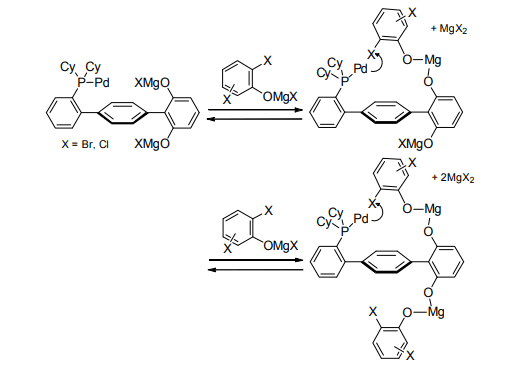
Scheme 2. Complex formation between the Pd-DHTP catalyst and substrate.
DHTP はヒドロキシ基を 2 つもつことにより、ターフェニルの炭素―炭素単結合が回転しても常に基質をパラジウム近傍に保持できるため、ヒドロキシ基を 1 つもつ HTP よりも高い反応性および選択性を示すものと考えられる。
本稿では、Cy-DHTP を用いるオルト位選択的クロスカップリングおよび同反応を活用する多置換複素環化合物のワンポット合成について紹介する。
熊田―玉尾―Corriu カップリング
まず初めに、パラジウム触媒を用いるジブロモアレーンと Grignard 試薬の熊田―玉尾―Corriuカップリングにおける DHTP の効果を検討した。同反応においては、一般により立体障害が小さく電子不足な位置で反応が優先的に進行する。
しかしながら、DHTP を配位子として用いると、一般的な配位子を用いた場合と位置選択性が逆転することを見出した9)。例えば、1,6-ジブロモ-2-ナフトールを基質として用いる反応において、配位子として DPPF を用いると立体障害が小さく電子不足な C6 位選択的にカップリングが進行する(Scheme 3a)。
一方、Cy-DHTP を用いた場合、反応性が低い C1 位において選択的に反応が進行する。同様に、4-ブロモ-2-クロロフェノールと Grignard 試薬のカップリングでは、Cy-DHTP を用いると一般的に反応性が低いとされるオルト位のクロロ基で選択的に反応した(Scheme 3b)11)。
また、2,4-ジブロモアニリンの場合においても、Cy-DHTP を配位子とした場合、中程度の収率ながらオルト位選択的にカップリングが進行した(Scheme 3c)11)。
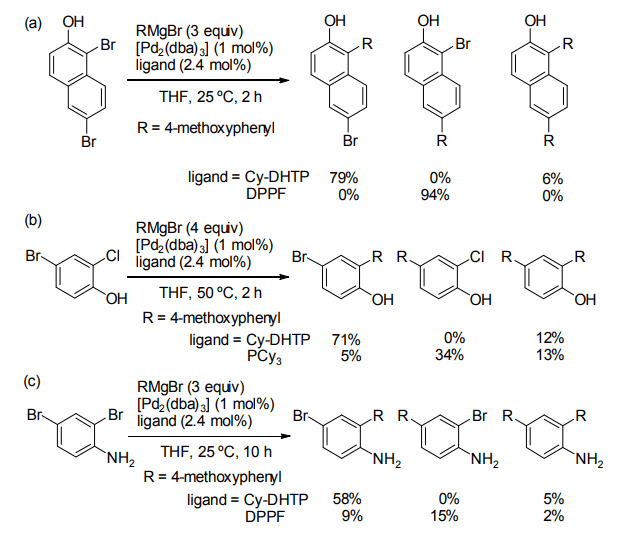
Scheme 3. Effect of the ligand in Kumada--Tamao--Corriu coupling.
薗頭カップリング―環化によるベンゾフラン合成
熊田―玉尾―Corriu カップリングで得られた知見を基に、他のクロスカップリングへの Cy-DHTP の適用を検討した。
ベンゾフラン合成法として、2-ハロフェノールと末端アルキンの薗頭カップリングと続く環化による方法は広く用いられてきた12)。しかし、利用可能な基質は 2-ヨードフェノールや 2-ブロモフェノールにほぼ限られており、安価であるが反応性の低い 2-クロロフェノールを用いる合成はほとんど報告されていない。
我々はこれまでに Pd―Cy-HTP 触媒が、リチウム t-ブトキシド存在下、2-クロロフェノールと末端アルキンのオルト位選択的薗頭カップリングを進行させることを見出した8)。しかしながら封管中で反応を行う必要があり、基質適用範囲も限られていた。
そこで、Pd―Cy-DHTP 触媒を用いればより温和な反応条件で広い基質一般性をもつ反応が実現できるのではないかと考え検討を行った13)。その結果、トルエン溶媒中で加熱還流すると 1 時間以内で薗頭カップリングが完結した。カップリング後にメタノールあるいは水を加えて加熱還流することで 2-アルキニルフェノールの環化が促進され、対応するベンゾフランが得られた (Scheme 4)。
![Scheme 4. Benzo[b]furan synthesis using Pd‒Cy-DHTP catalyst.](images/si10992_img04.png)
Scheme 4. Benzo[b]furan synthesis using Pd‒Cy-DHTP catalyst.
薗頭カップリングにおいては、リチウムフェノキシドを介して Pd―Cy-DHTP 触媒と 2-クロロフェノールが Scheme 2 に示した複合体と類似の複合体を形成することで高いオルト位選択性が発現していると考えられる。本手法により様々な置換基をもつベンゾフランを合成可能である (Table 1)。
さらに、ジクロロフェノールを基質に用いた場合においても、よりかさ高いオルト位で選択的に薗頭カップリングが進行し、対応するクロロベンゾフランを中程度から良好な収率で得た。
Table 1. Benzo[b]furan synthesis using various 2-chlorophenols and various alkynes.
![Table 1. Benzo[b]furan synthesis using various 2-chlorophenols and various alkynes.](images/si10992_img05.png)
ジクロロフェノールからのワンポットでの二置換ベンゾフラン合成
<次に、Pd-Cy-DHTP 触媒を用いるジクロロフェノール類と末端アルキンからのクロロベンゾフラン合成に続いて、さらに残存するクロロ基をワンポットにて変換することを試みた(Scheme 5)。その変換反応として、薗頭カップリングと同様に塩基性条件で反応が進行する鈴木―宮浦カップリング反応を選択し、二置換ベンゾフラン体のワンポット合成を検討した。
![Scheme 5. One-pot synthesis of disubstituted benzo[b]furans.](images/si10992_img06.png)
Scheme 5. One-pot synthesis of disubstituted benzo[b]furans.
Pd-Cy-DHTP 触媒存在下ジクロロフェノールのオルト位選択的に薗頭カップリング反応を進行させた。引き続き水を加えクロロベンゾフラン体とし、同反応系内に新たにボロン酸と塩基を加えた。しかし、この場合、鈴木―宮浦カップリングが十分に進行せずクロロベンゾフランの残存が確認された。
そこで鈴木―宮浦カップリングを促進する配位子として XPhos を用いたところ同反応が円滑に進行し、ワンポットでの二置換ベンゾフラン合成が実現した。すなわちパラジウム触媒存在下、二種類の配位子 Cy-DHTP と XPhos を共存させてクロロフェノールのオルト位選択的に薗頭カップリング反応を行い、水を加えてクロロベンゾフラン体を得た。
続いてボロン酸と塩基を加えて鈴木-宮浦カップリング反応を行い、二置換ベンゾフラン体を得た。本反応は種々のボロン酸を用いた場合にも適用可能であり、様々な置換基を有する二置換ベンゾフラン類を合成することができた(Table 2)。また、用いるジクロロフェノールを変えることで様々な置換パターンを有するベンゾフランを得た。
Table 2. One-pot synthesis of disubstituted benzo[b]furans.
![Table 2. One-pot synthesis of disubstituted benzo[b]furans.](images/si10992_img07.png)
本反応における二種類の配位子の役割を明らかとするため様々な実験を行った結果、Pd-Cy-DHTP がオルト位選択的薗頭カップリング反応において有効な触媒種として機能し、興味深いことに Pd-XPhos は同反応に関与しないことが示唆された。一方、鈴木-宮浦カップリング反応においては Pd-XPhos が反応を大幅に促進することを見出した。
薗頭カップリング―環化によるインドール合成
インドールについてもベンゾフランと同様に、2-ハロアニリンと末端アルキンからの薗頭カップリング―環化のプロセスにより合成可能である12)。そこで、Pd-Cy-DHTP 触媒を用いてジクロロアニリン誘導体と末端アルキンの位置選択的薗頭カップリング、続く環化によるクロロインドールのワンポット合成を検討した14)。
その結果、N-トシルジクロロアニリンを基質として用いると、ジクロロフェノールの場合と同様にオルト位選択的に薗頭カップリングが進行した。水を加えてさらに加熱還流することで対応する N-トシルクロロインドールを良好な収率で得た(Scheme 4)。本合成法は種々のクロロインドール合成へと適用可能であり、4位、5位、6位にそれぞれクロロ基を有するクロロインドールを対応するN-トシルジクロロアニリンから中程度から高い収率で得た。
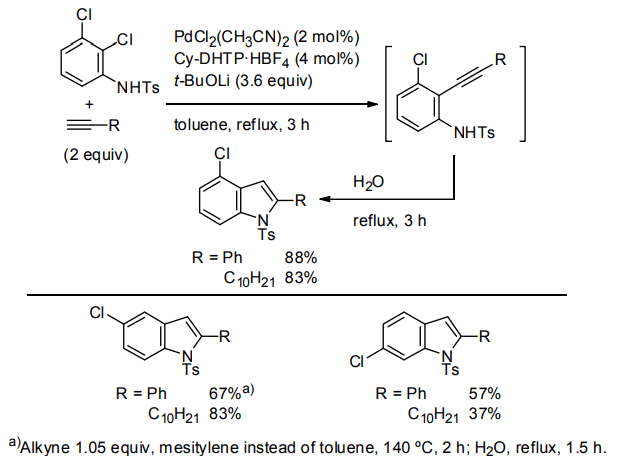
Scheme 4. Chloroindole synthesis using Pd‒Cy-DHTP catalyst.
ジクロロアニリン誘導体を用いるワンポットでの二置換インドール合成
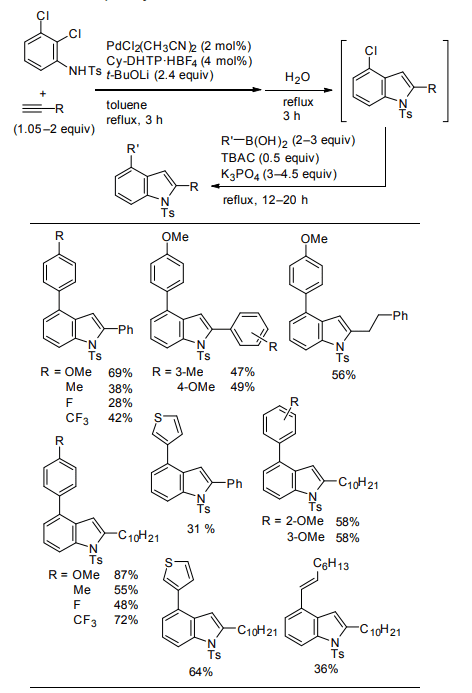
さらに、本合成法を用いてジクロロアニリン誘導体からのクロロインドール合成と続く鈴木―宮浦カップリングによる二置換インドール類のワンポット合成について検討した。
まず、ベンゾフラン合成で有効であった2種類の配位子の組み合わせを用いて反応を行ったが低収率にとどまった。反応条件を精査した結果、配位子に Cy-DHTP のみを用い、さらに触媒量のテトラブチルアンモニウムクロリド(TBAC)を添加することにより、鈴木―宮浦カップリングが良好に進行することが明らかとなった。
すなわち、アミノ基をトシル基で保護したジクロロアニリン誘導体のオルト位選択的に薗頭カップリングを行い、続いて水を添加して環化を進行させクロロインドールとし、さらにボロン酸、塩基と共に触媒量の TBAC を加えることで鈴木―宮浦カップリング反応が良好に進行し、ワンポットで二置換インドールを得ることに成功した。
本手法を用いることで、一般に合成が困難とされている 4-置換インドール類について、N-トシル-2,3-ジクロロアニリンと末端アルキンから効率良く合成することができた(Table 3)。種々のボロン酸を用いることで、様々な置換基を有するアリール基、アルケニル基、チオフェニル基などを導入可能である。
Table 3. One-pot synthesis of 2,4-disubstituted indoles.
参考文献
- Schröter, S., Stock, C., Bach, T.: Tetrahedron, 61, 2245 (2005). DOI: 10.1016/j.tet.2004.11.074
- Fairlamb, I. J. S.: Chem. Soc. Rev., 36, 1036 (2007). DOI: 10.1039/B611177G
- Wang, J.-R., Manabe, K.: Synthesis, 1405 (2009). DOI: 10.1055/s-0029-1216632
- Manabe, K., Yamaguchi, M.: Catalysts, 4, 307 (2014). DOI: 10.1246/cl.2007.1302
- Ishikawa, S., Manabe, K.: Chem. Lett., 36, 1302 (2007). DOI: 10.1246/cl.2007.1304
- Ishikawa, S., Manabe, K.: Chem. Lett., 36, 1304 (2007). DOI: 10.1246/cl.2007.1304
- Ishikawa, S., Manabe, K.: Tetrahedron, 66, 297 (2010). DOI: 10.1016/j.tet.2009.10.101
- Wang, J.-R., Manabe, K.: J. Org. Chem., 75, 5340 (2010). DOI: 10.1021/jo1007948
- Ishikawa, S., Manabe, K.: Angew. Chem., Int. Ed., 49, 772 (2010). DOI: 10.1002/anie.200905544
- Ishikawa, S., Manabe, K.: Tetrahedron, 67, 10156 (2011). DOI: 10.1016/j.tet.2011.09.013
- Ishikawa, S., Manabe, K.: unpublished results.
- Heravi, M. M., Sadjadi, S.: Tetrahedron, 65, 7761 (2009). DOI: 10.1016/j.tet.2009.06.028
- Yamaguchi, M., Katsumata, H., Manabe, K.: J. Org. Chem., 78, 9270 (2013). DOI: 10.1021/jo401503t
- Yamaguchi, M., Manabe, K.: Org. Lett., 16, 2386 (2014). DOI: 10.1021/ol500711z




