【連載】Talking of LAL「第8話 薬剤の影響(1)」
本記事は、和光純薬時報 Vol.60 No.3(1992年7月号)において、和光純薬工業 土谷 正和が執筆したものです。
第8話 薬剤の影響(1)
薬剤の測定は、薬剤が測定に影響しない条件で行うことが好ましいと考えられます。今回は、薬剤の試験条件の検討方法について、筆者らが実際に行った試験結果も交えて考えてみたいと思います。
試料の測定への影響を除去するための最も一般的な方法は、「希釈」です。希釈を限りなく行えば試料の影響はなくなっていきますが、試料の希釈に限界があることは、前回紹介した通りです。測定を行う上からも、できるだけ小さい希釈倍率の方が手間も少なく、試料中のエンドトキシンの希釈も少ないため、有利と考えられます。
そこで、試料の測定条件を決めるために、まず測定への影響がなくなる試料濃度を求めます。「試料濃度の影響がなくなる」という判断の基準については、米国薬局方1)及び FDA ガイドライン2)が参考になると思われます。すなわち、ゲル化転倒法では、試料で希釈したエンドトキシン溶液によるゲル化のエンドポイントが、リムルス試薬の表示感度の 1/2 ~ 2 倍以内であるとき、また比濁時間分析法及び合成基質法では、検量線作成に用いた最低濃度の 4 倍量のエンドトキシンによる試料への添加回収が 100±25% であるとき、それぞれ試料の影響がないと判断します。
最近 FDA より発行された暫定ガイダンス3)では、比濁時間分析法を用いた測定における阻害または促進試験の許容範囲が、エンドトキシン回収率として 100±50% と変更されました。日本では、局方等で試料の影響に関する判断基準が定められていないため、個々の目的に従って結果を分析する必要があります。筆者らは、測定条件の検討段階では 100±25% のエンドトキシン回収率を目安にしております。
さて、実際の操作について考えてみましょう。まず、各種濃度の資料にエンドトキシンを添加します。添加方法としては、各種濃度の試料溶液を調製した後、それぞれにエンドトキシン溶液を添加する方法と、エンドトキシンを添加した試料溶液を希望する濃度のエンドトキシン溶液で希釈する方法とがあります。添加方法は、試料の性質と測定に必要な濃度によって選択する必要があります。
今回は、比濁時間分析法を用いたクエン酸ナトリウム注射液の測定例を紹介します。
各種濃度(2% ~ 0.06%)のクエン酸ナトリウム溶液(4ml)に 12.5 EU/ml のエンドトキシン溶液 20µl を添加し、リムルス試薬としてリムルス HS-J テストワコーを、測定装置としてトキシノメーター ET-201 を用いて測定しました。同時に、エンドトキシンを添加しない試料溶液も測定しました。
エンドトキシンの検量線は、0.0156 ~ 0.125 EU/ml の 2 倍希釈系列、4 濃度の結果より作成しました。添加したエンドトキシンの終濃度は 0.0625 EU/ml となりますから、検量線の最低エンドトキシン濃度(λ)の 4 倍となります。
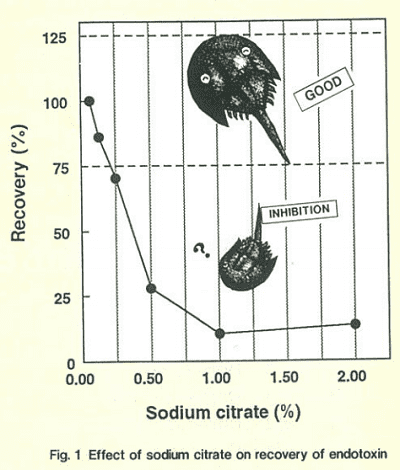
測定により得られたゲル化時間(Tg)よりそれぞれのエンドトキシン濃度を計算し、0.0625 EU/mg を 100% として回収率を求めました。エンドトキシンを添加しない試料はすべてゲル化判定されませんでした。クエン酸ナトリウムの濃度とエンドトキシン回収率の関係を Fig.1 に示します。クエン酸ナトリウムは、2% で測定を阻害していますが、希釈により阻害がなくなっていくことが判ります。今回使用した試料では、0.125% でエンドトキシン回収率が 75% 以上になり、測定が可能となりました。
このようにして得た結果をもとに、希望するエンドトキシン限界値や MVD を考慮して、測定条件を決めることになるわけです。薬剤の測定への影響は、製品によって異なる挙動を示す場合があります。製造方法や共存物質の相違が原因かも知れません。また、測定法(比濁時間分析法、ゲル化転倒法、合成基質法)にもそれぞれの特徴があり、影響の受け方も異なることがあるので注意が必要です。
参考文献
- The United States Pharmacopeia 22th, The National Formulary 17th, p.1493-1495, Pharmacopeial Convention Inc., MD (1989).
- Guideline on validation of the Limulus amebocyte lysate test as an end-product endotoxin test for human and animal parenteral drugs, biological products, and medical devices, Food and Drug Adm. (1987).
- Interim guidance for human and veterinary drug products and biologicals, Food and Drug Adm. (1991)
関連記事