【総説】LH 遺伝子変異解析法による肺がん等での遺伝子変異検索の概要
本記事は、和光純薬時報 Vol.83 No.4(2015年10月号)において、神奈川県立がんセンター 臨床研究所 がん分子病態研究学部 松隈 章一様、宮城 洋平様、和光純薬工業 臨床検査薬研究所 石川 友一に執筆いただいたものです。

はじめに
がん遺伝子変異ががん化・悪性化に重大な関与をしているが、その中でも、特定の遺伝子変異を標的とする治療薬が肺がんやその他のがんで有効であることが判っている。肺がん(非小細胞性)では EGFR 遺伝子の変異を確定し、EGFR 遺伝子を標的とするがん治療薬イレッサの治療有効性を予見することが臨床上重要となった1)。
また、遺伝子標的治療薬として BCR-ABL 遺伝子転座異常がある慢性骨髄性白血病に著効を示すグリベックが、KIT 遺伝子のインフレーム欠損変異を持つ消化管間質腫瘍にも著効を示すなど、遺伝子を標的とするがん治療の将来性が期待されてきた。
悪性黒色肉腫(メラノーマ)では BRAF 遺伝子の変異 V600E が高頻度で見つかり、新たな遺伝子標的薬剤の開発が進められている2, 3)。さらに、IDH1、IDH2 のようなミトコンドリアでの代謝に関与する遺伝子の変異がグリオブラストーマや急性骨髄性白血病に見つかり、代謝阻害による新たな治療の可能性も追求されている。
遺伝子変異検出法
遺伝子変異検出法の標準は PCR-サンガー法であり、最近では次世代シーケンサーも期待されている。上記肺がんの遺伝子標的治療薬の対象となる EGFR の変異はエクソン 19 の L747-E749 を含む 9-18 塩基のインフレーム欠損変異であり、またエクソン 21 のコドン 858 での一塩基置換によるミスセンス変異 L858R が主要なものとなる。
これらの変異により遺伝子産物 EGF 受容体タンパクの立体構造が微妙に変化しイレッサに対する結合性が増すため本来の増殖因子シグナル伝達機能が阻害されるのが遺伝子標的薬のメカニズムである。こうしたホットスポットでの遺伝子変異を検索する簡易法が多数提案され、LH 遺伝子変異検出法もその一つとして 2006 年に発表した4, 5)。
ループハイブリッド(LH)のポリアクリルアミドゲル電気泳動での挙動
遺伝子変異部位を含む DNA を PCR で増幅した場合、染色体の一方に変異があり野生型と変異型を同時に含むがん細胞の DNA をテンプレートにすると、PCR 産物は、当初、野生型および変異型の DNA(ホモ duplex)からなるが、PCR のサイクル数が進んで増幅 DNA の濃度が増加すると、野生型と変異型のハイブリッド体であるヘテロ duplex も生成されるようになる。
肺がん細胞でよく検出される EGFR 遺伝子エクソン 19 でのインフレーム欠損変異では、PCR 増幅されるホモ duplex は野生型と欠損変異型で長さが異なる。これらがヘテロのハイブリッド体を形成すると、欠損変異部分に対応して野生型 DNA の一部がヘテロ duplex からループ上にはみ出す形をとる(図 1A)。
このループを一意的に形成させるために、野生型センス鎖の配列を持つ合成一本鎖 DNA を作製し、また欠損変異 DNA のプラスミド・クローンをテンプレート DNA として PCR 増幅し、これら両者のハイブリッド体を形成させた。このハイブリッド体はループを有し、ポリアクリルアミドゲル電気泳動で解析すると、欠損変異の大きさのみならず、その位置や付加的な塩基置換に応じて特有の移動遅延性を示すバンドが一本出現した(図 1B, C)。
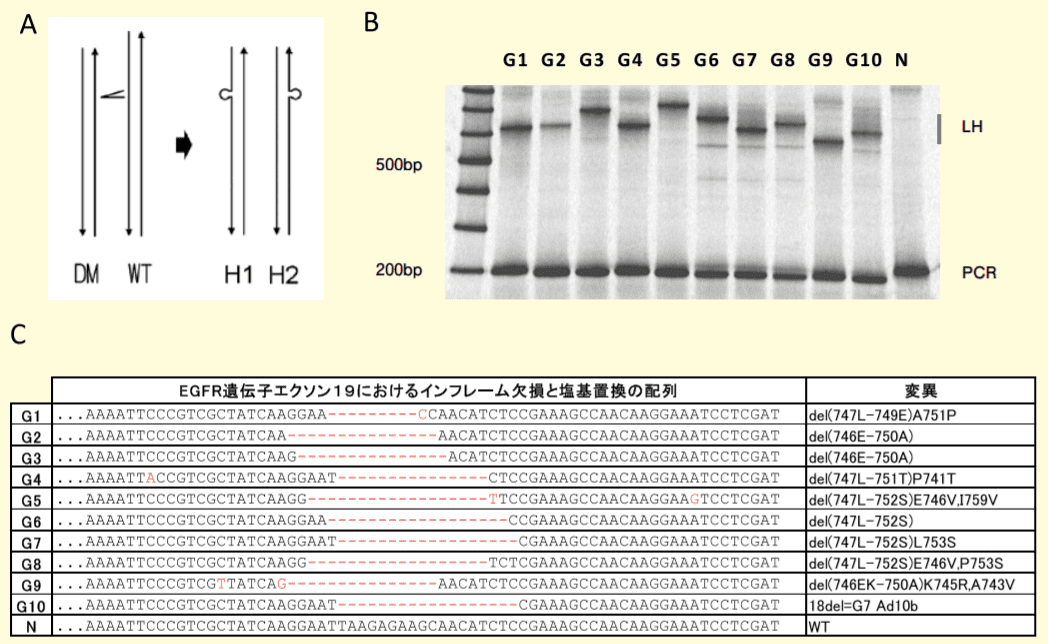
図1.EGFR遺伝子エクソン19で発生するインフレーム欠損変異とその野生型のPCR産物間で形成されるループハイブリッドの電気泳動による検出
A. 欠損変異型(DM)と野生型(WT)DNAのPCR産物が形成するハイブリッド体(H1, H2)のループを含む形状。B. 欠損変異のプラスミド・クローン10種が野生型合成一本鎖DNAと形成するヘテロ duplex のポリアクリルアミドゲル電気泳動後の遅延移動性バンド(LH)。C. 10種の欠損変異と野生型の配列。赤字:欠損-と塩基置換。これらのループを側鎖に持ち、ポリアクリルアミドゲル電気泳動で移動遅延性を示すバンドに対応するハイブリッド体をループ・ハイブリッド、または略して LH、と呼ぶことにした。さらに、ポリアクリルアミドゲル電気泳動中の LH の顕著な遅延移動性とそのループ内構造に依存した移動度の変化を基本原理として、DNA 内の一塩基置換変異を検出する方法を開発した。
LH による一塩基置換変異の検出
日本人の肺がんでよく起こる EGFR 遺伝子エクソン 21 の一塩基置換(L858R、CTG>CGG)は同遺伝子エクソン 19 のインフレーム欠損変異とともにイレッサ治療の対象となる。この L858R 変異を含む領域を PCR で増幅し、変異が多発する塩基の下流に一定塩基数の欠損を設けたプローブ(LH プローブ)を合成オリゴ DNA によりアンチセンス側で作製し、PCR 産物に添加してハイブリダイズさせる。
LH プローブとしてのハイブリッド体において、欠損部と相補的に対応する部分はループとなって突出する。LH プローブは 3' 側をアンプリコンより 73 塩基短く設計されているが、ハイブリッド体のこの部分はポリメラーゼ伸長反応で埋められるため、ループ以外で LH は二重鎖となる(図 2A)。PCR 産物中の野生型 DNA と変異型 DNA の量比は、野生型 LH と変異型 LH の生成比に反映される。
変異型 LH と野生型 LH の違いはループの根元での変異塩基によるミスマッチである。このミスマッチによるループ構造の変化が LH の泳動度の差として最も良く反映されたのは、18 塩基を欠損させた LH プローブであった。ポリアクリルアミド電気泳動後の野生型と変異型の LH バンドの濃さの相対比は PCR 中の野生型と変異型 DNA の量比を反映し、変異 DNA が 1-3% 以上あれば L858R 変異は変異型 LH バンドとして高精度で検出できる(図 2B)。
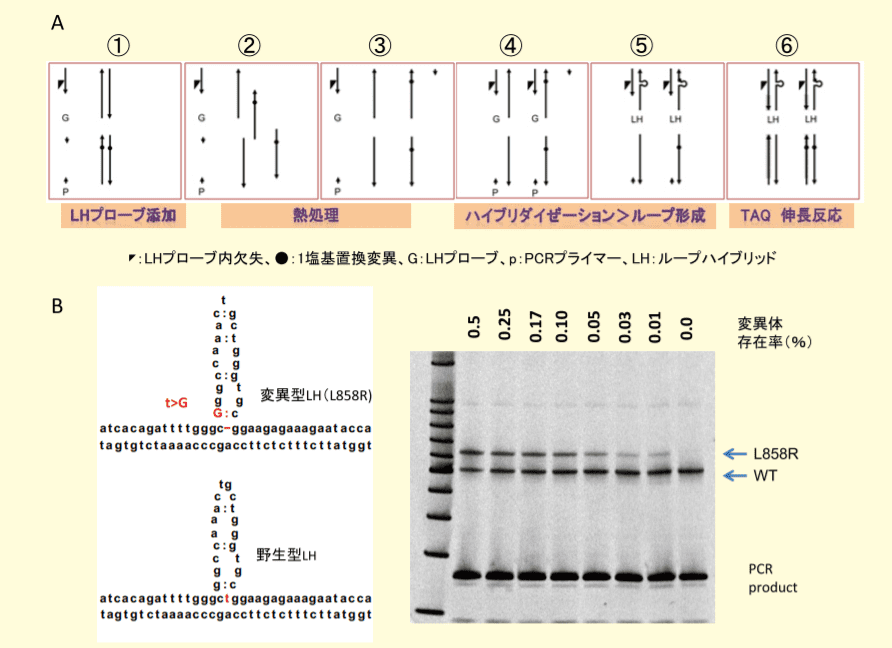
図2.EGFR遺伝子エクソン21での一塩基置換変異L858RのLHによる検出法
A. LHによる一塩基置換変異の検出プロトコール。B. 変異型および野生型LHのループ形状の模式図(左パネル)、変異型と野生型DNAの構成比率を変動させたときの変異型と野生型のLHバンドの濃度変化(右パネル)。挿入変異の LH による検出
先に述べた欠損変異(EGFR 遺伝子エクソン 19)の場合と同様の原理で、挿入変異(EGFR エクソン 20)でも PCR の増幅と野生型配列の合成 DNA プローブで変異型 LH ができ、ポリアクリルアミドゲル電気泳動でホモ duplex とは異なる遅延性バンドとして検出できる。
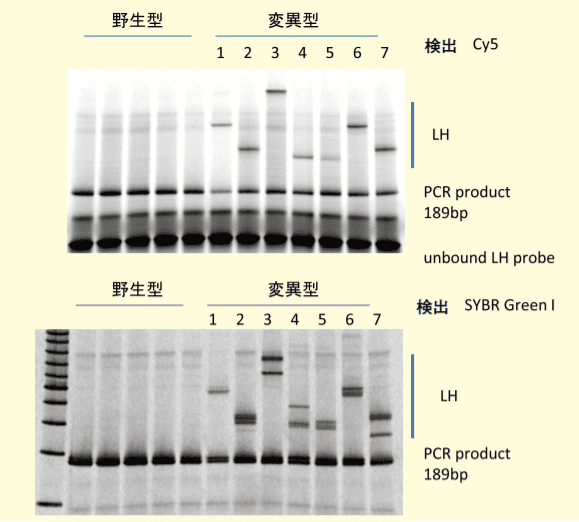
図3.EGFR遺伝子エクソン20における挿入変異の蛍光LHプローブによる検出
Cy5標識したLHプローブを用いCy5蛍光シグナルを検出(上パネル)とSYBR Green Ⅰ染色による検出(下パネル)。(挿入塩基数、1:9bp、2:3bp、3:6bp、4:12bp、5:3bp、6:9bp、7:3bp)合成 DNA プローブは Fw プライマーから始まり挿入変異の頻発領域のさらに 20 塩基以上、下流側に延長させた一本鎖 DNA であり、肺がん由来 DNA をテンプレートにした PCR 産物に添加してハイブリダイズさせる。この LH プローブと挿入変異型 DNA で LH が 1 種類でき、この変異型 LH はポリアクリルアミド電気泳動で遅延性バンドとして検出できる。
Cy5 等の蛍光色素で LH プローブを 5' 末端標識しておけば、この標識をゲル中に検出するスキャナー装置(STORM、TYPHOON 他)で 1 本の LH バンドとして検出できる。挿入変異のない野生型サンプルとは LH バンドは生じない。また、ハイブリダイズしない LH プローブはゲルの下方で検出される(図 3 上パネル)。
蛍光標識をしていない LH プローブを用いた場合では、泳動後のポリアクリルアミドゲルを二重鎖 DNA 特異蛍光色素(SYBR Green I, EtBr, GelRed)で染色し対応する波長域で検出する。この場合、LH プローブに由来しない挿入変異型と野生型の間でのハイブリッド体が遅延性バンドとして二本検出されるが、これらは挿入変異の存在を意味するバンドであり変異検出の妨げとはならない。ハイブリダイズしない一本鎖 LH プローブはゲル下方に薄いバンドとして検出される(図 3 下パネル)。
蛍光標識 LH プローブの有用性
蛍光標識 LH プローブを用いると LH バンドが一意的に検出されるので、反復配列を含む DNA での変異の検出に有用である。UGT1A1 遺伝子産物は肝臓で発現され抗がん剤イリノテカンの有効物質 SN-38 の解毒化に作用するが、UGT1A1 遺伝子の多型によって個人の薬剤感受性が大きく変わる。
エクソン 1 の上流に (TA)7TAA と (TA)6TAA の 2 型のうち、前者をホモ接合型に持つ個人はイリノテカンに高感受性となる。この遺伝多型を含む領域を PCR 増幅して Cy5 標識 LH プローブでハイブリダイズする。LH プローブはターゲット DNA 中の反復配列近傍で 8 塩基がループとなるように設計した6)。
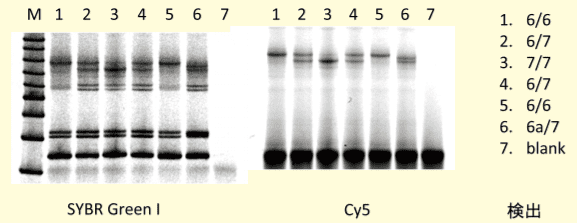
図4.蛍光標識したLHプローブの有用性
UGT1A1遺伝子多型解析における、SYBR Green ⅠによるDNA検出(左パネル)とCy5末端標識したLHプローブのCy5蛍光検出(右パネル)。6/6は(TA)6のホモ、6/7は(TA)6と(TA)7のヘテロ、7/7は(TA)7のホモ、6aは(TA)6の11塩基上流で一塩基多型のあるもの。通常の手法にて反復配列を有する多型を泳動解析する場合では、複数のバンドがノイズとして検出されるなどの問題が生じる。この様な応用例では、Cy5 標識 LH プローブを用い、形成された LH の Cy5 蛍光を電気泳動後のゲル中に検出することにより、二つの遺伝型と一意的に対応する LH バンドで明確に遺伝子型判定ができる(図4)。
LH による遺伝子変異検出の拡張性
EGFR 遺伝子は、エクソン 20 での一塩基置換変異 T790M がイレッサ抵抗性を獲得する変異となる。また、エクソン 18 で一塩基置換(G719S, C, A)が低頻度で見つかるがイレッサに対する反応性は中立的といわれる。これらの EGFR 変異は LH 遺伝子変異検出で対応できる7)。
KRAS 遺伝子コドン 12、13 の一塩基置換変異については、変異の遺伝型が 12 種あるが、これらすべてを同一の LH プローブを用いて検出することができる。LH プローブとしては、欠損タイプではなく、10 塩基(TTCTGCAGAA)を変異ホットスポットに隣接して挿入した挿入タイプを用いる。
別の欠損タイプ LH プローブと併用し変異 LH バンドの移動パターンから変異型 12 種を区別できる8)。大腸がんでの KRAS の変異は NRAS 変異をふくめて抗 EGFR 抗体治療薬セツキシマブの有効性への事前検定に必須とされる9)。
BRAF 遺伝子の一塩基置換変異 V600E は変異ホットスポットに隣接した 9 塩基の欠損タイプ LH プローブにより検出できる4)。メラノーマ等で一定頻度でこの変異が起こり、ダブラフェニブがこの変異を有するメラノーマ細胞の増殖抑制効果を持つとされる。
以上は LH による遺伝子変異検出の概略であるが、手法の詳細については LH 遺伝子変異検出キット(和光純薬工業(株)から発売)に添付の使用説明書に具体的に述べられている。または、原論文4)を参照していただければ幸いである。
LH 遺伝子変異検出の他の遺伝子変異解析への応用は継続しており、いくつかは発表を予定している。遺伝子標的薬としてのがん治療薬の開発が進展し、対象となる遺伝子の変異検出に LH 遺伝子変異検出法が寄与できることを願う次第である。
謝辞
本研究を支持していただいた神奈川県立がんセンター臨床研究所及び病院の皆様、並びに、研究用試薬キットを検討いただいた和光純薬工業(株)ライフサイエンス研究所林田幸信研究員に感謝いたします。
ポイント
遺伝子変異について
ヒトの遺伝子はゲノム中で数個から数十個のエクソンに分散し、それらがメッセンジャー RNA に再構成された後そのコード領域で 3 塩基(codon)ごとにアミノ酸に翻訳され遺伝子産物としてタンパク質酵素ができる。一塩基置換で codon が別のアミノ酸に変わるのがミスセンス変異であり、L858R では 858 番目のロイシンがアルギニンに変わる。
欠損ないし挿入が codon の倍数で起き、対応アミノ酸配列の欠損ないし挿入が生じるものをインフレーム変異という。それ以外はフレームシフトとなり機能タンパクが出来ない変異となる。
キーワード:遺伝子変異 遺伝子標的薬 EGFR 電気泳動
参考文献
- Pao, W. et al. : Nat. Rev. Cancer, 10, 760 (2010). DOI: 10.1038/nrc2947
- Flaherty, K. T. et al. : Nat. Rev. Cancer, 12, 349 (2012). DOI: 10.1038/nrc3218
- Holderfield, M. et al. : Nat. Rev. Cancer, 14, 455 (2014). DOI: 10.1038/nrc3760
- Matsukuma, S. et al. : J. Mol. Diagn., 8, 504 (2006). DOI: 10.2353/jmoldx.2006.060030
- Oshita, F. et al. : Br. J. Cancer, 95, 1070 (2006). doi: 10.1038/sj.bjc.6603396
- Matsukuma, S. et al. : Clin. Chim. Acta, 412, 1668 (2011). DOI: 10.1016/j.cca.2011.05.021
- Sakuma, Y. et al. : Lab. Invest., 93, 1137 (2013). DOI: 10.1038/labinvest.2013.102
- Matsukuma, S. et al. : Clin. Chim. Acta, 412, 1874 (2011). DOI: 10.1016/j.cca.2011.06.030
- Misale, S. et al. : Cancer Discov., 4, 1269 (2014). DOI: 10.1158/2159-8290.CD-14-0462




