【総説】界面集積型脱水縮合剤とその反応
本記事は、和光純薬時報 Vol.81 No.1(2013年1月号)において、金沢大学医薬保健研究域薬学系 国嶋 崇隆 先生に執筆いただいたものです。

ミセルの特性のうち、反応場という観点から重要なものとして、次の3点を上げることができる。すなわち、①水中に溶解/分散している脂溶性分子の取り込み作用により、ミセル内でそれらの濃度が高まる局所濃縮効果、②両親媒性化合物の場合、極性官能基を界面に向けて取り込まれる前配向性効果、③会合解離を繰り返す平衡系であるため、取り込まれる分子の出入りが速いこと1, 2)。
このような性質を利用して、例えば酵素様の反応触媒としての利用が古くから試みられており、また、ミセル界面で加水分解など幾つかの反応が大きく促進されることも報告されている1-6)。しかし、現在知られている多様な有機化学反応のなかで、ミセルの有用性が十分に活かされている例は残念ながら多くはない。筆者らは、加水分解の逆反応である脱水縮合反応に対してもミセル界面が反応場として優れた特性を有することを明らかにしたので、本稿でその概要を述べたい。
筆者らは以前に、π電子不足な 1,3,5-トリアジンの特性を利用して、水中で使用できる脱水縮合剤 DMT-MM を開発し、これを用いるとカルボン酸とアミンの脱水縮合反応が、水やアルコール溶媒中でも高収率に進行することを明らかにしてきた7-9)。縮合剤や活性中間体は加水分解を受け易いことから、水中での脱水縮合反応は言わば非常識であったが、元来極性であるカルボン酸やアミンが可溶な水を溶媒に用いることはむしろ合理的とも言える。
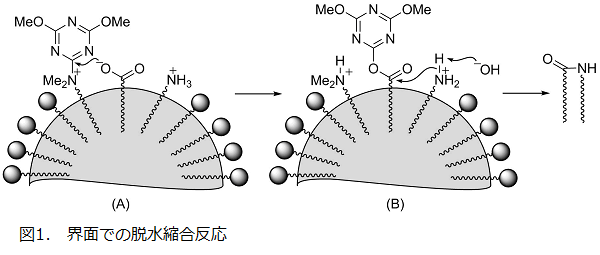
一方、水中よりも劇的に速く加水分解が進行するミセル界面を利用する試みは、それ以上に困難な課題であった10-13)。しかし、水中で電離するカルボキシ基やアミノ基、さらに 4 級アンモニウム構造を有する脱水縮合剤等に脂溶性部位を導入すると、上記②の前配向性効果によって全ての反応点が都合良くミセル界面に並ぶことになる。その結果、図1のようにカルボキシラートイオンのトリアジンへの求核攻撃(A)と、生じた活性エステルへの引き続くアミンの攻撃(B)が、いずれもミセル界面で加速されると期待される。
脂肪酸塩の形成するミセル中での反応加速
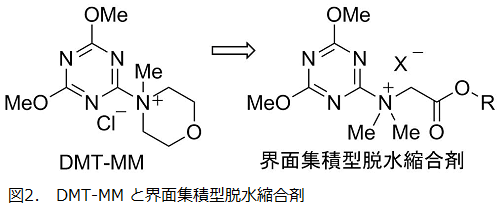
前節の考察に基づいて、まず界面で働く脱水縮合剤を設計・開発した14)。4 級アンモニウム構造を有する水溶性の DMT-MM に脂溶性を付与して両親媒性にすれば、反応点である極性のトリアジニルアンモニウム部分をミセル界面に向けてうまく配向すると期待し、ジメチルグリシンに着目した。すなわち、そのジメチルアミノ基にはトリアジンが結合して縮合剤を形成し、カルボキシ基にはエステル結合を介して各種高級アルコール(ROH)を導入できる。このアルコールの炭素鎖長によって縮合剤の脂溶性を自在にコントロールすることが可能である(図2)。
ミセル形成による反応加速を調べるには、反応条件設定が重要となる。後述の如く無数に存在する界面活性剤の中から、目的の実験に最適なものを事前に選択することは容易ではない。そこで、反応系を単純化するために、脂肪酸塩が界面活性剤として作用することに着目し、基質である脂肪酸塩自身が形成するミセル中での反応速度を調べることにした。縮合剤に対してカルボン酸とアミンを大過剰に用いれば、反応速度は脱水縮合剤の濃度に対する擬一次反応として観測できる。
一般に界面活性剤は、その濃度が臨界ミセル濃度(CMC)より低いときは水中に均一に溶解した単分子分散状態をとり、CMC を超えるとミセルを形成する。従って、もし一種類の脂肪酸塩を用いて会合体形成による反応への影響を調べるならば、その濃度を CMC の前後で変化させる必要がある。しかし、速度に直接影響する脂肪酸塩濃度を変化させる実験系は、反応加速を見積もるには適切ではない。そこで、炭素鎖長の異なる脂肪酸塩を用いてこの問題を解決した。つまり、同じ濃度であっても、脂溶性が高く小さな CMC を持つ脂肪酸塩はミセルを形成し、脂溶性が低く大きな CMC を持つものは均一に溶解することを利用して、それぞれの反応速度を測定・比較した。
その結果、擬一次反応速度定数の相対比で示すように(表1)、水溶性の高い酪酸塩では、縮合剤のエステルに導入したアルキル基(R)の炭素鎖長の影響は小さいものであったが、ミセルを形成するラウリン酸塩では、両親媒性の縮合剤を使用したときに劇的に加速し、その大きさは最大 2000 倍にも及ぶことが分かった14)。
表1. ミセル形成による反応加速:擬一次反応速度定数の相対比
| 縮合剤:O-R | C3H7COONa(単分子分散) | C11H23COONa(ミセル) |
|---|---|---|
| O-C2H5 親水性 | 1.0 | 56 |
| O-C8H17 両親媒性 | 0.7 | 1200 |
一般的な界面活性剤の形成するミセル中での反応
上述の脂肪酸塩ミセルでの大きな反応加速は、学術的に重要な知見ではあるものの、ミセル形成のために反応物の脂肪酸塩を過剰に使用する点と、ミセル形成しないカルボン酸塩には利用できないという点で、反応としての一般性に大きな制約がある。そこで一般的な界面活性剤として、非イオン性の Triton X-100、アニオン性のドデシル硫酸ナトリウム(SDS)やデカンスルホン酸ナトリウム(DSA)、カチオン性の塩化セチルトリメチルアンモニウム(CTAC)を用いて、ミセル中の反応を検討した15)。
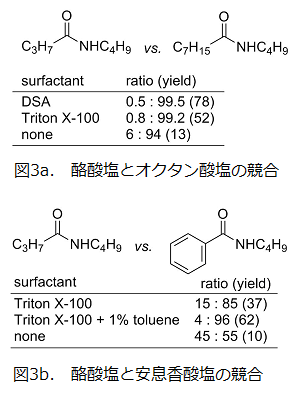
その結果、CTAC 存在下では反応は全く進行しないことが分かった。おそらくカチオン性のミセル界面には対イオンとして水酸化物イオンが濃縮されることから3,5)、縮合剤や活性エステル中間体の加水分解が促進されたためと考えられる。一方、非イオン性とアニオン性では反応加速が認められ、例えばどちらもミセルを形成しない酪酸塩とオクタン酸塩の等モル混合物における競合反応において、脂溶性の高いオクタン酸のアミドが 99% 以上の選択性で得られた(図3a)。界面活性剤非存在下と比べ、アミドの収率が大きく向上していることから、観察された選択性はミセル効果による反応加速に基づいていることがわかる。
ベンゼン環を有するカルボン酸塩は酪酸塩に対してあまり高い選択性を示さなかったが、この場合トルエンを添加してエマルションを形成させると収率が向上し、95% 以上の選択性となった(図3b)。
アミンの脂溶性に基づく選択性
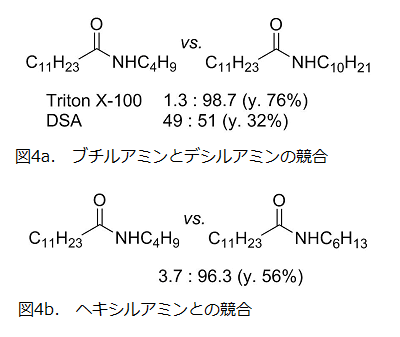
前項までは、脂肪酸塩に着目した選択性発現の検討であったため、縮合するアミンには水溶性でミセルの影響が小さいブチルアミンを用いた。そこで次にアミンの脂溶性の違いによる反応性を検討した。ブチルアミンとデシルアミンの競合条件下におけるアミド生成比を調べたところ、非イオン性の Triton X-100 ではデシルアミンが 99% 近い高選択性で反応したが、興味深いことにアニオン性の DSA では選択性はほぼ失われた(図4a)。
アニオン性界面活性剤のミセル界面では酸が解離しにくくなることが知られており16)、取り込まれたデシルアンモニウムの脱プロトン化が遅くなったことが原因と考えられる。Triton X-100 を用いた反応系では、プチルアミンよりわずか 2 炭素長いヘキシルアミンに対して、約 96:4 という高い選択性が観察された(図4b)。
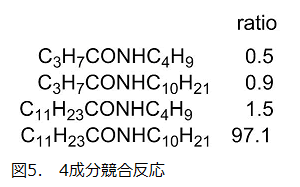
カルボン酸塩とアンモニウム塩がともに長短二種類ずつの炭素鎖を有する4成分混合系での競合反応では、4種の可能な生成物のうち、97%の選択性で長鎖アルキル基を有する化合物同士の縮合したアミドが得られた(図5)。会合体形成のないメタノール中では選択性は全く認められなかった。
膜界面での脱水縮合反応
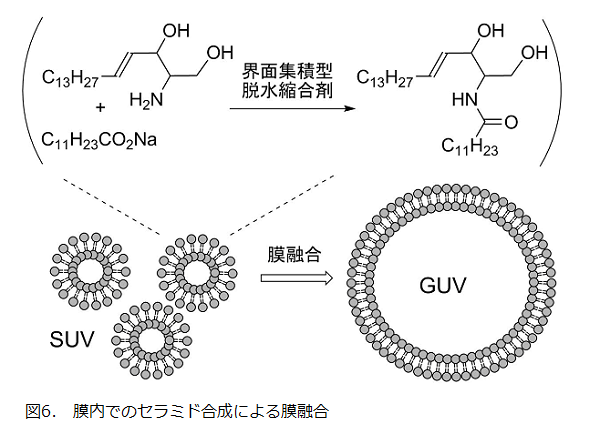
本反応の応用例として、脂肪酸塩とスフィンゴシンを構成成分に含む小さな二分子膜ベシクル(SUV)の界面でセラミドの合成を行うと、SUVの自発的な融合による巨大ベシクル(GUV)の形成が観察された(図6)17)。おそらく膜を構成する脂質の化学変化に伴って、膜の曲率が変化したことが原因と考えられる。酵素等の機能性タンパク質非存在下での膜融合現象であり、本技術は生命科学の観点から脂質分子の機能を解明するための重要なツールとなることが期待される。
おわりに
界面活性剤の極性頭部は、非イオン性、アニオン性、カチオン性、両性等に分類され、それぞれに様々な官能基が知られている。また、脂溶性尾部も、脂肪族、芳香族、直鎖状、分枝状、飽和、不飽和、一本鎖、二本鎖など多様である。更に炭素鎖長や、不飽和結合の数、位置、立体化学などの違いも含めて、これらの脂溶性尾部を極性頭部と組合せることを考えれば、その数は無数とも言える3,18)。
例えば同じ極性頭部を有する同系列の界面活性剤であっても、アルキル基の炭素数が一つ異なるだけでCMCが変わるとおり、個々の界面活性剤分子の微細な構造変化が、その会合体の形態や、相転移温度、界面電荷、安定性などの物性に大きな変化をもたらす。従って、無数の界面活性剤の何を用いるかによって、同じ温度や濃度であっても、全く異なる反応場が作り出される。翻って通常の均一溶液での化学反応において、我々が用いる溶媒は多くても数十種類程度であることを考えれば、ミセルなどの会合体は反応場として非常に大きなポテンシャルを有すると期待される。
本反応では電荷を持たない非イオン性または両性界面活性剤が適当であることが明らかとなったが、アルキル鎖の効果など、解明すべき興味深い課題がまだ沢山ある。
参考文献
- Tasciouglu, S. : Tetrahedron, 52, 11113 (1996). DOI: 10.1016/0040-4020(96)00669-2
- Fendler, J. H. : "Membrane Mimetic Chemistry", John Wiley & Sons, New York (1982).
- Fendler, J. H. and Fendler, E. J. : "Catalysis in Micellar and Macromolecular Systems", Academic Press, New York (1975).
- Dwars, T., Paetzold, E. and Oehme, G. : Angew. Chem. Int. Ed., 44 7174 (2005). DOI: 10.1002/anie.200501365
- Menger, F. M. and Portnoy, C. E. : J. Am. Chem. Soc., 89, 4698 (1967). DOI: 10.1021/ja00994a023
- Broxton, T. J., Christie, J. R. and Sango, X. : J. Org. Chem., 52, 4814 (1987). DOI: 10.1021/jo00230a036
- Kunishima, M., Kawachi, C., Morita, J., Terao, K., Iwasaki, F. and Tani, S. : Tetrahedron, 55, 13159 (1999). 10.1016/S0040-4020(99)00809-1
- Kunishima, M., Kawachi, C., Hioki, K., Terao, K. and Tani, S. : Tetrahedron, 57, 1551 (2001).DOI: 10.1016/S0040-4020(00)01137-6
- 国嶋崇隆 : 和光純薬時報, 72 (2), 8 (2004).
- Jaeger, D. A. and Ippoliti, J. T. : J. Org. Chem., 46, 4964 (1981). DOI: 10.1021/jo00337a028
- Rico, I., Halvorsen, K., Dubrule, C. and Lattes, A. : J. Org. Chem., 59, 415 (1994). DOI: 10.1021/jo00081a022
- Ranganathan, D., singh, G. P. and Ranganathan, S. : J. Am. Chem. Soc., 111, 1144 (1989). DOI: 10.1021/ja00185a063
- 国嶋崇隆 : 化学, 67, 68 (2012).
- Kunishima, M., Imada, H., Kikuchi, K., Hioki, K., Nishida, J. and Tani, S. : Angew. Chem. Int. Ed., 44, 7254 (2005).
- Kunishima, M., Kikuchi, K., Kawai, Y. and Hioki, K. : Angew. Chem. Int. Ed., 51, 2080 (2012).
- Montal, M. and Gitler, C. : Bioenergetics, 4, 363 (1973). DOI: 10.1007/BF01648978
- Kunishima, M., Tokaji, M., Matsuoka, K., Nishida, J., Kanamori, M., Hioki, K. and Tani, S. : J. Am. Chem. Soc., 128, 14452 (2006). DOI: 10.1021/ja0652969
- 「油化学便覧‐脂質・界面活性剤‐ 第4版」(丸善)(2001).




