【連載】〈幹細胞由来EV~治療、診断、化粧品への展開~〉第5回 細胞外小胞の治療・診断マーカーを開発する上での正確性の重要性
本記事は、和光純薬時報 Vol.92 No.2(2024年4月号)において、新潟大学大学院 医歯学総合研究科 消化器内科学分野 土屋 淳紀様に執筆いただいたものです。
はじめに
近年、ヒトばかりでなく、植物、果実、細菌、酵母などあらゆる細胞が放出する細胞外小胞(extracellular vesicles)が、我々の生命活動の情報伝達手段の一つとして、重要であることが明らかになり疾病の診断から治療への応用まで幅広く研究が進められている。特に、細胞外小胞の中でも粒径100 nm前後のものを特に小細胞外小胞 (small extracellular vesicles;以下sEVsと記載、日本ではエクソソームの方が頻用されている) が注目を集めている。これらは脂質二重膜で覆われ安定で内部に産生細胞固有の多数のタンパク質やmiRNAなどの核酸を含むことから新たな治療・診断ツールとして注目を集めている1)。本稿では我々が今までに取り組んで来たsEVsのバイオマーカー開発及び、治療開発において要所要所で富士フイルム和光純薬株式会社の製品に助けられてきており、その接点を紹介したい。
間葉系幹細胞のsEVsを用いた治療法開発での接点
我々は現在、肝硬変に対して、間葉系幹細胞のsEVsを用いた治療法の開発を行っている。肝硬変はB型肝炎、C型肝炎などのウイルス、アルコール、生活習慣の欧米化などが原因で炎症を伴う肝障害とそれに引き続く線維化によって形成され、患者数が本邦で40万人いる国民病で線維化改善薬はunmetmedical needsとなっている2)。我々はこれまでに間葉系幹細胞はマクロファージを通して肝硬変の線維化を改善させること(Stem Cells Transl Med, 2019)3)、間葉系幹細胞の効果機序の本体はそのsEVsに由来すること(NPJ Regen Med, 2021)4)、間葉系幹細胞のsEVsは肝内の障害部のマクロファージに高率に取り込まれ、そのマクロファージは組織修復機能を発揮すること(Inflamm Regen, 2023)5)を発表している。我々の報告ばかりで無く、間葉系幹細胞のsEVsは経静脈的に投与をすると早期に肝臓や肺に集積すること、そしてマクロファージに集積しやすいことが報告されており6)、そのため、肝臓のマクロファージをターゲットとしている我々にとっては間葉系幹細胞のsEVsは非常に魅力的な治療製剤である。我々は更に、間葉系幹細胞をinterferon-γ(IFN-γ)で刺激した後に得られるsEVsがより高い治療効果を発揮することを明らかにしてきた。
このような基礎研究を積み重ねて行くうちに、臨床への道筋を探って行くようになった。近年日本再生医療学会「エクソソームの調製・治療に対する考え方ワーキンググループ」(議長は大阪大学紀ノ岡正博教授)からエビデンスの高い治療法として開発していく重要性が示されたり (Regenerative Therapy 2022)7)、Pharmaceutical and Medical Devices Agency (PMDA)のエクソソームを含む細胞外小胞(EV)を利用した治療用製剤に関する専門部会より報告書が示されたり、International Society for Extracellular Vesicles (ISEV)や各国から示される情報などにより少しずつsEVsの治療法開発の方向性が見えてきている。
間葉系幹細胞のsEVsの治療を目指す為には、その元となる間葉系幹細胞の同等性・同一性が求められ、大量培養技術、大量抽出技術、得られたsEVsの同等性・同一性そしてin vivoでの効果と繋がるin vitroでのアッセイ系での評価も必要であろう。そして、品質、治療効果が不均一になりやすいsEVsを、如何に均一化して行くかが重要課題であると考えている。こうした研究は実に地道な一つ一つの検証・評価によって成り立つと考えている。一つの例を挙げてみたい。
例えば、sEVsの評価に関して紹介したい。どのようなタンパク質やmiRNAが含有されているかということは一つ重要なことである。このようなことを正確に評価するためには、不純物を最低限に正確にsEVsを抽出できていなければならない。我々は、従来の超遠心法などの手法ではどうしても正確性に欠け困っていたところ、富士フイルム和光純薬株式会社MagCapture™ Exosome Isolation Kit PS Ver.2に出会った。この手法を用いることにより、不純物を最小限に採取でき、プロテオミクス解析で含有するタンパク質をそしてmiRNA解析にて含有するmiRNAを正確に評価できるようになり、データに高い信用性が出るようになったと考えている。間葉系幹細胞の増殖培養用のmedium、sEVsを回収するためのmedium、そして近年ではエクソソームをはじめとする細胞外小胞の大量精製用カラムも開発されており、実際使わせていただいており、このような技術の進歩と共にsEVsの治療法開発は進んでいることを近年強く実感している。
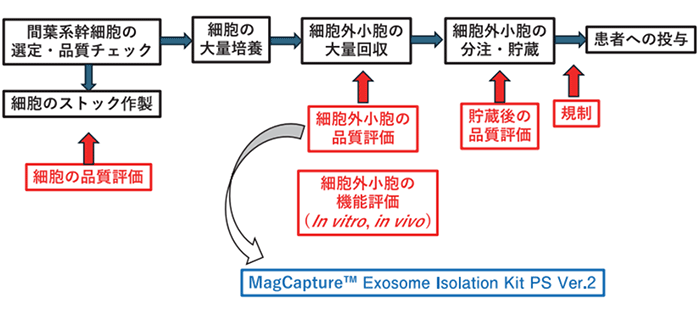
図1.間葉系幹細胞の臨床を考える上での大きな工程の流れと我々のMagCapture™ Exosome Isolation Kit PS Ver.2の使用箇所
血清中のsEVsから肝線維化マーカーの発見
我々は間葉系幹細胞のsEVsを用いた治療法開発と並んで、血清に含まれるsEVsから肝硬変の線維化に関わるバイオマーカーを見つけ出すことができたため、ここで述べたい。このバイオマーカーの発見及び発見後の多検体での検証に富士フイルム和光純薬株式会社の技術に助けられたので紹介したい。解析の一連の流れとしては、まずは肝硬変患者と健常者の血清からsEVsを抽出し、その後プロテオミクス解析を行い、患者と健常者のsEVsに発現するタンパク質の違いから候補タンパク質を選定する。選定したタンパク質がELISA法で定量的に測定できるか実際に目的タンパク質を発現しているcell lineからsEVsを抽出し、目的タンパク質の抗体を用いて測定を行う。この検証を経て定量性の信頼性の高い抗体を用いて多検体の血清でELISA法で測定し、臨床データと照合し評価して行くという流れである。この過程での、血清中からのsEVsの抽出に先程も出てきた、MagCapture™ Exosome Isolation Kit PS Ver.2が、正確にsEVsを採取しプロテオミクス解析を行うのに非常に有用であった。また、更にELISA法には、PS Capture™ Exosome ELISA Kitが大変役にたった。これらはsEVsを認識するための付属のCD63抗体を使用すると、正確に血清のsEVsの量を定量的に評価できるが、これだけでなく、このCD63抗体を目的タンパク質の抗体に置き換えることによって、目的タンパク質を発現するsEVsの量を正確に評価することができる系であり、当初目的タンパク質が見つかった後で定量的な評価に難渋していた私には、非常に有用なキットであった。このような、富士フイルム和光純薬株式会社のキットに助けられて、fibulin-4という従来にないLysyl oxidase8)に関連する新たな肝線維化マーカーを見いだすことができたことは研究者として喜びに堪えない。一度確立した系を用いれば、更なる疾患でのマーカー発見、評価に応用が利くと考えている。また、この開発の過程で、富士フイルム和光純薬株式会社の今若直子さん、請川亮さん、西部隆宏さんにご助言、技術協力をいただいた点にこの場を借りて厚く御礼申し上げたい。
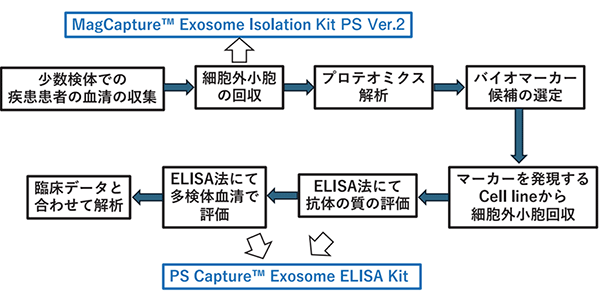
図2.我々が行った、血清からのバイオマーカー開発とMagCapture™ Exosome Isolation Kit PS Ver.2やPS Capture™ Exosome ELISA Kitの使用箇所
最後に
我々が目指している、sEVsのバイオマーカー開発及び、治療開発の一端と富士フイルム和光純薬株式会社の製品の関わりを紹介した。その中でsEVsは見えにくく、純度よく採取、解析して行く際に、今回紹介した製品無しには進歩が得られなかった。ホームページを拝見すると、エクソソーム研究の工程と製品ラインアップとして、sEVsの産生、抽出、定量、解析の場面場面での製品が紹介されていて、お世辞抜きで質、量ともにレベルが高いものがラインアップされていることがわかり、会社の熱量が伝わってくる。日本から、このような高い技術がより多く出てきて、マーカー・治療開発の進歩に結びつくことを心から願ってやまない。
参考文献
- Kalluri, R. and LeBleu, V. S. : Science, 367(6478), eaau6977 (2020).
- Tsuchiya, A. et al. : Inflamm. Regen., 39, 18 (2019).
- Watanabe, Y. et al. : Stem Cells Transl. Med., 8 (3), 271 (2019).
- Takeuchi, S. et al. : NPJ Regen. Med., 6 (1), 19 (2021).
- Takeda, N. et al. : Inflamm. Regen., 243 (1), 48 (2023).
- Kang, M. et al. : J. Extracell. Vesicles, 10 (8), e12085 (2021).
- Tsuchiya, A. et al. : Regen. Ther., 21, 19 (2022).
- Chen, W. et al. : Hepatology, 72 (2), 729 (2020).




