【テクニカルレポート】社会実装を目指す国産ゲノム編集技術CRISPR-Cas3
本記事は、和光純薬時報 Vol.92 No.2(2024年4月号)において、東京大学医科学研究所 先進動物ゲノム研究分野 吉見 一人様に執筆いただいたものです。
一般社会への応用が進むゲノム編集技術
ゲノム編集技術とは、文字通り、細胞ゲノム内の狙ったDNA配列を改変するツールのことです。2013年にCRISPR-Cas9技術が真核細胞で利用できることが報告されると、その効率と便利さから急速に研究に利用され、2020年には発見者であるEmmanuelle Charpentier氏とJennifer Doudna氏がノーベル化学賞を受賞しています。
現在CRISPR-Cas9技術をはじめとするゲノム編集技術は、基礎研究にとどまらず、産業や医療、農業など幅広い分野での社会実装が進んでいます。特に、CRISPR-Cas9を用いた鎌状赤血球症に対する遺伝子治療が2023年11月から12月にかけて英米で世界初のゲノム編集治療法として承認されたことは記憶に新しく、希少疾患をはじめとした様々な治療への応用が期待されています1)。工業分野でも新しいバイオリアクタや微生物、動物による高機能物質の効率的な生産が行われ、農林水産分野では植物や魚類をはじめとしたさまざまな生物種の品種改良が実施されています。
CRISPR-Cas9をベースとした技術改良も盛んにおこなわれており、最近ではBase EditingやPrime EditingといったDNAの二本鎖切断なしで一塩基の置換や特定配列の挿入を可能にする安全かつ正確なゲノム編集方法が注目されています2)。この他、ゲノム配列自体は編集せずに遺伝子発現を制御するエピゲノム編集やRNA編集技術も開発されており、こうした多岐にわたるゲノム編集ツールも同様に社会実装が進んでいます。
ゲノム編集技術におけるCRISPR-Casシステム
元来、微生物内におけるCRISPR-Casシステムは、ウイルスやファージなどの外敵に対する獲得性免疫として知られており、複数のタンパク質因子で狙った配列を分解するクラス1 CRISPRと、単一のタンパク質で標的配列を分解するクラス2 CRISPRに大別されます(図1)。
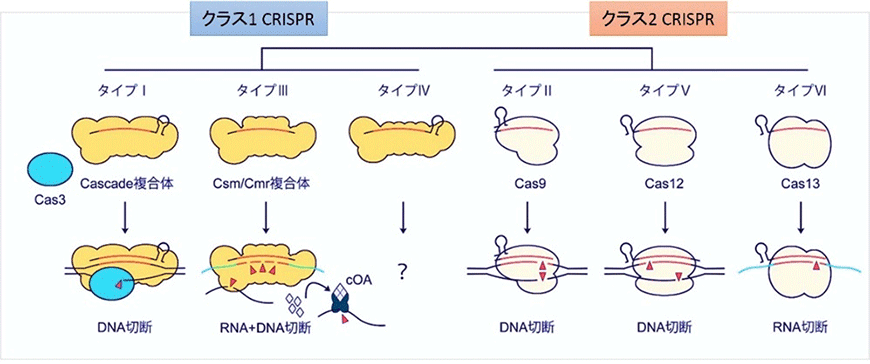
図1.CRISPR-Casシステムの分類
クラス2 CRISPRは、単一タンパク質のため取り扱いが容易であり、サイズも小さく標的細胞への送達もしやすいため、CRISPR-Cas9やCRISPR-Cas12aなど多くのゲノム編集技術がこのクラス2 CRISPRから開発されています。他にもRNA編集に使われるCRISPR-Cas13や、小型のCRISPR-Cas12fやCRISPR-Cas12jなど、新しいゲノム編集技術が現在もクラス2 CRISPRから見出されています。
一方、細菌の大部分はクラス1 CRISPRを有しており、中でもDNAを標的とするタイプI CRISPRが広く利用されていることが知られています。クラス1 CRISPRは複数の因子を制御する必要があり、DNA切断に対する厳密な制御が可能である一方で、その複雑な機構から真核細胞での利用は進んでいませんでした。こうした中、2019年に我々はcrRNA前駆体を用いてヒト細胞内でCascade複合体形成反応をさせることにより、真核細胞でのゲノム編集に成功しました。最近では、微生物叢や真核細胞におけるゲノム、エピゲノムの編集ツールとしても台頭してきています3, 4)。
国産ゲノム編集技術CRISPR-Cas3の開発と応用
DNAを標的とするクラス1タイプI CRISPRには、Cascade複合体に必要な因子数の違いなどから、I-A、I-B、I-C、I-D、I-E、I-F、I-Gなどのサブタイプに分かれています。我々は、これらの中で大腸菌由来のタイプI-E CRISPR-Cas3が真核細胞においてゲノム編集ツールとして効率よく利用できることを明らかにしました5)。興味深いことに、CRISPR-Cas3が導入する変異パターンは、標的認識に必要なプロトスペーサー隣接(PAM)配列の上流側に平均数百から数千塩基ほどの大きな欠失変異を導入するというものでした(図2)。
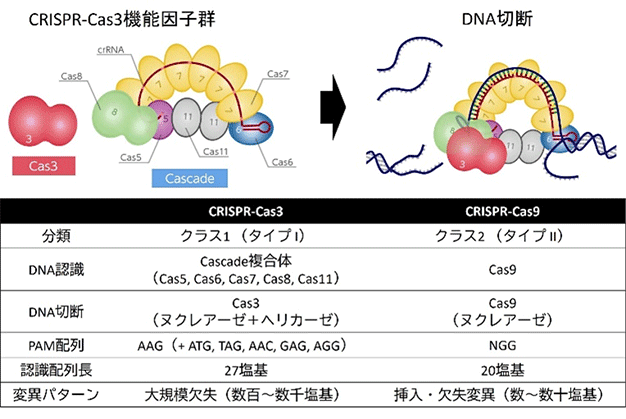
図2.CRISPR-Cas3の特徴とCasとの比較
分子機構を検討した結果、Cas3タンパク質がヌクレアーゼドメインに加えてDNAをほどくヘリカーゼドメインも持ち、二本鎖DNAをほどきながら一本鎖DNAを切断することが明らかになりました6)。これは、主に標的部位に一から数十塩基程度の小さな変異を導入するCRISPR-Cas9とは大きく特徴が異なります。このCRISPR-Cas3独特の特徴は、標的配列を大きく取り除くことに適した新しいゲノム編集技術になると考えられます。加えて、タイプI-EのCascade複合体はPAM配列とその下流27塩基を認識します。この27塩基長は、20塩基を認識するCas9に比べて長いため、より配列特異性が高く安全なゲノム編集技術として医療への応用が期待されています(図2)
CRISPR-Cas3は国産のゲノム編集技術として期待される一方、CRISPR診断と呼ばれる新しい核酸検出法への応用も期待されています7)。代表的なCRISPR診断技術に利用されるCRISPR-Cas12aは、特定のDNA配列を認識したときに、周辺の一本鎖DNAを分解する特性を持ちます。この反応を利用してウイルスの核酸の有無を可視化するDETECTR法が開発されました。我々もCRISPR-Cas3システムがCas12aと同様の特性を持つことを見出し、CRISPR-Cas3を用いた核酸検出法としてCONAN法(Cas3 Operated Nucleic Acid detectioN)を確立しました8)。CONAN法を用いてCOVID-19患者のサンプルで高精度の診断が可能であることも示しています。本方法は特別な診断機器を必要とせず、PCR検査法の感度と抗原検査法の迅速さ、簡便さ、安価さを兼ね備えており、次世代の診断法として社会実装が期待されています。
最後に
CRISPR-Cas9技術は、報告から約10年が経った今では遺伝子治療の承認がされるなど、医療への実用化が着実に進んでいます9)。一方、国産ゲノム編集技術のCRISPR-Cas3も、大規模なゲノム領域の効率的な編集が可能で、ウイルス配列やトランスポゾンの除去、ノンコーディング領域の解析などに利用可能とされています。今後、変異導入効率の改善、細胞内へのデリバリー方法、欠失サイズの制御などの課題を解決していくことで、国産ゲノム編集ツールとしての有用性が高まっていくと想定しています。Nature誌は2022年に引き続き、2023年でも注目すべき7つのテクノロジーの一つとして「CRISPR anywhere」を挙げており10)、ゲノム編集技術は今なお世界中で医療、産業分野に欠かせない技術として活用が進められています。
参考文献
- Sheridan, C. : Nat. Biotechnol., 42, 3 (2024).
- Anzalone, A. V. et al... : Nat. Biotechnol., 38, 824 (2020).
- Pickar-Oliver, A. et al... : Nat. Biotechnol., 37(12), 1493 (2019).
- Cameron, P. et al... : Nat. Biotechnol., 37 (12), 1471 (2019).
- Morisaka, H. et al... : Nat. Commun., 10, 5302 (2019).
- Yoshimi, K. et al... : Nat. Commun., 13, 4917 (2022).
- Kaminski, M. M. et al... : Nat. Biomed. Eng., 5, 643 (2021).
- Yoshimi, K. et al... : iScience, 25, 103830 (2022).
- Doudna, J. A. : Nature, 578, 229 (2020).
- Eisenstein, M. : Nature, 613 (7945), 794 (2023).




