【総説】エポキシ樹脂包埋生物試料のマルチカラーIn-resin CLEM
本記事は、和光純薬時報 Vol.89 No.2(2021年4月号)において、順天堂大学大学院医学研究科 谷田 以誠様、山口 隼司様、角田 宗一郎様、内山 安男様に執筆いただいたものです。
はじめに
光線−電子相関顕微鏡法(Correlative Light and Electron Microscopy ; CLEM)は、同一試料を蛍光顕微鏡および電子顕微鏡で観察し、蛍光顕微鏡による蛍光タンパク質により標識された標的タンパク質・オルガネラの細胞内局在情報(あるいは、標的細胞の組織内位置情報)と電子顕微鏡による超微形態情報を相関し解析する方法である。
近年、超解像蛍光顕微鏡により蛍光タンパク質の局在が1 分子単位で解析できるようになり、CLEM における微細レベルの一致精度は、より厳密になる必要が出てきた。そのため樹脂包埋した生物試料から作成した同一の超薄切片から蛍光顕微鏡と電子顕微鏡で同時観察し、より相関性を高めるIn-resin CLEM の必要性が出てきた。In-resin CLEM においては、理論上は電子線と蛍光波長の差による違い以外は相関性が担保される。
しかしながら、これまでのIn-resin CLEM では、超微形態の保持性が高いエポキシ樹脂ではなく、免疫電子顕微鏡に汎用されるメタアクリルレート系のLowicryl樹脂、アクリル系のLR-white 樹脂やヒドロキシエチルメタクリレート系Technovit 樹脂などを用いた方法であった。そのため、超微形態保持性と汎用性に難があり、エポキシ樹脂包埋試料を用いたIn-resin CLEM が待たれていた。近年、エポキシ樹脂包埋試料のIn-resin CLEM に利用できる蛍光タンパク質として、mEosEM あるいはmKate2-GGGSGL (CLEM-Red)を使った単色In-resin CLEM が報告された1, 2)。
しかしながら、共局在やオルガネラ局在解析など蛍光顕微鏡で汎用されているような細胞生物学的解析のためには、少なくとも2 色以上のマルチカラーIn-resin CLEM が必要である。今回は、緑色蛍光タンパク質および遠赤色蛍光タンパク質を用いて、エポキシ包埋樹脂生物試料を用いたマルチカラーIn-resin CLEM について概説する。
エポン樹脂生物試料での解決すべき問題点
エポキシ樹脂は生物試料の形態保持性に関しては、歴史的・汎用的に超微形態観察に最も適した樹脂の一つである。In-resin CLEM におけるエポキシ樹脂の問題点は、自家蛍光を持つことであった。しかしながら、100nm 厚の超薄切片を作成して自家蛍光を観察すると、緑色の自家蛍光はそれほど強くなかった。おそらく100nm という薄さのためだと考えられる。そこで、エポキシ樹脂包埋試料をブロックのまま観察することは難しくても、エポキシ樹脂包埋試料作成まで緑色蛍光タンパク質の蛍光が保持できれば、超薄切片での緑色蛍光タンパク質の蛍光が観察できる可能性があると考えた。このために、必要な蛍光タンパク質の条件としては、グルタルアルデヒド耐性、四酸化オスミウム処理耐性、エタノールによる脱水耐性、エポキシ樹脂重合反応(60 ℃、72 時間)耐性である。特に四酸化オスミウム処理耐性とエポキシ樹脂重合反応は、蛍光タンパク質にとっては、蛍光を大きく失活させる条件であるため、In-resin CLEMを行うための大きな問題点となっていた。
マルチカラーIn-resin CLEM のために必要な蛍光タンパク質の選定
これまで、エポキシ樹脂包埋試料の In-resin CLEM に使える緑色蛍光を発する蛍光タンパク質として、mEosEM が報告されていた1)。mEosEM はサボテンサンゴ由来のEosFP からの改変タンパク質で光変換可能な蛍光タンパク質mEos4b のエポキシ樹脂耐性変異体である。緑色蛍光として最大励起波長505nm、最大蛍光波長516nm、赤色蛍光として最大励起波長570nm、最大蛍光波長580nm である。エポキシ樹脂内では緑色蛍光を示し、赤色蛍光を示さない、と報告されている。
mEosEM が利用できれば、話は簡単であったが、HeLa 細胞内にmEosEMを発現させて、電子顕微鏡試料作成に必要な固定条件(通常、2 〜4% パラホルムアルデヒド+0.2 〜2.5% グルタルアルデヒド固定液)と四酸化オスミウム処理での緑色蛍光の変化を観察したところ、mEosEM は四酸化オスミウム処理で蛍光が著しく減衰した。少なくとも通常GFP やFITC 観察に用いられている汎用フィルターセットを用いた観察条件では、mEosEM は四酸化オスミウム処理後のエタノールによる脱水処理、エポキシ樹脂重合反応(60℃、48−72 時間)、エポキシ樹脂の自家蛍光のバックグラウンドに対抗できるほどの蛍光強度が保持できないと判断した。
そこで、2.5%グルタルアルデヒド処理後に蛍光強度がmEosEM よりも強く、四酸化オスミウム処理後の蛍光保持率がmEosEM より高い蛍光タンパク質をスクリーニングした。このときに、グルタルアルデヒド固定・四酸化オスミウム処理の際の洗浄液として、HB 溶液を用いた3)。その結果、四酸化オスミウム処理後でも、細胞内で CLEM-Green (CoGFP variant 0)と mWasabi が比較的よく緑色蛍光を保持できていた3, 4)。CLEM-Green は、ウミサボテンから単離された緑色蛍光タンパク質CoGFP の単量体型に改変された亜種で、酸性条件下でも蛍光が強く保持される性質を持つ4)。mWasabiはウミトサカから単離された青緑色蛍光タンパク質cFP484 から改変された単量体型緑色蛍光タンパク質である5)。遠赤色蛍光タンパク質も同様のスクリーニングを行った結果、CLEM-Redに加えて、mCherry2 も四酸化オスミウム処理後でも明るい蛍光を保持できた6)。
エポキシ樹脂包埋試料の作成には、四酸化オスミウム処理後にエタノール脱水、エポキシ樹脂重合反応が必要である。そのために、脱水処理前にできるだけ、蛍光を回復する必要があった。TUK for multicolor 溶液で固定細胞を処理すると、緑色蛍光および赤色蛍光が部分的に回復できたため、この処理を四酸化オスミウム処理後に行うことにした。
これまでにLR-white 樹脂包埋の植物試料でNa2CO3 や蛍光退色防止剤によりGFP の蛍光が回復するとの報告がある7)。しかしながら、Na2CO3 は蛍光がある程度回復するが、数十分−数時間で蛍光が減衰するためにエポキシ樹脂重合反応(60℃、72時間)に耐えられないと判断した。また、蛍光退色防止剤の場合は、蛍光回復以前に、塩の析出と粘性が問題であった。
マルチカラーIn-resin CLEM の実際
CLEM-Green、mWasabi、mCherry2がCLEM-Red 同様にIn-resin CLEMに応用可能か否かを調べるために、それぞれのタンパク質をHeLa 細胞に発現させて、グルタルアルデヒド固定、四酸化オスミウム処理後に、エタノール脱水、エポキシ樹脂重合反応まで行い、100nm 厚の超薄切片を作成し、蛍光顕微鏡によりそれぞれのタンパク質の蛍光が観察されるか否かを調べた。蛍光観察の際には、退色防止剤の代わりに、TUK for multicolor 溶液を用いて観察した。その結果、いずれのタンパク質でも蛍光が観察され、同時に電子顕微鏡を用いて、電子顕微鏡観察が可能であった(図1)。
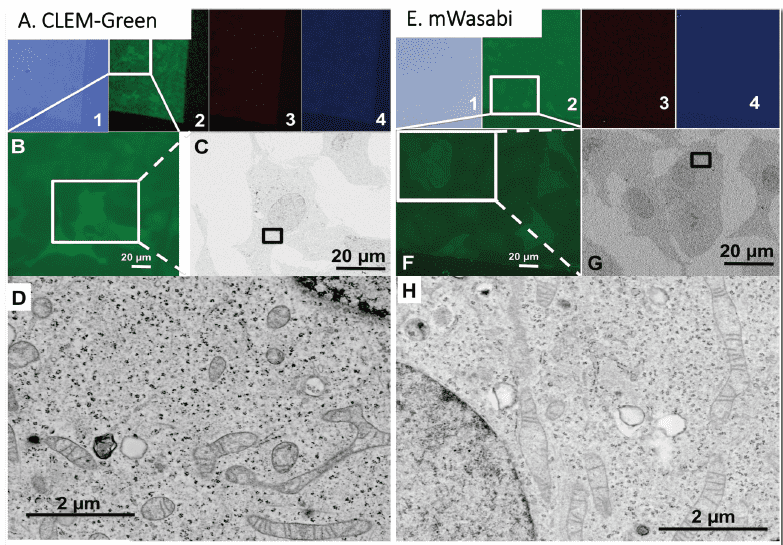

図1. CLEM-Green、mWasabi、mCherry2を用いたエポキシ樹脂包埋細胞のIn-resin CLEM
CLEM-Green (A-D)、mWasabi (E-H)、mCherry2 (I-L)を発現させたHeLa 細胞をエポキシ樹脂に包埋し、100nm 超薄切片を作成し、蛍光顕微鏡および電子顕微鏡で観察した。緑色蛍光フィルターによる観察像(2, B, F)、赤色蛍光フィルターによる観察像(3, J)、青色蛍光フィルターによる観察像(4)、1 は明視野像に蛍光像をマージしたもの。超薄切片中に蛍光を発する細胞が観察できる(B, F, J)。電子顕微鏡観察により、ミトコンドリア、核、小胞体の形態が維持されているのがわかる(D, H, L)。更に、オルガネラ局在型蛍光タンパク質を作成し、これらのタンパク質をHeLa 細胞に発現させ、蛍光タンパク質標識したオルガネラのIn-resin CLEMが可能か否かを調べた。エポキシ樹脂包埋生物試料の100nm 厚の超薄切片において蛍光顕微鏡を用いて、ミトコンドリア(図2および3)、核(図2および4)、小胞体(図3および4)について多色蛍光観察が可能であった。また、同一切片を用いて、電子顕微鏡観察を行ったところ、ミトコンドリア、核、小胞体特有の形態が観察された(図2−4)。
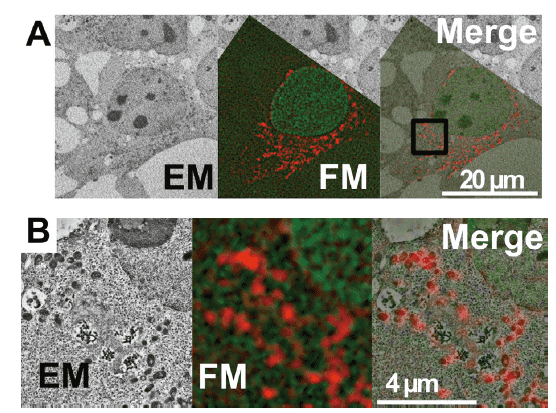
図2. 核局在CLEM-Green とミトコンドリア局在mCherry2 を用いたIn-resin CLEM
核局在CLEM-Green とミトコンドリア局在mCherry2 を発現させたHeLa 細胞を用いたIn-resin CLEM。電子顕微鏡像(EM)と蛍光顕微鏡像(FM)が良い相関を示している(Merge)。B はAの拡大図。-
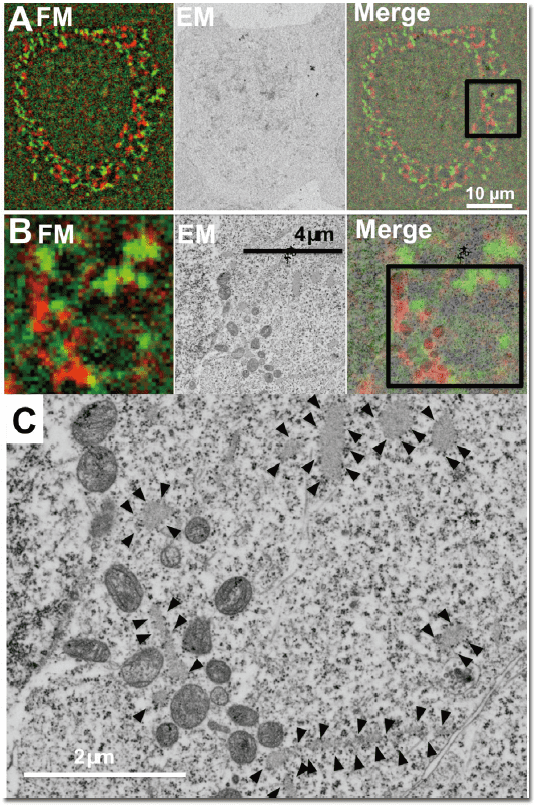
図3. 小胞体局在mWasabi とミトコンドリア局在mCherry2を用いたIn-resin CLEM
小胞体局在mWasabi とミトコンドリア局在mCherry2 を発現させたHeLa 細胞を用いたIn-resin CLEM。電子顕微鏡像(EM)と蛍光顕微鏡像(FM)が良い相関を示している(Merge)( A, B)。C では小胞体(矢頭)の形態が保持されているのがわかる。 -
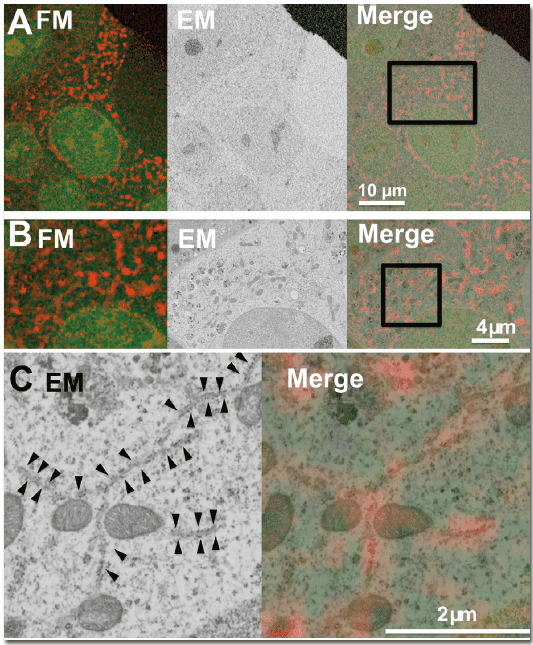
図4. 核局在CLEM-Green と小胞体局在mCherry2 を用いたIn-resin CLEM
核局在CLEM-Green と小胞体局在mCherry2 を発現させたHeLa細胞を用いたIn-resin CLEM。電子顕微鏡像(EM)と蛍光顕微鏡像(FM)が良い相関を示している(Merge)。C では赤色蛍光に対応する位置の小胞体(矢頭)の形態が保持されている。
培養細胞において、小胞体の超微形態は形態保持が難しいオルガネラであるが、きちんと形態保持されていた。これらの蛍光シグナルと電子顕微鏡像を相関させると、良い相関性が得られた。このことは、緑色蛍光タンパク質と遠赤色蛍光タンパク質を用いてエポキシ樹脂包埋生物試料を用いたマルチカラーIn-resin CLEMが可能となったことを示している。
おわりに
このように緑色蛍光および赤色蛍光タンパク質を用いて、エポキシ樹脂包埋試料を用いたマルチカラーIn-resin CLEM が可能となった。同一切片を用いて、蛍光顕微鏡像と電子顕微鏡像を観察するため、CLEM の相関精度は、飛躍的に上昇した。理論的には電子線と光線の波長の違いによる歪みに限定される。また、蛍光シグナルのZ軸最大分解能が超薄切片の厚みに限定されるために、3D In-resin CLEM への応用が現実的になってきた。
マルチカラーIn-resin CLEM と称したが、まだ2色の蛍光タンパク質が利用できたにすぎない。CLEM-Green、mWasabi、mCherry2、CLEM-Red に共通の因子が何かわかれば、In-resin CLEM に利用できる蛍光タンパク質をより効率的にスクリーニングできるのであるが、共通因子は未だ不明である。青色−シアン系蛍光タンパク質もこれまでのところ、エポキシ樹脂包埋試料を用いたIn-resin CLEM に利用可能な蛍光タンパク質は見つかっていない。エポキシ樹脂の自家蛍光が少ないと思われる遠赤外に近い遠赤色(680nm − 720nm)の蛍光を持つ蛍光タンパク質も、多くは四酸化オスミウムに感受性のものばかりであった。今後、エポキシ樹脂包埋試料を用いたIn-resin CLEM に利用可能な新しい青色−シアン系あるいは遠赤外系蛍光タンパク質が発見されることを期待している。
参考文献
- Fu, Z. et al. : Nat. Methods, 17 (1), 55 (2020). DOI: 10.1038/s41592-019-0613-6
- Tanida, I. et al. : Sci. Rep., 10 (1), 11314 (2020). DOI: 10.1038/s41598-020-68191-z
- Tanida, I. et al. : Sci. Rep., 10 (1), 21871 (2020). DOI: 10.1038/s41598-020-78879-x
- Ogoh, K. et al. : Luminescence, 28 (4), 582 (2013). DOI: 10.1002/bio.2497
- Ai, H. et al. : BMC Biol., 6, 13 (2008). doi: 10.1186/1741-7007-6-13
- Shen, Y. et al. : PLoS One, 12 (2), e0171257 (2017). DOI: 10.1371/journal.pone.0171257
- Toyooka, K. et al. : Microscopy, 68 (5), 417 (2019). DOI: 10.1093/jmicro/dfz029
キーワード
CLEM
Correlative Light and Electron Microscopy の略で、光線-電子相関顕微鏡法とも呼ぶ。同一試料を光学顕微鏡と電子顕微鏡を用いて観察し、それぞれの像を比較することにより、細胞内における細胞小器官・細胞分子の局在および形態を解析する手法である。通常のCLEM では蛍光観察した後に電子顕微鏡試料用の固定を行い、四酸化オスミウム処理、エタノール脱水処理、エポキシ樹脂包埋を行うため、電子顕微鏡観察前に化学的・物理的に形態的歪みが生じる。このため、局所観察に限定され、画像もデジタル的補正が必要になる。
In-resin CLEM
通常のCLEM が蛍光顕微鏡観察と電子顕微鏡観察を樹脂包埋前後に行うのに対し、In-resin CLEM では、同一超薄切片で蛍光顕微鏡観察と電子顕微鏡観察を行うために、化学的・物理的に形態的歪みを避けることができる。
エポキシ系樹脂
電子顕微鏡で生物試料を観察する場合に最も汎用される樹脂である。細胞内小器官を超微形態観察するのに適している。おもにEpon812 が汎用されている。
Lowicryl 樹脂、LR-white 樹脂、Technovit 樹脂
いずれもエポキシ樹脂とは異なり水溶性樹脂。低温重合も可能であるため、抗原となるタンパク質の変性を抑制する可能性があり、樹脂内での免疫反応が可能となるため、免疫組織染色や免疫電子顕微鏡用の試料作成に汎用される。エポキシ樹脂に比べて、柔らかい傾向がある。




